2020-12-10 国立精神・神経医療研究センター
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所RI管理室の松坂恭成研究員および橋戸和夫室長らの研究グループは、エクソソーム形成1)、スフィンゴミエリン分解、セラミド2)合成などに関わるnSMase2/Smpd3遺伝子がデュシェンヌ型筋ジストロフィー(以下、DMDと略す)の骨格筋壊死の改善やストレス応答に関わることを明らかにしました。
DMDは、X染色体短腕(Xp21)上に存在するジストロフィン遺伝子の突然変異が原因で発症する進行性の筋肉の病気です。DMD患者は5歳以後緩徐に運動能力の低下が進行し、10歳頃に車椅子生活となり15歳頃に寝たきり状態に、20歳前後で呼吸障害や心不全で死に至りますが、現在根本的な治療法は確立されていないのが現状です。
nSMase2/Smpd3遺伝子がコードするSmpd3タンパク質(以下、Smpd3と略す)は、細胞膜上でスフィンゴ脂質をセラミドに加水分解する酵素で、エクソソーム形成や細胞内膜輸送、受容体からの情報伝達など多様な細胞内反応に関わり、赤血球の分化、脳における記憶形成、腫瘍の増殖などの生命現象において重要な役割を果たすことが知られています。一方で、Smpd3は骨格筋にも存在するものの、その骨格筋における働きや、DMDの病気の進行との関連はわかっていませんでした。
このたび、橋戸・松坂らの研究グループは、DMDの進行によって変化するmicroRNAs3)がエクソソーム内に含まれることに着目して、エクソソーム産生に関わるSmpd3遺伝子についての研究を行いました。そこで、DMDのモデルマウスにおいて、Smpd3遺伝子をノックアウトしてその機能を阻害すると、(1)過剰な炎症作用、(2)筋細胞のアポトーシス、(3)筋幹細胞の分化、などのDMDに特徴的な異常な筋病理像が全て改善され、骨格筋の筋膜損傷や筋力、運動能力も改善することが観察されました。このことから、DMD病態進展には、Smpd3遺伝子が関わっていること、さらにはSmpd3によるエクソソーム放出が関わっていることが明らかになりました。また、DMDモデルマウスにおける不安様行動もSmpd3遺伝子のノックアウトによって軽減されたことから、エクソソームによるmicroRNAsの脳への伝播がDMDにおける脳症状に関与している可能性が示唆されました。これは、DMDが単なる筋肉の病気ではなく、microRNAが血液を介して全身を循環するという「循環RNA疾患」である、という新しい疾患概念につながるものです。
今回の成果によって、DMD病態進展に関わる新たな分子機構である「臓器間のネットワーク」が明らかにされただけでなく、この難治性疾患の新たな創薬のターゲットが発見されたと言えます。
本研究成果は日本時間2020年11月20日に、英国のオンライン総合学術雑誌「BMC Medicine」に掲載されました。
研究の背景
DMD患者の骨格筋では、細胞膜の裏打ちを行う細胞骨格タンパク質であり細胞膜の安定化および筋肉の収縮・弛緩からの筋細胞に対する保護的な役割を果たすジストロフィンの働きの異常により筋細胞膜がもろく弱くなり、さらにそれにともない細胞の外側から流れ込んだカルシウムによるプロテアーゼの活性化およびミトコンドリアの働きの異常によって筋繊維の壊死を引き起こします。この壊死した筋繊維は炎症細胞によって除去され、筋幹細胞4)から筋肉繊維を作り出す分化過程によって筋肉の再生が促進されます。一方、慢性的な筋繊維の壊死により過剰な炎症反応が引き起こされ筋幹細胞の分化と筋肉細胞の枯渇を防ぐための筋幹細胞自体の増殖のバランスが崩れることにより筋肉の再生能力が低下し、さらには運動能力をもつ筋繊維が結合繊維や脂肪に置き換えられてしまい、筋肉の委縮および筋力の低下を引き起こすことが病態メカニズムのひとつと考えられていました。さらに最近、上記のジストロフィンの細胞構造を保つ働きに加えて、筋幹細胞の分裂および増殖に係る新たな機能が報告されました(文献1)。一般に健全な筋幹細胞では、筋肉の損傷などの刺激によって筋幹細胞の分化や筋繊維の生成が促進され筋肉の再生が行われます。それと同時に筋幹細胞自体の自己増殖が起こり筋幹細胞の枯渇を防止しています。この報告によるとジストロフィンの働きを欠損した筋幹細胞では自己増殖を行う筋幹細胞が異常に増殖し、一方、筋幹細胞の分化によって生成される筋細胞が減少することが明らかになりました。また、ジストロフィンと結合して糖タンパク複合体を形成することによって、筋細胞膜の強度を維持する重要な働きを担っているジストログリカンを筋繊維でのみ欠損させたマウスでは、DMDのような筋肉の壊死は観察されませんでしたが、一方、筋幹細胞でのみこのジストログリカンを欠損させたマウスでは、DMDと似た筋肉の再生が遅れることが報告されました(文献2)。このようなことから、DMDにおける骨格筋の壊死は筋細胞膜がもろく弱くなることだけでなく、筋幹細胞の分化・自己増殖のバランスも重要であることを示唆しています。しかしながら、筋幹細胞の働きとDMDの病気の進行に関わる分子メカニズムについては完全には明らかにされていませんでした。また、DMDは骨格筋の壊死に加えて、脳内でのジストロフィンの欠損により精神遅滞などの症状を合併することが知られていましたが、この分子病態についても不明なままでした。
一方、筋幹細胞の増殖・分化さらには筋肉の再生を制御する分子として骨格筋に豊富に存在するいくつかのmicroRNAsが報告されました(文献3)。これらのmicroRNAsは筋肉の損傷などの刺激によってその量が増加し、筋幹細胞の増殖・分化を制御する主要な調節タンパク質量を調節しています。さらに、これらのmicroRNAs量はDMDの病状の進行度合いに関係した増減パターンで血液中に分泌されることも報告されました(文献4)。そこで、これらのmicroRNAs を包み込んで血液中に分泌する細胞外小胞であるエクソソームに着目し、DMDモデルマウスであるmdxマウスを用いて、エクソソーム分泌を抑制したときのDMD病態に迫りました。
研究の概要
Neutral sphingomyelinase 2/Sphingomyelin phosphodiesterase 3 (nSMase2/Smpd3)は、スフィンゴミエリンの加水分解を行う細胞膜に結合する酵素で、細胞内の膜輸送や受容体の細胞膜上での移動、受容体からの情報伝達など様々な細胞内反応に関わっていることが分かっていました。さらに、腫瘍壊死因子-やインターロイキン-1, インターフェロンなどの炎症性サイトカインによって活性化され、細胞内のカルシウム依存的なカスパーゼ12やカルパインの活性化を行う働きを持っており、さらにマクロファージの組織内への浸潤にも関与することが知られていました。
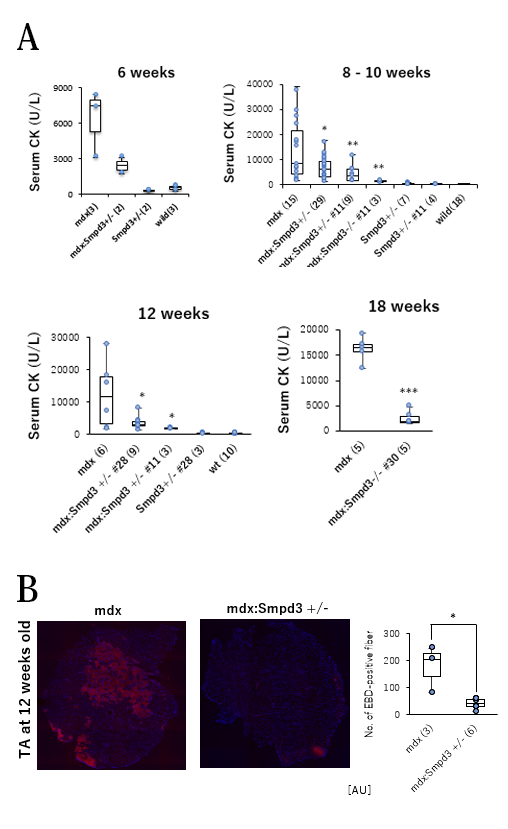
今回の研究で橋戸・松坂らの研究グループは、Smpd3遺伝子を改変したマウス(ノックアウトマウス)を作製し、さらにジストロフィンを欠損するmdxマウスとの交配によってSmpd3欠損mdxダブルノックアウト(以下、Smpd3:mdx DKOと略す)マウスを作出しました。このDKOマウスでは、骨格筋において炎症性サイトカイン量が低下することや、さらに炎症反応を起こしている筋肉部分が低下することを見出しました(図1)。さらに、DMD病態の一つである骨格筋細胞膜の弱さの変化を調べるために、Smpd3:mdx DKOおよびmdxマウスの血清を用いて筋損傷のバイオマーカーであるクレアチンキナーゼ(以下、CKと略す)活性を測定しました。その結果、DMD病態の初期においてmdxマウスと比べてSmpd3:mdx DKOマウスのCK値が低下することを見出しました(図2A)。さらに、損傷した組織内へ取り込まれることによって
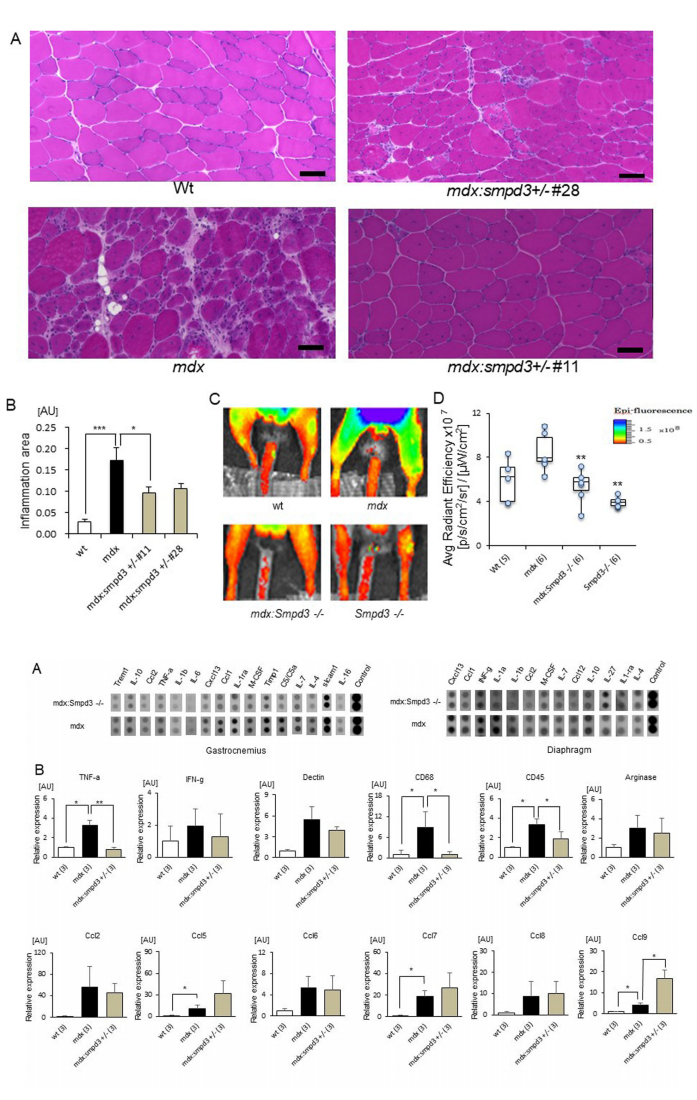
【図1】Smpd3:mdx遺伝子変異DKOマウス骨格筋に見られる炎症軽減
【図2】Smpd3:mdx遺伝子変異DKOマウス骨格筋に見られる膜損傷の軽減
筋肉の損傷レベルを可視化するエバンスブルー (以下、EBDと略す)色素を用いてSmpd3:mdx DKOおよびmdxマウスの骨格筋の筋肉損傷について調べました。その結果、mdxマウスと比べてSmpd3:mdx DKOマウスの骨格筋においてEBD染色領域が低下することを見出しました(図2B)。それらの結果は、Smpd3活性の抑制によって、DMD病態における骨格筋組織の損傷が軽減されることを示唆しています。また、DMD病態の特徴のひとつである進行性の運動力の低下について調べるために、Smpd3:mdx DKOおよびmdxマウスの握力について調べました。その結果、mdxマウスと比べてSmpd3:mdx DKOマウスの握力の増加が観察されました(図3A)。さらにまた、トレッドミル歩行試験を用いて歩行耐久力についても調べた結果、mdxマウスと比べてSmpd3:mdx DKOマウスの歩行耐久時間が増加することが観察されました(図3B)。これらの結果は、Smpd3活性がDMD病態の運動力低下にも関与することを示唆しています。
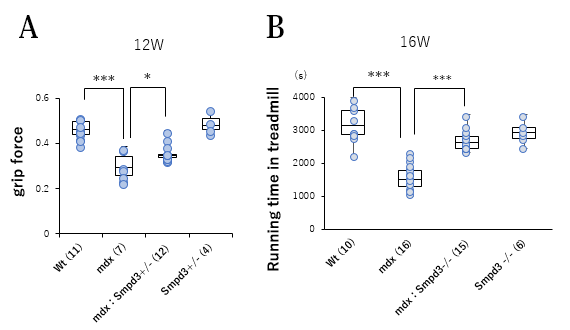
【図3】Smpd3:mdx遺伝子変異DKOマウスの筋力・運動能力の改善
さらに、DMDの筋肉の損傷に対する筋肉の再生過程において、筋幹細胞から筋細胞を作り出す過程である分化とDMD病態との関連性について調べるため、筋芽細胞分化マーカーとして脳由来神経栄養因子5)(brain-derived neurotrophic factor: 以下、BDNFと略す)の細胞内の量的な変化について調べました。筋芽細胞C2C12を分化誘導させた場合、細胞内のSmpd3量は分化誘導にともなって上昇しますが、逆にBDNFは分化3日目以降からその量が低下していきます(図4A)。また、Smpd3:mdx DKOおよびmdxマウスの骨格筋におけるBDNF量を調べた結果、野生型マウスに比べてmdxマウスではBDNF量が増加しているのに対して、Smpd3:mdx DKOマウスではmdxマウスと比べてBDNF量が低下していることを見出しました(図4B)。これらの結果は、Smpd3が、筋芽細胞の分化過程に関与することを示唆しています。
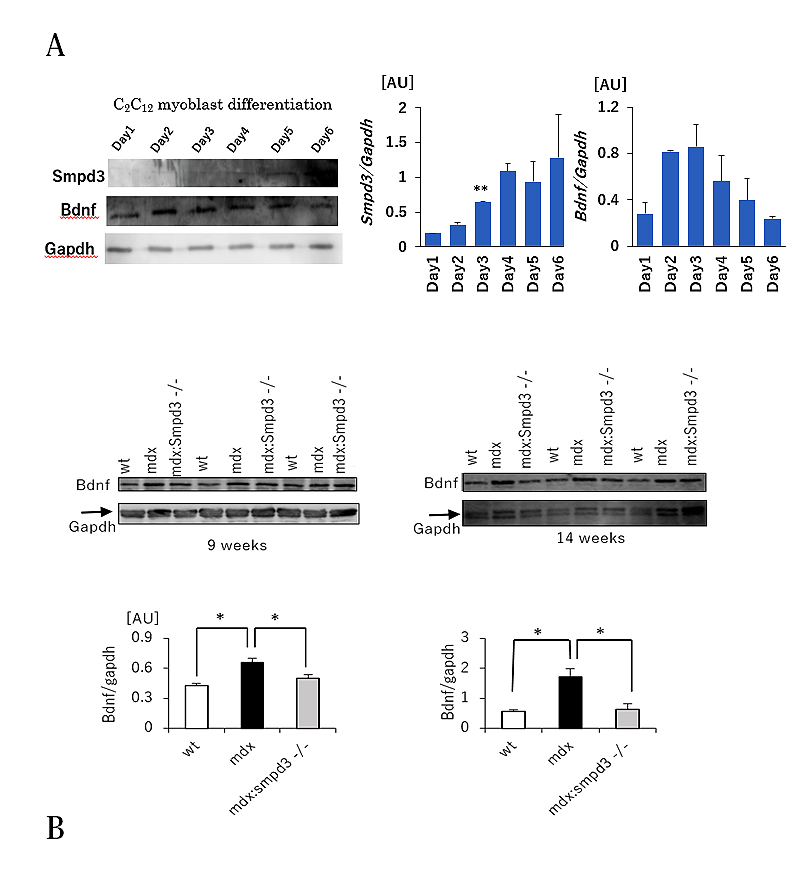
【図4】Smpd3:mdx遺伝子変異DKOマウスの筋幹細胞分化誘導の改善
また、DMDの骨格筋における細胞死について調べるために、Smpd3:mdx DKOおよびmdxマウスの腓腹筋(GAS)および前脛骨筋(TA)におけるカスパーゼの活性を測定しました。その結果、mdxマウスと比べてSmpd3:mdx DKOマウスのカスパーゼ-3活性の低下が観察されました(図5)。さらに骨格筋における筋肉の再生および細胞死に関係するmicroRNA量を調べた結果、Smpd3:mdx DKOマウスにおいて回復傾向が観察されました(図6)。これらの結果は、Smpd3がDMD病態における筋肉細胞の細胞死と関与することを示唆しています。
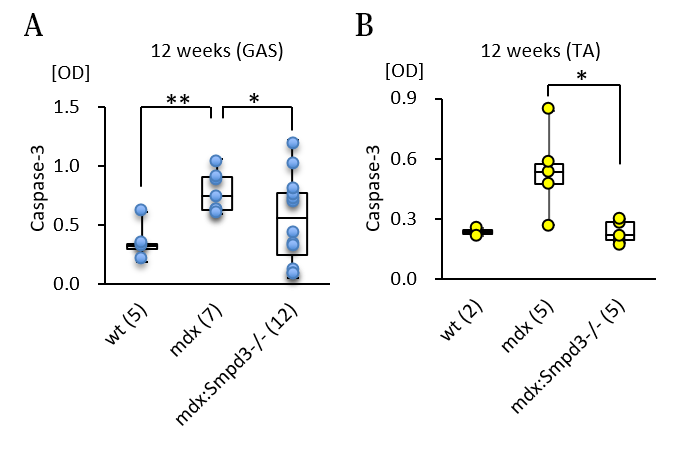
【図5】Smpd3:mdx遺伝子変異DKOマウスの腓腹筋(A)および前脛骨筋(B)における細胞死
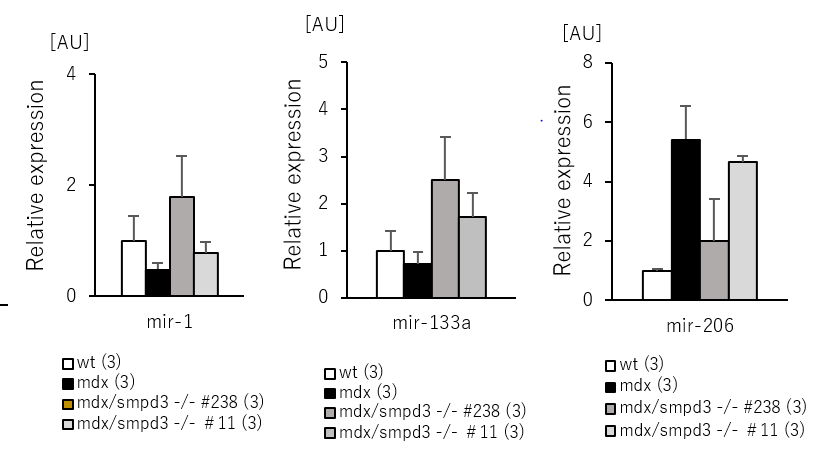
【図6】Smpd3:mdx遺伝子変異DKOマウスの骨格筋におけるmicroRNA量の回復
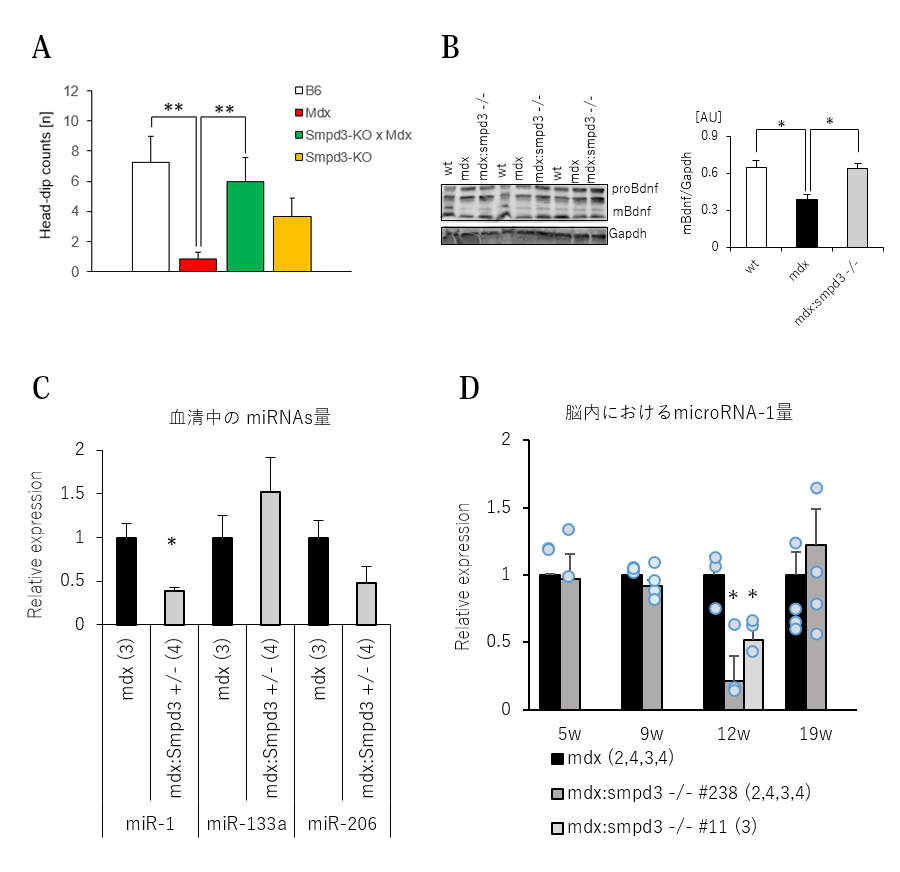
【図7】Smpd3:mdx遺伝子変異DKOマウスのストレス応答情動行動の改善
さらにまた、Smpd3:mdx DKOおよびmdxマウスのストレスに対する反応について調べるために、ホールボード試験を行いました。この試験では、マウスを床面に数
か所穴を設けた実験装置に放置し、穴を覗き込む(head-dip)回数を測定することにより恐怖・不安に対する行動変化を観察しました。その結果、mdxマウスでは穴を覗き込む探索行動が野生型マウスと比べて低下しているのに対してSmpd3:mdx DKOマウスではこの探索行動の回数が野生型マウスと同程度まで回復していることを見出しました(図7A)。さらに、恐怖記憶などとの関連性が知られているBDNFについても脳内の量を調べた結果、野生型マウスと比べてmdxマウスのBDNF量も低下しているのに対して、Smpd3:mdx DKOマウスでは野生型マウスと同程度まで改善していることを見出しました(図7B)。さらに、BDNF量を調節する働きが知られているmicroRNA-1がmdxマウスと比べてSmpd3:mdx DKOマウスの血液中で減少し、さらに脳内におけるmicroRNA-1量もmdxマウスと比べてSmpd3:mdx DKOマウスで低下することを見出しました(図7C,D)。これらの結果は、Smpd3がDMD病態におけるストレス反応にも関与することを示唆しています。
本研究から、Smpd3遺伝子がDMD病態において炎症反応や筋細胞膜のもろさ弱さ、筋幹細胞の分化およびストレス反応など様々な病気の進行に関与することが明らかとなりました。さらに、microRNA-1およびmicroRNA-133aは筋幹細胞の分化や自己増殖を調節するタンパク質量を制御することやmicroRNA-206は筋肉の再生を行うタンパク質量を制御すること知られており、エクソソームを仲介したこれらのmicroRNA量の調節がDMDの新な治療法確立の基盤となることが期待されます。
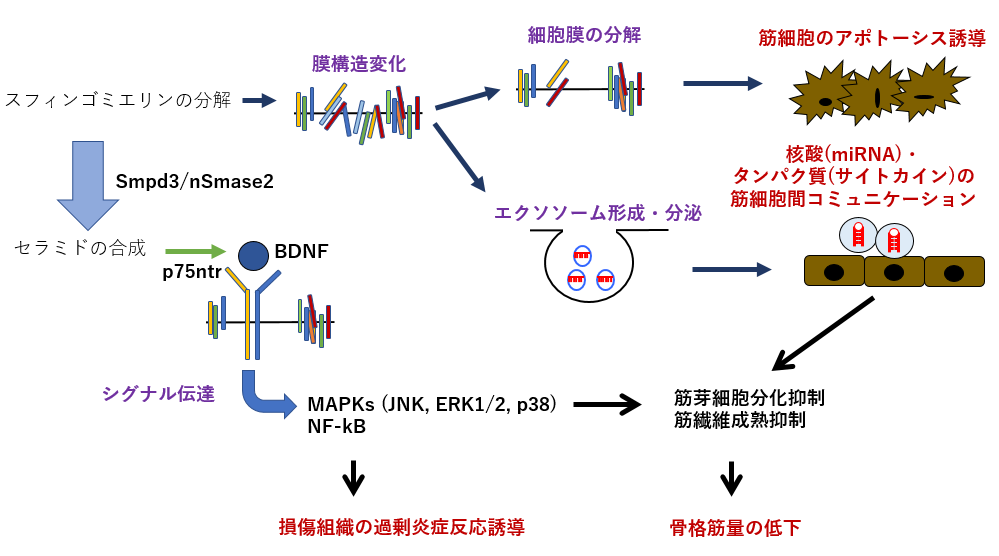
【図8】nSMase2/Smpd3遺伝子の予想されるDMD病態機構
今後の展望
上記のように、Smpd3遺伝子はDMD病態の様々な過程において関わることが明らかになりました(図8)。しかしながら、Smpd3は生体内で多様な機能を果たしていますが、これらのどの機能がどのようにDMD病態のどの場面で作用しているのかは未だ不明なままです。Smpd3がどの組織・細胞でどのような機能によってDMD病態を制御しているのかを明らかにすることによって、DMD病態の全貌を捉えられる可能性があり、より効果的で安全性の高い治療法の確立につなげることができると大いに期待されます。
用語の説明
1)エクソソームは細胞から分泌される直径50-150nmの顆粒状の膜小胞で、内部には核酸(microRNA, mRNA, DNAなど)やタンパク質などの細胞内物質を含み、細胞が細胞外の物質を取り込む機構の一種であるエンドサイトーシスにより細胞内にできたエンドゾームがさらに陥入することで作られ、細胞外に放出される。
2)セラミドはスフィンゴ脂質の一種であり、スフィンゴシンと脂肪酸がアミド結合した化合物群で、脂質二重膜を構成する主要な脂質である。
3)microRNAsはゲノム上にコードされる20-25塩基長の微小RNAとなる機能性核酸で遺伝子の発現調節を行う。
4)筋幹細胞(あるいはサテライト細胞)は、筋繊維の基底膜と形質膜の間に存在する単核細胞であり、損傷などの刺激により活性化して筋芽細胞さらには筋細胞へ分化する。
5)脳由来神経栄養因子は標的細胞表面上にある受容体TrkBに結合し、神経細胞の生存・成長・シナプスの機能亢進などの神経細胞の成長を調節する液性タンパク質で、筋芽細胞の増殖・分化に関わるmiR-1およびmiR-206によって発現が調節される。
原著論文情報
・論文名:The nSMase2/Smpd3 gene modulates the severity of muscular dystrophy and the emotional stress response in mdx mice
・著者:Yasunari Matsuzaka, Jun Tanihata, Yoshiko Ooshima, Daisuke Yamada, Masayuki Sekiguchi, Shouta Miyatake, Yoshitsugu Aoki, Mika Terumitsu, Ryu Yashiro, Hirofumi Komaki, Akihiko Ishiyama, Yasushi Oya, Yukiko U. Inoue, Takayoshi Inoue, Shin’ichi Takeda, and Kazuo Hashido.
・掲載誌: BMC Medicine
・doi: 10.1186/s12916-020-01805-5
・https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-020-01805-5
参考文献
1)Dumont NA, Wang YX, von Maltzahn J, Pasut A, Bentzinger CF, Brun CE, Rudnicki MA. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nat Med. 2015;21(12):1455-63. doi: 10.1038/nm.3990.
2)Cohn RD, Henry MD, Michele DE, Barresi R, Saito F, Moore SA, et al. Disruption of DAG1 in differentiated skeletal muscle reveals a role for dystroglycan in muscle regeneration. Cell. 2002;110:639–48. doi:10.1016/s0092-8674(02)00907-8.
3)Roberts TC, Blomberg KE, McClorey G, Andaloussi SEL, Godfrey C, Betts C, et al. Expression analysis in multiple muscle groups and serum reveals complexity in the microRNA transcriptome of the mdx mouse with implications for therapy. Mol Ther Nucleic Acids. 2012;1:e39. doi:10.1038/mtna.2012.26.
4)Cacchiarelli D, Legnini I, Martone J, Cazzella V, D’Amico A, Bertini E, Bozzoni I.
miRNAs as serum biomarkers for Duchenne muscular dystrophy. EMBO Mol Med. 2011;3(5):258-65. doi: 10.1002/emmm.201100133.
研究経費
本研究結果は、国立精神・神経医療研究センター精神・神経疾患研究開発費の支援を受けて行われました。
お問い合わせ先
【研究に関するお問い合わせ】
国立精神・神経医療研究センター
神経研究所ラジオアイソトープ管理室
橋戸和夫
【報道に関するお問い合わせ】
国立精神・神経医療研究センター 総務課広報係