2021-02-16 東京大学,金沢大学,京都大学,日本医療研究開発機構,科学技術振興機構
ポイント
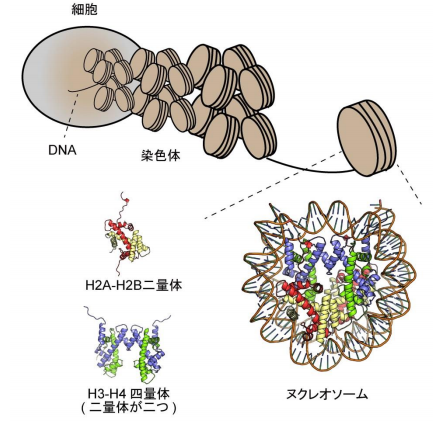
- 精子形成に重要なヒストンたんぱく質H2A.BによるDNA折りたたみ構造を、高速原子間力顕微鏡解析により世界で初めて解明しました。
- H2A.Bは「開いた」ヌクレオソーム構造を取ること、そして主要型のヒストンH2Aと自発的に置き換わることを発見しました。
- H2A.Bの欠損は精子形成異常に関与することから、この新たな折りたたみのメカニズムの知見は精子形成障害の原因解明や治療法確立へ向けて応用されることが期待されます。
東京大学 大学院理学系研究科 生物科学専攻の平野 里奈 大学院生、東京大学 定量生命科学研究所 クロマチン構造機能研究分野の胡桃坂 仁志 教授らの研究チームは、金沢大学 ナノ生命科学研究所の柴田 幹大 准教授、京都大学 複合原子力科学研究所の杉山 正明 教授らとの共同研究で、精子形成に重要なヒストンたんぱく質H2A.Bが、DNA折りたたみの基盤構造であるヌクレオソームをダイナミックに構造変換する様子を世界で初めて解明しました。
精子の形成過程では、DNAの折りたたみによって形成される染色体構造が大きく変化していきます。染色体の基本単位であるヌクレオソームは、ヒストンたんぱく質がDNAに巻き付くように結合した円盤状の構造体です。精子形成時には、ヒストンバリアントであるH2A.Bが発現して、染色体におけるDNA折りたたみ構造の変換に重要な役割を果たすと考えられていましたが、H2A.Bの機能についてはまだ不明な点が多く残されていました。
H2A.Bヌクレオソームの性質の動態を明らかにするためには、解析に必要な大量かつ高純度のヌクレオソームを調製する必要があります。そこで、本研究チームは、精製したヒストンとDNAをもとに、H2A.Bを含むヌクレオソームを試験管内で再構成し、その動態を生化学的解析、高速原子間力顕微鏡解析、そしてX線小角散乱解析によって解明しました。具体的には、H2A.Bを含むヌクレオソームが、ヒストンの複合体の一部が解離したような「開いた」構造を取ること、そしてH2A.Bが主要型のヒストンH2Aと自発的に置き換わるという特異的な性質を持つことを明らかにしました。これらのことから、H2A.Bを含むヌクレオソームが「開いた」構造を取ることで主要型ヒストンが結合しやすくなり、H2A.Bが押し出されてヒストンが置き換わると考えられました。
本研究で得られた知見は精子形成メカニズム解明に必要不可欠な基盤を提供するものであり、精子形成障害のメカニズムの解明・治療へつながることが期待されます。
本研究成果は、2021年2月12日(現地時間)に「Communications Biology」のオンライン版で公開されました。
本研究は、日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂 仁志、JP20am0101076)、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂 仁志、JP18H05534)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂 仁志、JPMJER1901)の支援を受けて実施されました。
- “Histone variant H2A.B-H2B dimers are spontaneously exchanged with canonical H2A-H2B in the nucleosome”
- DOI:10.1038/s42003-021-01707-z
<研究に関すること>
胡桃坂 仁志(クルミザカ ヒトシ)
東京大学 定量生命科学研究所 教授
科学技術振興機構 研究プロジェクト推進部
<報道担当>
東京大学 定量生命科学研究所 総務チーム
科学技術振興機構 広報課