細胞膜の突起の切断により生成、細胞の移動を速める
2021-03-23 奈良先端科学技術大学院大学,科学技術振興機構
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域の末次 志郎 教授の研究グループは、老化やがんなどの生体情報の伝達を担うことで注目されている「細胞外小胞」という脂質膜の微粒子について、細胞表面で突起した生体膜がちぎれて生み出されるという新たな機構を明らかにしました。
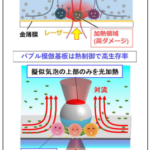
細胞外小胞は、老化やがんなどのさまざまな疾患に伴い、その量が増減することから、バイオマーカーなどの用途が期待されています。しかし、この細胞外小胞が形成される仕組みについては、細胞内に蓄積された後に、外部に放出される機構など、わずかなパターンしか知られておらず、十分に説明することができません。また、この不明瞭さの原因の1つには、頂端側の細胞表面(細胞の上部)は高精度の観察が困難であり、細胞全体を俯瞰して細胞外小胞の放出を観察することが困難であったこということがあります。
末次教授らは、細胞の脂質膜(生体膜)の微細な形作りを担うBARドメインと呼ばれるたんぱく質モジュール(集合体)の研究を行ってきました。BARドメインたんぱく質は、生体膜上で集まり、ブロックのように固有の形態を作ることで、生体膜の形を制御します。すでに末次教授らは、細胞突起については、BARドメインの一種であるI-BARドメインによる細胞膜の変形によっても生じることを明らかにしています。細胞突起はこれまでに、細胞の移動のための構造であると考えられていましたが、細胞間の情報伝達を担うとは考えられていませんでした。
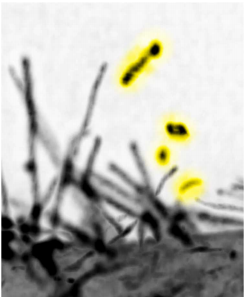
本研究では、細胞膜の変形によって生じた細胞突起が、毛細血管の圧力相当の生体内で通常に観察できる程度の外力により切断されて、細胞外小胞となることを見いだしました。高解像度の蛍光顕微鏡である「格子光シート顕微鏡」などを用いて細胞突起がちぎれる瞬間を捉え、さらに、細胞の頂端側を含む細胞の全表面からの小胞放出の頻度と外力の指標の相関を測定することで証明しました。また、見いだした細胞外小胞は、これを受け取った細胞の移動能力を増強させることや、これまでに知られていた形成機構による細胞外小胞とは含まれるたんぱく質の種類などが異なることが分かりました。
細胞外小胞の形成機構の解明により、老化やがんとの関わりや、類似の機構とみられるウイルス小胞の放出(産生)機構の解明に向けた基礎知識を提供することができたと考えられます。
本研究成果は2021年3月23日(日本時間)、国際科学誌「Developmental Cell」に掲載されます。
本研究成果は、JST 戦略的創造研究推進事業 CREST 研究領域「計測技術と高度情報処理の融合によるインテリジェント計測・解析手法の開発と応用」における研究課題「高精度時空間計測による多元細胞情報統合」(研究代表者:清末 優子)、科学研究費補助金 基盤研究(B)、基盤研究(C)、新学術領域研究「リポクオリティ」、上原生命科学記念財団などの支援によって得られました。
- “Filopodium-derived vesicles produced by MIM enhance the migration of recipient cells”
(MIMたんぱく質による細胞突起(フィロポディア)由来小胞は、受容細胞の細胞運動を亢進する) - DOI:10.1016/j.devcel.2021.02.029
<研究に関すること>
末次 志郎(スエツグ シロウ)
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域 分子医学細胞生物学研究室 教授
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
<報道担当>
奈良先端科学技術大学院大学 企画総務課 渉外企画係
科学技術振興機構 広報課