2019-05-27 東邦大学,日本医療研究開発機構
東邦大学の中野 裕康教授の研究グループは、新たに開発した遺伝子改変マウスを用いて、ネクロプトーシスと呼ばれる新しいタイプの細胞死が、胎児期の小腸上皮細胞で生じることにより、重篤な小腸炎を発症することを明らかにしました。この成果は、ヒト新生児で発症する重篤な壊死性腸炎の発症メカニズムの解明や新たな治療法の開発につながることが期待されます。
この成果は5月24日に米国の科学誌iScienceにて掲載されました。本研究は兵庫医科大学 大村谷 昌樹主任教授、順天堂大学 内山 安男特任教授、名古屋大学 木山 博資教授、熊本大学 荒木 喜美教授らとの共同研究により、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「NASHにおける肝リモデリングを制御する細胞間相互作用の解明と革新的診断・治療法創出への応用」(研究開発代表者:田中 稔)の一環で行われました。
発表者名
中野 裕康(東邦大学医学部生化学講座 教授)
発表のポイント
- ネクロプトーシスと呼ばれる新しいタイプの細胞死が胎児の小腸で生じる遺伝子改変マウスを開発しました。
- そのマウスでは、ネクロプトーシスを起こした小腸上皮細胞が特殊なリンパ球を活性化し、その活性化されたリンパ球の分泌するサイトカインが小腸上皮細胞にアポトーシスを誘導し、重篤な小腸炎を生じることを見出しました。
- ヒト新生児、特に未熟児が時に壊死性腸炎と呼ばれる重篤な病気を発症することが知られています。今回のマウスモデルを用いた研究成果により、その原因の解明や新たな治療法の開発につながる可能性が示されました。
概要
最近の研究から、細胞の死に方の違いにより、その後に起こる反応が異なってくることが分かってきました。ネクロプトーシス(注1)と呼ばれる新しいタイプの細胞死は、早期に細胞膜が破裂して細胞が死ぬために、周囲に強い炎症を誘導すると考えられています。しかし、ネクロプトーシスで細胞が死んだ後に、周囲の組織でどのような生体応答が誘導されるかは十分に解明されていませんでした。そこで、東邦大学の中野教授らは、cFLIPs(注2)と呼ばれるネクロプトーシスを誘導する遺伝子を過剰に発現する (cFLIPs Tg) マウスを開発して、ネクロプトシスの後に誘導される応答について解析しました。その結果このマウスでは、生まれる前から重篤な小腸炎を発症し、一部のマウスは子宮内で死亡していることがわかりました。
その原因を解析したところ、ネクロプトーシスを起こした少数の小腸上皮細胞が特殊なリンパ球を活性化し、活性化したリンパ球があるサイトカイン(注3)を産生し、残りの大多数の小腸上皮細胞にアポトーシス(注4)を誘導することで、小腸炎を生じさせていることが明らかとなりました。
一方で、このマウスの体内から特殊なリンパ球や特定のサイトカインを除去することで、小腸炎が改善し、マウスの生存率も大幅に改善することも明らかとなりました。このマウスの小腸炎の組織像は、ヒト新生児に見られる壊死性腸炎(注5)に類似していたことから、今回の成果は、ヒト新生児に見られる壊死性腸炎の原因の解明や新たな治療法の開発につながることが期待されます。
発表内容
本研究の背景
私たちの体を正常に保つためには、一部の細胞が適切に死ぬ(注6)ことが重要ですが、細胞死が過剰に起こると様々な病気を発症すると考えられています。また、アポトーシスと呼ばれる計画的細胞死がよく知られていますが、近年その他の細胞死も存在することが明らかになってきています。ネクロプトーシスはアポトーシス同様に制御された細胞死ですが、アポトーシスとは異なり細胞膜が早期に破裂して死ぬことから、細胞から放出される物質によって周囲に強い炎症を引き起こすと考えられています。ネクロプトーシスは心筋梗塞や脳梗塞、またウイルス感染細胞の排除などに関与していることが示唆されていますが、生体においてネクロプトーシスが生じた後にどのような応答が誘導されるかについては、あまりわかっていませんでした。
本研究の成果
そこで、中野教授らのグループは、ネクロプトーシス後の生体応答を個体レベルで解析するために、cFLIPsと呼ばれるネクロプトーシスを誘導する遺伝子を過剰に発現するマウスを開発しました。cFLIPs過剰発現マウスの一部は子宮内で死亡することがわかりました。組織学的な解析では、全身の臓器にcFLIPsが発現しているにも関わらず、小腸でのみ重篤な炎症が認められました。小腸においては、小腸上皮細胞の脱落と微絨毛の短小化が認められ、壊死性腸炎を発症していることがわかりました(図1A)。小腸上皮細胞においては予想通り一部の細胞にネクロプトーシスが誘導されていましたが(図1B)、驚いたことに大量の小腸上皮細胞がアポトーシスに陥り、腸管の中に脱落していることがわかりました(図1C)。さらに詳細な解析から、ネクロプトーシス細胞から炎症誘導物質(DAMPsと総称)が放出され、それに応答して3型自然リンパ球 (ILC3)(注7)と呼ばれる特殊なリンパ球が小腸に集まり、さらに活性化され、その細胞の産生するサイトカインの1種であるインターロイキン (IL)-22(注8)の発現の上昇が認められました。
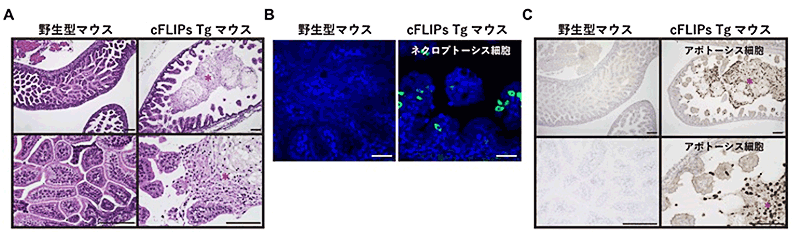
図1.cFLIPs Tgマウスは重篤な小腸炎を発症
(A)マウス胎児の小腸の組織像。胎児期の野生型マウスの小腸の内腔(内側)は絨毛でほとんど埋め尽くされている(左)。cFLIPs Tgマウスでは、小腸の絨毛が極端に短くなり、上皮細胞が脱落し、内腔に死んだ小腸上皮細胞が多数存在する(右 、赤アステリスク)。
(B)野生型マウスの小腸ではネクロプトーシス細胞(緑色)はみられないが、cFLIPs Tgマウスの小腸上皮細胞ではネクロプトーシス細胞が見られる(緑色)。
(C)野生型マウスの小腸ではアポトーシス細胞(茶色)は、ほとんど見られないが、cFLIPs Tgマウスの小腸の内側(赤、アステリスク)では多数のアポトーシス細胞が見られる(茶色)。
横棒は100μm。
小腸炎の発症のメカニズムを明らかにするために、ILC3やIL-22を除去したところ、アポトーシス細胞の出現をブロックしたものの、ネクロプトーシス細胞の出現は抑制しませんでした。以上の結果により、ネクロプトーシスになった小腸上皮細胞がILC3を活性化し、活性化されたILC3がIL-22を産生して、小腸上皮細胞にアポトーシスを誘導する、というネクロプトーシスに続く反応が胎児の小腸で起こっていることが初めて明らかとなりました(図2)。
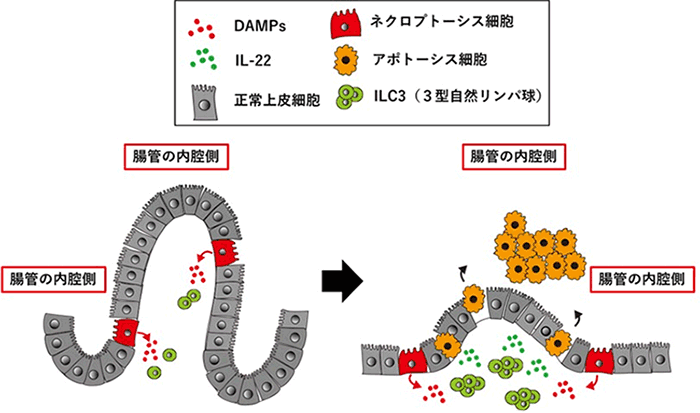
図2.ネクロプトーシス細胞による小腸炎発症のメカニズム
cFLIPsの過剰に発現した小腸上皮細胞の一部にネクロプトーシスが誘導され(細胞、赤)、DAMPs(炎症誘導物質、赤丸)が放出される。それに応答してILC3(3型自然リンパ球)が小腸に移動してくる(左)。移動してきたILC3は活性化されて、IL-22(緑丸)を分泌する。分泌されたIL-22が小腸上皮細胞に作用する。IL-22のシグナルを受け取った小腸上皮細胞はアポトーシスとなり腸の内側に脱落する(右)。その結果小腸の絨毛は極端に短くなる。
今後の展望
今回開発したマウスモデルはcFLIPsと呼ばれる遺伝子を過剰発現するというモデルですが、胎児期の未熟な環境において虚血などが原因でネクロプトーシスが小腸上皮細胞に誘導される可能性も十分に考えられます。一方でヒト新生児、特に未熟児が時に壊死性腸炎と呼ばれる重篤な病気を発症することが知られています。その原因は腸管への血流不足による低酸素状態などが考えられていますが、十分に解明されていません。今回作成したマウス胎児の小腸炎の組織像は、ヒト新生児に生じる壊死性腸炎に類似していることから、今回の研究の成果がヒト新生児の壊死性腸炎の原因の解明や、新たな治療法の開発につながる可能性が示されました。
発表雑誌
- 雑誌名:
- 「iScience」(オンライン版:2019年5月24日)
- 論文タイトル:
- Necroptosis of intestinal epithelial cells induces type 3 innate lymphoid cell-dependent lethal ileitis.
- 著者:
- Ryodai Shindo, Masaki Ohmuraya, Sachiko Komazawa-Sakon, Sanae Miyake, Yutaka Deguchi, Soh Yamazaki, Takashi Nishina, Takayuki Yoshimoto, Soichiro Kakuta, Masato Koike, Yasuo Uchiyama, Hiroyuki Konishi, Hiroshi Kiyama, Tetuo Mikami, Kenta Moriwaki, Kimi Araki, Hiroyasu Nakano
- DOI番号:
- 10.1016/j.isci.2019.05.011
- アブストラクトURL:
- https://www.cell.com/iscience/fulltext/S2589-0042(19)30148-8
用語解説
- (注1)ネクロプトーシス:
- アポトーシスとは異なった新しいタイプの制御された細胞死であり、細胞膜が早期に障害され破裂して死ぬことから周囲に強い炎症を惹起すると考えられている。アポトーシスとは異なり発生過程での意義は明確ではないが、心筋梗塞や脳梗塞の発症などに関与することや、ある種のウイルスの排除に関係していることが報告されている。ネクロプトーシスを制御する薬剤が心筋梗塞や脳梗塞の治療薬になる可能性もある。
- (注2)cFLIPs:
- CFLAR遺伝子からshort form (cFLIPs) とlong form (cFLIPL) の2種類のタンパク質が産生されるが、cFLIPsはネクロプトーシスを誘導する。
- (注3)サイトカイン:
- リンパ球などの細胞から分泌されるタンパク質で、周囲の細胞に特定の信号(増殖や分化など)を伝達する物質の総称。代用的なものにはインターロイキンやインターフェロンなどがある。
- (注4)アポトーシス:
- 制御された細胞死であり、カスパーゼと呼ばれるシステインプロテアーゼの活性化により実行される。発生過程で特定の細胞に、かつ特定の時期に見られる(例えば指の間の水かきの消失など)ことから計画的細胞死と呼ばれてきた。細胞が死んだ後でも細胞膜の機能が比較的長く保たれることから炎症を周囲に誘導することは少ないと考えられている。
- (注5)壊死性腸炎:
- 新生児、特に未熟児の腸管の血流障害による低酸素状態、腸内細菌やミルクの摂取などにより障害を受け、腸管が壊死(この場合の壊死はネクロプトーシスやアポトーシスという特定の細胞死を示しているのではなく、細胞が死んでいることを示す病理学的な用語)となる重篤な疾患。重症例は腸管に穴があき(穿孔)、死にいたることもある。
- (注6)一部の細胞が適切に死ぬ:
- 私達の体は約37兆個の細胞から出来ているが、そのうちの約0.5%程度の細胞(約1900億個)が毎日死んでおり(主にアポトーシスで)、適切な量の細胞が、適切な場所で死ぬことが我々の体を正常に保つために重要だと考えられている。免疫系の細胞死の低下は自己免疫疾患などの発症に関与することも知られており、一方で細胞死が亢進するとエイズ、劇症肝炎や炎症性腸炎など様々な病気を引き起こすことも示されている。
- (注7)3型自然リンパ球 (ILC3):
- リンパ球系に属する自然免疫系の細胞で、T細胞と類似したサイトカインを産生する能力を持った細胞の総称。T細胞やB細胞と異なり抗原特異的な受容体を持たない。産生するサイトカインのパターンにより1、2、3型の自然リンパ球に分類される。
- (注8)インターロイキン (IL)-22:
- ILC3や一部のT細胞が産生・分泌するタンパク質(サイトカイン)である。大人のマウスではIL-22は腸管を正常に保つために重要な役割を果たすことが報告されている。しかし、今回の研究から胎児期においては、異常に活性化された分泌されたIL-22が小腸上皮細胞にアポトーシスを誘導することが明らかとなった。
お問い合わせ先
本発表資料のお問い合わせ先
東邦大学 医学部 生化学講座 生化学分野
教授 中野 裕康
本ニュースリリースの発信元
学校法人東邦大学 法人本部経営企画部
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構
基盤研究事業部 研究企画課