PET診断と細胞レベルの観察を組み合わせた新手法
2021-05-17 理化学研究所
理化学研究所(理研)生命機能科学研究センター細胞機能評価研究チームの杉田幸研修生(研究当時)、大和正典研究員、片岡洋祐チームリーダーらの共同研究チームは、PETがん診断(18F-FDG-PET[1])で可視化される糖代謝[2]の高い領域が、がん組織中で低酸素[3]環境下にあり、その領域に存在する細胞が、がんの転移と関連する上皮間葉転換マーカー[4]を発現することを発見しました。
本研究成果は、糖代謝の高いがん細胞を標的とする治療薬の開発や、非侵襲的なPET診断によるオーダーメイド医療の実現に貢献すると期待できます。
がん細胞は、正常な細胞と比べて糖を大量に消費する性質があります。この性質を利用したPETがん診断では、ほぼ全身のがんを一度に調べられますが、細胞レベルでがんの特徴を把握することができませんでした。
今回、共同研究チームは、一般的なPET診断で用いられ、糖代謝の高い組織を個体レベルで可視化するがんの診断薬18F-FDGを、細胞レベルでの観察に応用する手法の確立を目指しました。検討の結果、ミクロオートラジオグラフィー法(microARG)[5]と蛍光多重免疫組織染色法[6]を組み合わせることで、18F-FDGの集積とさまざまながんマーカーの発現を細胞レベルの空間分解能で同時に可視化することに成功しました。この手法を用いて、マウスに移植したヒト由来のがん組織を調べたところ、低酸素マーカーおよび上皮間葉転換マーカーが陽性となるがん細胞が最も多く18F-FDGを取り込む性質を持つことが分かりました。
本研究は、科学雑誌『Scientific Reports』(5月17日付:日本時間5月17日)に掲載されます。

マクロからミクロレベルの18F-FDG分布と蛍光多重免疫組織染色
背景
がんは体内の細胞の異常増殖によって生じる疾患であり、身体的な所見からがんの位置や大きさを正確に診断することは困難です。そこで、非侵襲的に(体を傷つけずに)体内を撮像するX線CT[7]、磁気共鳴画像法(MRI)[7]、PETなどの画像診断法ががんの診断に力を発揮します。X線CTとMRIががん組織の形態を可視化するのに対して、PETはがん細胞に取り込まれやすい分子を可視化することで診断します。
がん細胞は、正常な細胞よりも糖(グルコース)を大量に消費します。グルコースと類似の化学構造を持つ化合物フルオロデオキシグルコース(FDG)は、グルコースと同様にがん細胞に多く取り込まれますが、解糖系[2]でのエネルギー産生には用いられず、細胞内にとどまり続ける特徴があります。一般的なPET診断では、FDGを放射性同位体フッ素(18F)で標識した18F-FDGを患者に投与し、がん組織に集積した18Fに由来する放射線の量と分布を検出することで、がんの位置や大きさを可視化します。この診断法は「18F-FDG-PET」と呼ばれ、非侵襲的ながん検査として広く普及しています。
これまでに多くのがん患者を対象に行われた18F-FDG-PETの診断データから、がん組織の内部においても18F-FDGの蓄積量(SUV[1])に差があることが知られています。さらに、がん組織内部で最も高い18F-FDG蓄積量を示す値(SUVmax)を患者間で比較すると、SUVmaxはがんの悪性度と関係し、治療の効果や予後と負の相関性が見られる(SUVmaxが高いほど難治性である)ことが分かってきました。従って、SUVmaxを指標にして糖の要求度が高いがん細胞を特定できれば、がん組織の中で悪性度がより高まったがん細胞に対する効果的な治療薬や、治療方法の開発につながるものと期待されます。
しかし、PETは個体レベルの画像診断法であるため、がん組織中の18F-FDG蓄積を細胞レベルの空間分解能で可視化できず、高い18F-FDG蓄積を示す細胞の特徴はこれまで明らかになっていませんでした。そこで、共同研究チームはPETで撮像したがん組織を顕微鏡下で観察し、18F-FDGの蓄積量とさまざまながんマーカーの発現との関係を詳しく調べました。
研究手法と成果
共同研究チームは、18F-FDGの放射性同位体標識からのシグナルと、顕微鏡観察で一般的に用いられる蛍光標識からのシグナルを同時に観察する技術の開発に取り組みました。大和正典研究員らは2009年に、PET撮像後に取り出した臓器から組織切片を作製し、同一切片で放射性同位体のシグナルと免疫組織染色像を観察できる「ミクロオートラジオグラフィー法(microARG)」を開発し、報告しました注1)。今回はこの技術をさらに発展させ、18F-FDG蓄積量の測定と、細胞の状態を反映するさまざまなマーカーに対する蛍光多重免疫組織染色を同一切片に施す技術を確立しました。
まず、マウスにヒト扁平上皮がん細胞を移植し、がん組織が1cmほどに成長した時点でPET撮像を行いました。PETでは、がんの位置や大きさとともに、組織中央部に18F-FDGの高い集積があることが分かりました(図1左)。次に、がん組織を取り出して厚さ5マイクロメートル(μm、1μmは1,000分の1mm)の切片を作製し、これをイメージングプレート[5]で読み取ることで、SUVmaxを示すがん組織内の領域を特定しました(図1右)。
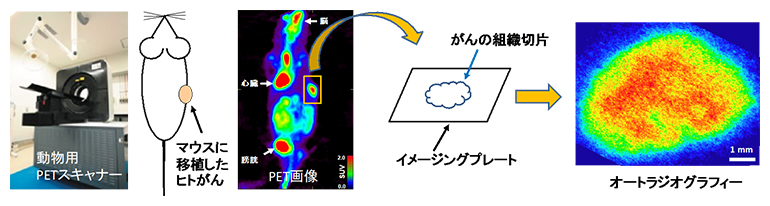
図1 個体レベルから組織レベルの観察
左)本研究で用いた動物用PETスキャナーと、ヒト扁平上皮がん由来の細胞株を移植したマウスの18F-FDG-PET像。赤色が18F-FDG集積の高い領域を示す。四角で囲まれた部分ががん組織。なお、がん組織以外に、脳や心臓が生理的に18F-FDGを蓄積することや、尿として排泄された18F-FDGが膀胱にとどまることが分かっている。
右)摘出したがん組織とイメージングプレートの模式図、およびその18F-FDGオートラジオグラフィー。赤色が18F-FDG集積の高い領域を示す。
次に、この切片を放射線に反応する感光剤や、がんの悪性度と関係することが知られている低酸素マーカーや上皮間葉転換マーカーなどに対する抗体と反応させ、18F-FDGを最も多く取り込む細胞の特徴を調べました。その結果、がんを構成する細胞のうち、低酸素マーカー陽性領域の細胞が、それ以外の領域のがん細胞よりも18F-FDGを多く取り込んでいることが分かりました。また、低酸素マーカー陽性細胞の中でも、上皮間葉転換マーカー陽性のがん細胞が18F-FDGを最も多く取り込んでいました(図2)。これらの結果から、18F-FDG-PETで高いSUVmaxを呈する細胞の特徴を明らかにすることができました。
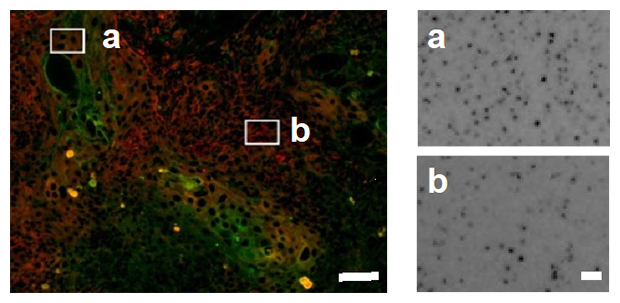
図2 上皮間葉転換マーカーを発現する細胞の18F-FDG蓄積
左)SUVmax領域を含む切片の蛍光顕微鏡像。赤は低酸素マーカー陽性領域、緑は上皮間葉転換マーカー陽性細胞を示す。低酸素マーカー陽性領域のうち、上皮間葉転換マーカーが陽性の細胞群をa、陰性の細胞群をbの四角で囲んだ。スケールバーは100μm。
右)左図aとbの四角で囲んだ領域の感光像。18F-FDG蓄積を示すドット(グレイン)の密度は、上皮間葉転換マーカー陽性細胞を含むaの領域でより高いことが分かる。スケールバーは10μm。
注1)Yamato, M., Kataoka, Y., Mizuma, H., Wada, Y. & Watanabe, Y. PET and macro- and microautoradiographic studies combined with immunohistochemistry for monitoring rat intestinal ulceration and healing processes. J Nucl Med 50, 266-273 (2009).
今後の期待
がんが高い糖要求を示すことは古くから知られており、がんの糖代謝を標的にした抗がん剤の開発も試みられてきましたが、まだ成功していません。その背景には、がん組織が体内で成長していく過程で多様な特徴を持つがん細胞集団が作られること、またそうしたがん細胞の中で、最も糖を取り込むがん細胞が同定されておらず、標的細胞特有の糖代謝経路を特定できなかったことがあります。本研究手法を用いることで、治療標的とすべきがん細胞の特徴への理解が進み、がん特異的な糖代謝を阻害し、兵糧攻めにするような画期的な新薬の開発が加速することが期待できます。
また、18F-FDG-PETによりがん細胞の正確な特徴を知る手法を確立することで、侵襲的な細胞診断をできるだけ用いずに、患者一人一人に合った治療法選択の精度が向上するなど、オーダーメイド医療の実現にも貢献することが期待できます。
補足説明
1.18F-FDG-PET、SUV
18F-FDG-PETは、陽電子を放出するフッ素の陽電子放出核種(放射性同位体の一種)で標識したフルオロデオキシグルコース(18F-FDG)を体内に投与し、その集積を非侵襲的に(体を傷つけずに)3次元画像にして定量する分子イメージング法。特定の組織に集積した18F-FDG量は、その部位の放射能と身体全体の平均放射能の比(Standardized Uptake Value;SUV)として定量化される。FDGはFluorodeoxyglucose、PETはPositron Emission Tomographyの略。
2.糖代謝、解糖系
18F-FDGは体内でグルコースと同様に細胞に取り込まれる。細胞は、取り込んだグルコースを分解する過程でエネルギーを取り出す(糖代謝)が、18F-FDGは細胞質で行われる最初の糖代謝(解糖系)の過程でリン酸化を受けた後は分解されずに細胞にとどまり続ける。
3.低酸素
多くの固形がんでは、がん細胞の増殖と血管からの隔離により、局所的に低い酸素濃度(低酸素)の環境が生じる。がん細胞の低酸素環境への適応は、悪性化に関係すると考えられている。
4.上皮間葉転換マーカー
上皮細胞が間葉細胞様に形質変化することを上皮間葉転換と呼び、がんの浸潤や転移に関わる細胞現象と考えられている。本研究では、がんの転移促進因子として知られるS100A4タンパク質の発現を上皮間葉転換マーカーとして用いた。
5.ミクロオートラジオグラフィー法(microARG)、イメージングプレート
試料中に含まれる放射性物質の分布を、フィルムや感光板(イメージングプレート)上に直接画像化する手法を一般にオートラジオグラフィー(autoradiography;ARG)と呼ぶ。ミクロオートラジオグラフィー法では、感光剤を塗布したプレパラート上に組織切片を静置し、放射線による銀粒子の形成を細胞レベルの高拡大で観察する。
6.蛍光多重免疫組織染色法
免疫組織染色は、組織中の特定の分子に対して特異的に結合する抗体を用い、分子や細胞を可視化する方法。蛍光多重免疫組織染色法は、異なる抗体を異なる蛍光色素で検出することで、同時に複数の分子を観察する染色法。
7.X線CT、磁気共鳴画像法(MRI)
放射線(X線)の照射によりコンピュータ断層撮影(Computed Tomography)を行う画像技術をX線CTと呼ぶ。磁気共鳴画像法は、磁気とラジオ波、それに水素原子の動きを利用して、主に身体の解剖学的な情報を得る技術。MRIはMagnetic Resonance Imagingの略。
共同研究チーム
理化学研究所 生命機能科学研究センター 細胞機能評価研究チーム
チームリーダー 片岡 洋祐(かたおか ようすけ)
研究員 大和 正典(やまと まさのり)
研修生(研究当時) 杉田 幸(すぎた さち)
(現 岡山大学大学院 環境生命科学研究科 動物生理学分野 大学院生)
岡山大学大学院 環境生命科学研究科 動物生理学分野
准教授 畑生 俊光(はたぶ としみつ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「脳内神経炎症が歪める全身代謝のフィジオーム研究(研究代表者:片岡洋祐)」や、同基盤研究(B)「脳内神経炎症を機軸とした癌関連疲労および悪液質病態の解明(研究代表者:片岡洋祐)」等による支援を受けて行われました。
原論文情報
Sachi Sugita, Masanori Yamato, Toshimitsu Hatabu and Yosky Kataoka, “Involvement of cancer-derived EMT cells in the accumulation of 18F-fluorodeoxyglucose in the hypoxic cancer microenvironment”, Scientific Reports, 10.1038/s41598-021-88414-1
発表者
理化学研究所
生命機能科学研究センター 細胞機能評価研究チーム
研修生(研究当時) 杉田 幸(すぎた さち)
(現 岡山大学大学院 環境生命科学研究科 動物生理学分野 大学院生)
研究員 大和 正典(やまと まさのり)
チームリーダー 片岡 洋祐(かたおか ようすけ)
報道担当
理化学研究所 広報室 報道担当