2021-07-01 京都大学,国立循環器病研究センター,関西医科大学,日本医療研究開発機構
概要
京都大学大学院医学研究科形成外科学 森本尚樹 教授(研究当時:関西医科大学形成外科学講座講師)、国立循環器病研究センター研究所生体医工学部 山岡哲二部長らの研究グループは、先天性巨大色素性母斑に対する世界初の皮膚再生治療を実施し、皮膚の再生が可能で、母斑の再発も無いことを確認しました。
先天性巨大色素性母斑は産まれた時から大きな色素性母斑が存在する疾患で、放置すると数%程度に皮膚の癌が発生します。患者さん自身の表皮を培養して何百倍にも増やす自家培養表皮が2016年に保険適用されましたが、真皮がない創(きず)への生着率は不良でした。研究グループは、高圧処理により母斑組織中の全細胞を死滅させた母斑組織そのもので真皮を再建する新規治療法「完全皮膚リサイクル治療法」を開発し(図1)、2016年から2019年にかけて10例の患者さんを対象に臨床研究を実施しました。本治療法は皮膚悪性腫瘍や皮膚以外の組織にも応用可能であると期待されます。本治療法で用いる高圧殺細胞装置の医療機器承認、保険収載を目的とした医師主導治験を2021年7月に開始する予定です。
本成果は、2021年6月30日にアメリカの国際学術誌「Plastic and Reconstructive Surgery」にオンライン掲載されました。
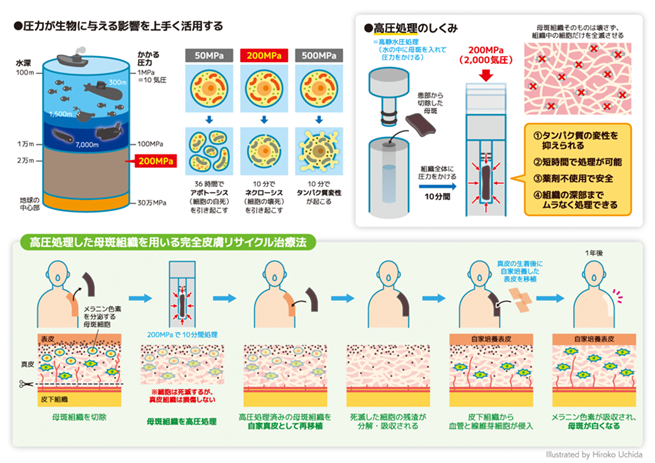
図1:本治療法の概念図、高圧処理によって母斑組織を殺細胞処理し、真皮再生に用います
背景
色素性母斑は、小さいものは一般に「ほくろ」と呼ばれる黒褐色のあざであり、母斑真皮中に存在する母斑細胞がメラニン色素を産生して黒褐色となっています。先天性巨大色素性母斑は、成人になったときに直径20cm以上(新生児では体部で直径6cm以上、頭部で9cm以上)の母斑で出生2万人に1人程度の発生があるとされています。先天性巨大色素性母斑は、母斑から悪性黒色腫(皮膚のがん)が数%程度で発生すると報告されており、外観上の問題とともに生命予後に関しても問題となります。悪性黒色腫の発症は若年者に多く、悪性黒色腫が発生する患者の70%が思春期までに悪性黒色腫を発症するとも報告されており、悪性腫瘍の発生、および整容面の問題からも乳児期も含めたできるだけ早期に母斑組織を完全に切除することが望ましいと考えられています。
巨大色素性母斑の治療上の問題は、母斑を切除した際に生じる大きな皮膚欠損の再建方法になります。巨大な皮膚欠損の再建は、患者さんご自身から採取した自家皮膚移植(植皮)で行われるのが一般的です。しかし、巨大色素性母斑の治療では、母斑が巨大であるほど植皮に利用できる健常な皮膚が少なく、母斑が完全には切除できないことが多く経験されます。
この先天性巨大色素性母斑の治療成績を向上させる目的で、自家培養表皮(ジェイス®:株式会社ジャパン・ティッシュ・エンジニアリング)が2016年より保険適用となり、日本全国で先天性巨大色素性母斑の治療に使用できるようになりました。自家培養表皮は2009年に重症熱傷に保険適用となった日本初の細胞使用製品(当時は医療機器として承認)で、1~2cm2の患者さんの皮膚を採取すると、1ヶ月程度で患者さんの全身を覆うことができる大きさの自家培養表皮が作製可能です。ただし、自家培養表皮のみで治療が可能となったわけではありません。皮膚は100~200μm(マイクロメートル:1000分の1ミリメートル)程度の厚さの表皮と1~2mm程度の厚みのある真皮から構成されます。自家培養表皮は真皮の上には良好に生着しますが、真皮が欠損した創、つまり脂肪や筋膜、肉芽とよばれる結合組織の上にはほとんど生着しません。これは熱傷治療においても同じであり、真皮の再建のためにスキンバンクから提供される同種皮膚(屍体より採取した皮膚)や人工真皮(コラーゲンスポンジを主成分、国内に5製品あり)を用いた真皮の再構築が試みられていますが、いまだに真皮再構築方法は確立されていません。そこで、本研究グループは、母斑組織の細胞成分を不活化(殺細胞処理:細胞をすべて殺してしまうこと)し、残された真皮成分を再移植することで患者さんご自身の真皮を再構築する新規治療方法の開発を行ってきました。母斑組織を用いて真皮再構築ができれば母斑切除部に移植するための皮膚を採取する必要がなくなり、より大きな母斑でも切除できるようになると考えられます。
研究手法・成果
現在、ある組織の細胞をすべて取り除く脱細胞化処理、という概念があり、海外では脱細胞化皮膚が医療機器として市販されています。脱細胞化をする代表的な方法として、界面活性剤を用いて洗浄し、組織中の細胞成分をすべて取り除く方法があります。ただし、脱細胞化組織は毛細血管網がなくなっており、移植した場合の生着が悪くなってしまうこと、また他人の組織であるため、一旦生着しても徐々に吸収されてしまうという課題があり、いままで熱傷治療や母斑治療に広く用いられていませんでした。
そこで、本研究グループが注目したのは高圧処理による殺細胞処理です(図1)。高圧処理は食品加工分野で応用されており、食品のもつ風味や食感等を失うことなく殺菌、加工する方法として使われています。高圧処理の特徴は、加熱処理や薬剤処理と異なり組織の深部まで均一に処理できること、また組織の構造を破壊しないやさしい処理である、ということです。本研究グループは基礎検討の結果、200MPa(2000気圧)で10分間高圧処理を行えば、母斑組織中の全細胞が死滅するものの、真皮の構造は保たれることを確認しました。また、母斑のメラニン色素も母斑細胞が死滅すれば徐々に吸収されることも確認しました。本研究で実施する高圧処理による殺細胞処理では、脱細胞化処理と異なり細胞そのものは除去しません。
これらの基礎研究の結果を受けて、関西医科大学附属病院で2016年2月から2018年8月までに10例の患者さんで本治療法を用いた世界で初となる(First-in-human)臨床試験を行いました。この試験では1回目の手術で対象部位の母斑を切除し、手術室の中で高圧処理による殺細胞処理を行い、再移植しました。2週間から3週間後に二回目の手術を行い、自家培養表皮を生着した高圧処理母斑の上に移植しました。その後、最初の手術から1年後まで経過を観察しました。1例の患者さんは試験途中で脱落(スケジュール通りの治療を行わなかったため除外)となりましたが、残り9例の方全員で、移植1年後の組織生検の結果、母斑細胞の残存がないこと(参考図表参照)、黒い色は徐々に消えていくことも確認されました(図2)。また、課題としては、不活化した母斑組織の生着が一定ではないこと、再建した皮膚が拘縮(縮むこと)あるいは肥厚性瘢痕(傷が盛り上がること)を生じることがあり、術後半年くらいまでは強くみられることが観察されました。このような課題はあるものの、本治療法を行えば、母斑組織と自家培養表皮を用いて母斑切除後の皮膚欠損を治療できることがわかりました。これは、いままでの同種皮膚や人工真皮を用いた治療では得られなかった結果です。
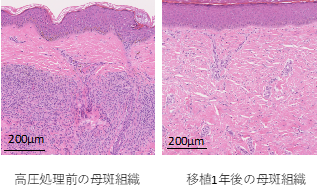
図2高圧処理前の母斑組織(左)と移植1年後の再建皮膚の組織写真(右)(ヘマトシキリンエオジン染色切片)高圧処理前には母斑細胞(青紫色)が真皮深層に多数みられるが、移植1年後には母斑細胞は見られない。
波及効果、今後の予定
本治療法は腫瘍組織である母斑組織を圧力という物理的な方法を用いて殺細胞処理を行った後に自家皮膚の再建に用いる画期的な方法です。同じ考えの治療法として、整形外科分野では、悪性腫瘍のために切除した骨を液体窒素に20分つける殺細胞処理を行った後に自分の骨の再建に用いる手技があり、2019年度から保険適用されています。高圧処理は10分間という更に短時間で処理が可能で、硬い組織である骨でも組織の内部まで均一に殺細胞処理できるという特徴があります。本治療法を保険適用された治療法とするためには、まずは、高圧処理装置が医療機器として承認を取得する必要があります。現在、本研究グループは2021年度に京都大学医学部附属病院で承認取得のための医師主導治験を開始することを目標に準備を行っています。また、更に基礎研究を行い、母斑だけでは無く、皮膚の悪性腫瘍、あるいは骨や軟骨、神経などの悪性腫瘍の組織に対しても本治療法が有効であることを確認する予定です。
形成外科は、頭頸部の悪性腫瘍、消化管の悪性腫瘍、乳癌などで失われた組織の再建手術を担当しています。本治療法を用いた「腫瘍組織の再利用」が広く行われるようになれば、いままでのように再建手術のために健康な自家組織を採取する必要がなくなり、手術をうける患者さんのQOL(Quality of life)の向上に寄与すると予想しています。ただし、細胞を死滅させた組織の移植になり、生きている組織と比べると生着が悪いため、今後は移植方法の検討、あるいは細胞を組み込む工夫などが必要になると考えられます。
研究プロジェクトについて
本研究開発の基礎検討は、科学技術振興機構(JST)「研究成果最適展開支援プログラム(A-STEP)シーズ顕在化タイプ」(平成24~25年度)、文部科学省「橋渡し研究加速ネットワークプログラム」(平成26年度)、厚生労働省「革新的がん医療実用化研究事業」(平成26年度)、日本学術振興会科研費基盤研究B(平成29年度~令和2年度)の支援により実施しました。
臨床研究は、日本医療研究開発機構(AMED)の「革新的がん医療実用化研究事業」(平成27年度~令和元年度)の支援で実施されました。
なお、本年7月に開始予定の医師主導治験は、新たに令和2年度より、AMED「革新的がん医療実用化研究事業」の支援を受けています。
論文タイトルと著者
- タイトル
- A novel treatment for giant congenital melanocytic nevi combining inactivated autologous nevus tissue by high hydrostatic pressure and a cultured epidermal autograft:First-in-human, open, prospective clinical trial(先天性巨大色素性母斑に対する高圧処理不活化自家母斑組織と自家培養表皮を用いた新規治療法:世界初の前向き臨床研究)
- 著者
- 森本尚樹、光井俊人、坂本道治、馬原淳、吉村健一、荒田順、神野千鶴、覚道奈津子、楠本健司、山岡哲二
- 掲載誌
- Plastic and Reconstructive Surgery
- DOI
- 10.1097/PRS.0000000000008084
お問い合わせ先
森本 尚樹(もりもと なおき)
京都大学大学院医学研究科形成外科学・教授
報道・取材に関するお問い合わせ
京都大学 医学部附属病院総務課企画・広報掛
国立循環器病研究センター 総務課広報係
日本医療研究開発機構(AMED)革新的がん医療実用化研究事業について
国立研究開発法人 日本医療研究開発機構(AMED)
医療機器・ヘルスケア事業部 医療機器研究開発課