2021-12-15 理化学研究所,筑波大学
理化学研究所(理研)バイオリソース研究センターiPS細胞高次特性解析開発チームの林洋平チームリーダー(筑波大学医学医療系准教授)、ボリソワ・エフゲーニャ大学院生リサーチ・アソシエイト(筑波大学大学院人間総合科学研究科博士課程)、筑波大学医学医療系西村健准教授、久武幸司教授らの共同研究グループは、iPS細胞[1]をより高効率・高品質に作製できるKLF4タンパク質[2]改変体を開発しました。
本研究成果は、従来よりも優れた次世代リプログラミング(初期化)因子により、患者自身の体細胞から作製するiPS細胞を用いた自家移植医療の実現に貢献すると期待できます。
今回、共同研究グループは、iPS細胞作製の際に必要なリプログラミング因子の一つであるKLF4タンパク質において、DNAと直接相互作用するアミノ酸残基の改変体を多数作製しました。その中から「KLF4 L507A改変体(ヒトKLF4の507番目のアミノ酸残基ロイシンをアラニンに置換したもの)」を用いてiPS細胞を作製したところ、迅速、かつ高効率で、高品質なiPS細胞株を樹立できることが分かりました。
本研究は、科学雑誌『iScience』オンライン版(12月14日付:日本時間12月15日)に掲載されます。
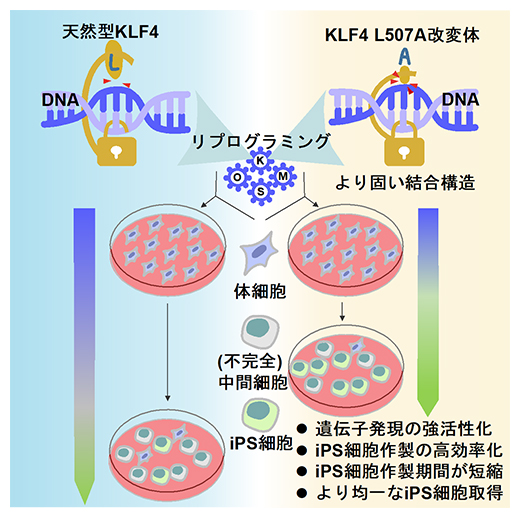
本研究の概要
背景
「リプログラミング(初期化)」は、転写因子[3]などのリプログラミング因子を異所的に発現させることで、体細胞を他の望ましい種類の細胞に変える技術です。iPS細胞の開発に代表されるように、生命科学、創薬、再生医療の革新的技術として発展してきました。リプログラミング因子は、DNAのサイレンシング(遺伝子発現の抑制)された部分などに協調して結合し、「パイオニア因子」として活発な転写イベントを開始し、下流の遺伝子の発現や、細胞の初期化状態に向けたエピジェネティック[4]な状態の変更を制御します。
リプログラミングの効率や質を改善するために、過去の多くの研究では、新規・代替・追加因子の探索、エピジェネティックな状態を変える因子の探索、培養条件、因子の導入方法の改善などに焦点が当てられてきました。しかし、現在の技術では、体細胞からの直接的なリプログラミングにおいて高品質なiPS細胞の収量が少ないことから、特に患者自身の体細胞から作製したiPS細胞を(自家)移植医療へ応用するのが遅れています。
今回、共同研究グループは、既存のリプログラミング因子自体の機能強化を目標としました。リプログラミング因子のうちKLF4(Krüppel-like factor 4)は、転写活性化ドメインと抑制ドメインの両方を持つジンクフィンガータンパク質[5]であり、iPS細胞の作製や他のリプログラミングにも広く使われています。このKLF4の機能改善を図るべく、有用なKLF4改変体の開発に取り組みました。
研究手法と成果
共同研究グループは、リプログラミング因子を合理的に設計し、構造生物学、機能生物学なアプローチを組み合わせることで、リプログラミングがどのように改善されるかを調べました。
まず、KLF4のDNA結合領域であるジンクフィンガー領域(ZnFドメイン)に着目し、DNAと相互作用するアミノ酸残基19個を既報の結晶構造から見いだしました(図1)。これらのアミノ酸残基をアラニンに置換した改変体群を作製し(アラニンスキャニング[6])、それらの改変体をレトロウイルスベクター[7]を用いてマウス線維芽細胞に導入し、iPS細胞を作製しました。すると、これらの改変体の多くは、天然型(野生型)KLF4と比較して、iPS細胞の作製効率(リプログラミング活性)を低下(または消失)させましたが、「KLF4 L507A改変体(ヒトKLF4の507番目のアミノ酸残基ロイシンをアラニンへと置換したもの)」だけは、iPS細胞の生成速度と作製効率を向上させることが分かりました(図2)。
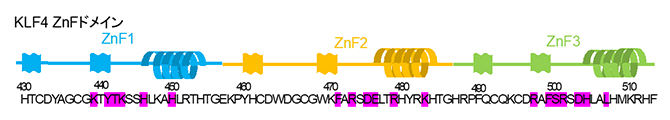
図1 KLF4のZnFドメインにおけるアミノ酸残基配列
ピンク色でハイライトした文字は、今回アラニンに置換した改変体を作製したアミノ酸残基(19個)を示す。これらのアミノ酸残基はDNAと相互作用する。この中で、ZnF3領域にある507番目のアミノ酸残基ロイシン(L)をアラニン(A)に置換したKLF4 L507A改変体だけが、iPS細胞の作製に有効であることが分かった。
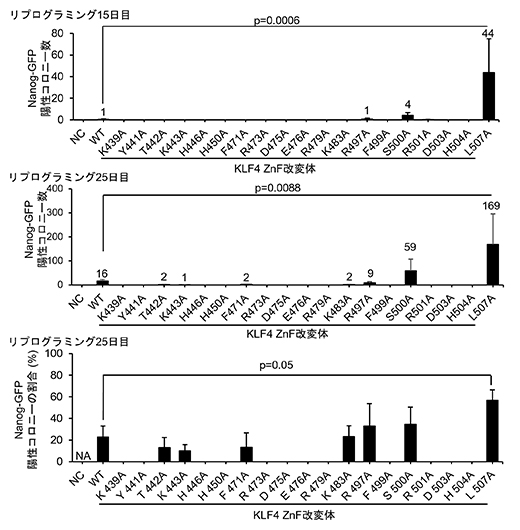
図2 19個のKLF4ZnF改変体を用いたiPS細胞作製実験の結果
iPS細胞になると緑色蛍光タンパク質(Nanog-GFP)を発現するマウス繊維芽細胞に、各KLF4改変体レトロウイルスベクターを導入してiPS細胞を作製し、15日目、25日目にそれぞれコロニー数を計測した。25日目にはさらにコロニー総数の割合を計測した。KLF4 L507A改変体ではiPS細胞を多く作製できた。
KLF4 L507A改変体は、ヒト繊維芽細胞に対しても同様にiPS細胞の作製効率を向上させました。また、ゲノムDNAに挿入されず、ヒト細胞に高い感染性を示すことから再生医療に高い応用性があると考えられているセンダイウイルスベクター[7]を用いても、KLF4 L507A改変体は同じように、マウス、ヒトの体細胞の両方から、天然型KLF4よりも高いiPS細胞作製効率を示しました。
作製したヒトiPS細胞(クローン)株を単離直後に解析したところ、多くの細胞でiPS細胞マーカーのNANOG遺伝子[8]発現の不均一性が比較的低いこと、センダイウイルスベクターの残存によるRNA発現が低いこと、分化抵抗性[9]を示すiPS細胞株のマーカーRNA(HERV-HやlincRNA-RoR)の発現が低いことが分かりました。この結果は、天然型KLF4と比較して、KLF4 L507A改変体を用いた方がより均一に高品質のiPS細胞を作製できることを示しています。
また、KLF4のL507部位のアミノ酸残基を天然アミノ酸20種にそれぞれ置換した改変体を用いてiPS細胞を作製し、その作製効率を比較しました。すると興味深いことに、アラニンやグリシンといった分子体積の小さいアミノ酸残基に置換した改変体を用いた場合はiPS細胞の作製効率が高く、L507部位のアミノ酸残基の分子体積の大きさとiPS細胞の作製効率が逆の相関を示すことが分かりました(図3)。このことは、L507部位のアミノ酸残基がiPS細胞へのリプログラミングにおけるKLF4の機能に立体障害となることを示しています。
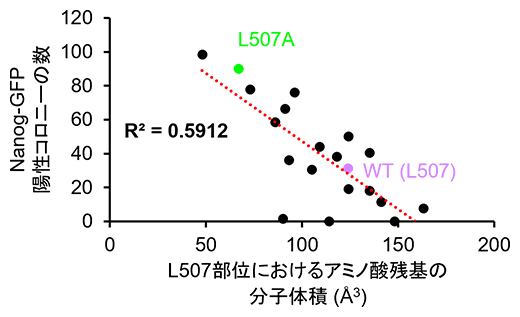
図3 L507部位におけるアミノ酸残基の分子体積とiPS細胞作製効率の関係
KLF4のL507部位のアミノ酸残基を天然アミノ酸20種それぞれに置換した改変体を用いて、iPS細胞を作製した。グラフのR2は決定係数(相関関数の2乗)、WT(L507)は天然型を示す。
次に、iPS細胞の作製効率を向上させることが知られているいくつかの因子をそれぞれ追加して、KLF4 L507A改変体または天然型KLF4を用いてiPS細胞を作製しました。その結果、KLF4と同様にZnFドメインを持つ転写因子のGlis1[10]やKlf5[10]を添加した場合は、iPS細胞作製効率を向上させる効果がKLF4 L507A改変体によって打ち消されることが分かりました。これは、KLF4 L507A改変体がGlis1やKlf5を追加したときと同様の効果を持つことを示しています。
また、ChIP-Seq[11]やRNA-Seq[12]の実験により、KLF4 L507A改変体はKlf5などの一部の多能性関連遺伝子のプロモーター[13]やエンハンサー[13]に多く結合し、リプログラミングの際にそれらの遺伝子発現を天然型因子よりもさらに強く促進することが明らかになりました。
最後に、KLF4 L507A改変体がKLF4とDNAの結合構造にどのような変化をもたらすかを予想するため、分子動力学シミュレーション解析[14]を行いました。その結果、KLF4 L507A改変体のタンパク質-DNA複合体では、いくつかのアミノ酸残基とDNAとの間に水素結合が新たに形成され、タンパク質とDNAの結合が天然型KLF4よりも強化されるようなコンフォメーション(立体配座)が存在する可能性を見いだしました(図4)。
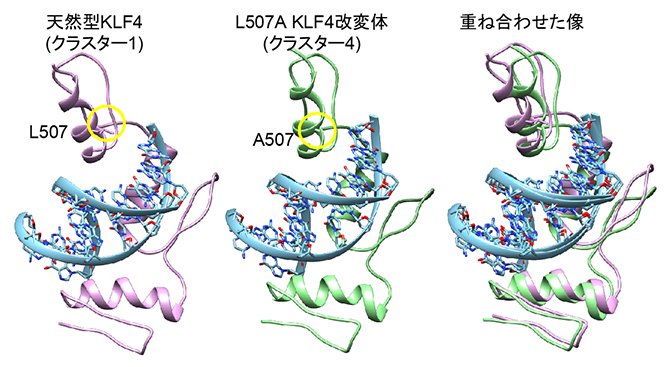
図4 分子動力学シミュレーションを用いたKLF4ZnFドメインとDNAの複合体構造予測
タンパク質はリボンで、DNAはボールアンドスティックで示す。L507A改変体のクラスター4構造(中央)は34%の存在確率であり、この改変体に固有の構造である。いくつかのアミノ酸残基とDNAとの間に水素結合が新たに形成され、タンパク質とDNAの結合が天然型KLF4よりも強化されると考えられる。
本研究では、iPS細胞の作製に用いられるリプログラミング因子であるKLF4に着目し、そのDNAの相互作用の構造的知見から改変体を探索しました。その結果、iPS細胞の作製を高効率化・高品質化する機能強化型改変体としてL507A(およびL507部位における小さなアミノ酸残基改変体)を見いだしました。この改変体は、ゲノムDNAとの複合体においてより固い結合状態を取りうると考えられます。iPS細胞のリプログラミング時にKlf5などの多能性関連遺伝子の転写をより強く活性化します。以上の分子機構から、iPS細胞作製の期間がより短くなり、効率が高くなります。作製されたiPS細胞は、従来よりも分化抵抗性のものが少ない、質の高いものがより均一的になります(図5)。
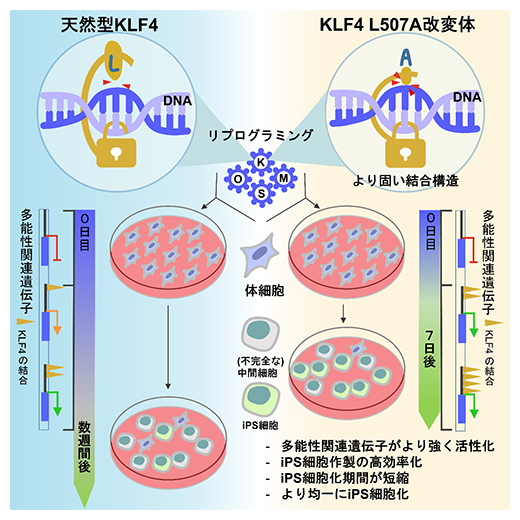
図5 本研究成果の概要
天然型KLF4と今回の研究で見いだしたKLF4 L507A改変体を用いたiPS細胞の作製実験における違い。
今後の期待
本研究成果は、従来の天然型タンパク質よりも優れたリプログラミング能を持つ「次世代リプログラミング因子」を開発した初めての例です。今後、他のリプログラミング因子においても同様な機能増強型の改変体が開発されると考えられます。その延長線上では、より効率よく高品質のiPS細胞を容易に作製できることから、患者自身から作ったiPS細胞(My iPS細胞)を用いた自家移植医療の実現に貢献すると期待できます。
また、本研究成果に関する特許のライセンスを受けて事業化を希望する企業を募集しています。
補足説明
1.iPS細胞
ヒトを含む哺乳類の体細胞にごく少数の因子を導入し、培養すると、その細胞はさまざまな組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力を持つ多能性幹細胞に変化する。この細胞をiPS細胞(人工多能性幹細胞、induced pluripotent stem cells)と呼ぶ。
2.KLF4タンパク質
iPS細胞を作製する際に用いられるリプログラミング因子の一つ。そのほかにも、初期発生や恒常性の維持、がん化など多様な生命現象に関わる。構造的には、転写抑制ドメイン、転写活性化ドメイン、ジンクフィンガードメインを含む。
3.転写因子
DNAに特異的に結合するタンパク質の一群であり、DNA上のプロモーター、エンハンサー領域に結合し、転写を調節する。
4.エピジェネティック
広義には、遺伝性ではない形質を幅広く指すが、ここでは、狭義として(DNAの配列そのものの変化ではなく)DNAのメチル化およびヒストンの化学的修飾など、RNA発現とタンパク質の翻訳に対する細胞内環境の状態変化を意味する。
5.ジンクフィンガータンパク質
ジンクフィンガーはタンパク質ドメインの一種で、DNAに結合する性質を持つ。亜鉛(ジンク)イオンがその構造の安定化に重要である。
6.アラニンスキャニング
タンパク質の特定アミノ酸残基をアラニンに置換した改変体を作製し、そのアミノ酸残基の機能を調べる手法。アラニンは側鎖がメチル基だけで、分子半径が小さく、極性も持たないため、別のアミノ酸残基の効果を打ち消す目的で広く利用される。
7.レトロウイルスベクター、センダイウイルスベクター
それぞれ、レトロウイルス、センダイウイルスを改変して作られた細胞内への遺伝子導入のために用いられるベクター(運び屋)である。レトロウイルスベクターは分裂する細胞のゲノムDNAに安定に組み込まれて、長期的な遺伝子の発現が可能であるのに対し、センダイウイルスベクターは非分裂細胞にも遺伝子導入でき、ゲノムDNAには取り込まれずに、数週間ほど発現が持続する。
8.NANOG遺伝子
多能性幹細胞(や生殖細胞の一部)のみで高発現している遺伝子であり、多能性幹細胞の多能性や自己複製を制御している。iPS細胞作製実験においては、作製されたiPS細胞の指標(マーカー)遺伝子として用いられる。
9.分化抵抗性
iPS細胞などの幹細胞は、一般的にさまざまな細胞に分化する能力を持っているが、リプログラミングが不十分、長期培養による変化などが原因となり、分化しにくい性質を帯びてしまうことがある。これを「分化抵抗性」と呼び、基礎研究や再生医療における分化誘導に支障を来す要因となる。
10.Glis1、Klf5
ともにジンクフィンガータンパク質であり、iPS細胞作製を促進することが知られている。Klf5はKlf4に類似した構造、機能を持っており、Klf4の代替としてiPS細胞を作製できる(Nakagawa et al., Nature Biotechnology 2008)。Glis1はiPS細胞の効率を促進するものの、体細胞やiPS細胞自身にはほとんど発現していないことが過去に示されている(Maekawa et al., Nature 2011)。
11.ChIP-seq
ある特定の転写因子やヒストンなどのDNA結合タンパク質が、細胞内においてDNAのどの配列にどの程度結合しているかを網羅的に解析する手法。
12.RNA-seq
細胞内からRNAを回収し、その配列を網羅的に読むことで、その発現量や発現している遺伝子の種類を解析する実験手法。
13.プロモーター、エンハンサー
プロモーター(Promoter)とは転写(DNAからRNAを合成する段階)の開始に関与する遺伝子の上流領域の配列を指す。エンハンサー(Enhancer)はさらに周辺領域で、遺伝子の転写を調節する配列を指す。
14.分子動力学シミュレーション解析
原子ならびに分子の物理的な動きを予測するコンピューターシミュレーション手法。原子および分子は、ある時間の間相互作用することが許され、これによって原子の動的発展の状況予測が得られる。化学物理学、材料科学、生体分子のモデリングに広く利用されている。
共同研究グループ
理化学研究所 バイオリソース研究センター iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(はやし ようへい)
(筑波大学 医学医療系 准教授[連携大学院]、筑波大学グローバル教育院 ライフイノベーション学位プログラム 准教授[協働大学院])
大学院生リサーチ・アソシエイト ボリソワ・エフゲーニャ(Borisova Evgeniia)
(筑波大学大学院 人間総合科学研究科 博士課程)
テクニカルスタッフ(研究当時) 安 瑜利(あん ゆり)
研修生(研究当時) 髙見 美帆(たかみ みほ)
(筑波大学大学院 人間総合科学研究科 修士課程)
研修生(研究当時) ジンユエ・リ(Jingyue Li)
(筑波大学大学院 人間総合科学研究科 修士課程)
研修生 ダン・ソン(Dang Song)
(筑波大学大学院 人間総合科学研究科 博士課程)
開発研究員 髙﨑 真美(たかさき まみ)
研修生(研究当時) ドリアン・ルクス(Dorian Luijkx)
(オランダ ユトレヒト大学大学院 修士課程)
筑波大学 医学医療系
遺伝子制御学研究室
教授 久武 幸司(ひさたけ こうじ)
准教授 西村 健(にしむら けん)
大学院生 相澤 志穂(あいざわ しほ)
解剖学発生学研究室
助教 久野 朗広(くの あきひろ)
(グローバル教育院 ヒューマンバイオロジー学位プログラム)
プレシジョン・メディスン開発研究センター
センター長・教授 佐藤 孝明(さとう たかあき)
客員准教授 杉原 英志(すぎはら えいじ)
(藤田医科大学 研究支援推進本部 共同利用研究設備サポートセンター ゲノム解析室准教授)
高エネルギー加速器研究機構 物質構造科学研究所 構造生物学研究センター
特任准教授(研究当時) 湯本 史明(ゆもと ふみあき)
東京大学 大学院農学生命科学研究科 応用生命工学専攻生物分子工学講座
准教授 寺田 透(てらだ とおる)
研究支援
本研究は、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)の課題「リプログラミング因子変異体のDNA相互作用における分子動力学シミュレーション」(課題番号JP21am0101107(支援番号 1907))、日本学術新興会(JSPS)科学研究費補助金 研究活動スタート支援 「KLF4DNA結合部位アミノ酸残基の機能解析から改良リプログラミング因子の開発(研究代表者:林洋平)」(課題番号JP16H06662) 、同若手研究(A)「染色体異常を伴った疾患特異的iPS細胞を修復する「染色体編集法」の開発(研究代表者:林洋平)」(課題番号JP17H05063) 、基盤研究(B)「iPS細胞誘導過程でのKlf4による細胞形態と細胞機能のリプログラミング機構(研究代表者:久武幸司)」(課題番号JP17H04036) 、基盤研究(B)「iPS細胞誘導におけるKlf4を中心とした動的エピゲノム転写制御の分子機構(研究代表者:西村健)」(課題番号JP19H03203) 、文部科学省「ナノテクノロジープラットフォーム事業」(課題番号JPMXP09 S20NM0001) 、公益財団法人武田科学振興財団の支援、上原記念生命科学財団、東京生化学研究会、2018年度iPSアカデミアジャパン研究助成による支援を受けて行われました。また、ボリソワ・エフゲーニャは本研究の実施期間に大塚敏美育英奨学財団の奨学金を得ていました。
原論文情報
Evgeniia Borisova, Ken Nishimura, Yuri An, Miho Takami, Jingyue Li, Dan Song, Mami Matsuo-Takasaki, Dorian Luijkx, Shiho Aizawa, Akihiro Kuno, Eiji Sugihara, Taka-aki Sato, Fumiaki Yumoto, Tohru Terada, Koji Hisatake, and Yohei Hayashi, “Structurally-discovered KLF4 variants accelerate and stabilize reprogramming to pluripotency”, iScience, 10.1016/j.isci.2021.103525
発表者
理化学研究所
バイオリソース研究センター iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(はやし ようへい)
大学院生リサーチ・アソシエイト ボリソワ・エフゲーニャ(Evgeniia Borisova )
筑波大学 医学医療系 遺伝子制御学研究室
准教授 西村 健(にしむら けん)
教授 久武 幸司(ひさたけ こうじ)
報道担当
理化学研究所 広報室 報道担当
筑波大学 広報室