2022-04-20 千葉県がんセンター, 日本医療研究開発機構
千葉県がんセンターの研究グループは、種の進化と遺伝子進化を統合する新たな概念を提唱し、ヨーロッパ分子生物学機構の科学誌『EMBO Reports』に発表しました。近年、類人猿以降に出現した遺伝子ががんの発症や進展に関わることが示されてきました。しかし、このような進化的に新しい遺伝子がどのような機構で誕生したのかは謎のままでした。
そこで研究グループは今回、国立がん研究センター研究所および東北大学と共同で遺伝子の誕生を検出できる指標ORFドミナンスを考案し、生命樹の全てのドメイン(細菌、古細菌、真核生物)から選んだ100生物種についてORFドミナンスを計算することで進化においてどのように遺伝子が誕生したかを調べました。この指標を用いて同定したヒトの新しい遺伝子候補は、脳の発生やがんに関連する可能性が示唆されました。また、遺伝子誕生の確率は絶滅危惧種などの個体数が少ない生物種では特に高いことを発見しました。
がん進展の過程は、DNA変異により遺伝子を誕生させてがん細胞集団の構成を変化させるため、「がん進化」と呼ばれます。今後、ORFドミナンスをがんにおいて計算することで、がん進化を抑制する手法の開発に繋げます。
研究概要
千葉県がんセンター研究所・末永雄介上席研究員、国立がん研究センター研究所・加藤護分野長、東北大学大学院・牧野能士教授らの共同研究チームは、進化において新しく誕生した遺伝子を検出するために有用な指標ORFドミナンスを考案し、ORFドミナンスを細菌、古細菌、真核生物から選んだ100生物種の全RNAについて計算することで遺伝子誕生のメカニズムの一端を明らかにしました。
近年、類人猿以降に出現した進化的に新しい遺伝子が、がんを含む様々な疾患に関与することが報告されており、新たな治療の標的として注目されています。一方で、細胞内には機能を持たないノイズのようなRNAが多数存在し、進化において新しく誕生した遺伝子のRNAはこの機能を持たないノイズに類似するため効率的に発見することが困難でした。
今回開発したORFドミナンスはRNAがタンパク質に翻訳される効率と関連し、ノイズのようなRNAと新しく誕生した遺伝子のRNAを見分けるのに有用でした。ORFドミナンスを用いて同定したヒトの新しい遺伝子候補は、遺伝病の全前脳胞症や、脳腫瘍の一種である膠芽腫などに関連する可能性が示唆されました。また、原核生物に比較して真核生物では、ノンコーディングRNAから新しい遺伝子が誕生しやすいことを示しました。さらに、遺伝子誕生の確率は絶滅危惧種などの個体数が少ない生物種で特に高いことを見出しました。これらの結果から研究チームは、「生物は個体数減少に対する対抗策として新しい遺伝子を誕生させる」というモデルを提唱しています。また、個体数減少があまりに急激だと遺伝子誕生が環境への適応に貢献できず、絶滅に追いやられるとしています。
研究成果のポイント
- 進化的に新しく誕生した遺伝子を同定するために有用なスコア「ORFドミナンス」を考案した。
- ヒトの新しく誕生した遺伝子の候補は脳の遺伝病やがんと関連する可能性が示唆された。
- 遺伝子誕生の確率は個体数が少ない生物種、特に絶滅危惧種において高い。
研究の背景
生物学のセントラルドグマでは遺伝子のDNA領域からメッセンジャーRNA(mRNA)が転写されタンパク質に翻訳されることで、タンパク質が機能を発揮するとされています(図1A 赤枠)。しかし近年、タンパク質に翻訳されずに機能を発揮するRNAが発見されました。これらはノンコーディングRNAと呼ばれます(図1A 右)。このノンコーディングRNAには従来から知られていたリボソームRNA、トランスファーRNAに加え、転写調節や核構造の維持など多彩な機能を持つRNAが含まれます。一方で、ノンコーディングRNAの大部分は機能が発見されておらず、これらはノイズのように本質的に機能を持たない可能性も示唆されています(図1A右)。ノンコーディングRNAに対比してタンパク質に翻訳されるmRNAはコーディングRNAとも呼ばれます(図1A)。すなわち遺伝子は広義にはコーディングRNAまたは機能を持つノンコーディングRNAを転写するDNA領域と理解されています(図1A)。
しかし、がん抑制遺伝子p53のRNAなど既知のコーディングRNAにおいて、RNA自身に生理機能があることが証明されました。逆にノンコーディングRNAとして知られていたRNAがタンパク質に翻訳され、そのタンパク質の生理機能を証明したとする報告も多数あります。
このようなRNAはコーディングRNA、ノンコーディングRNAという二元論的な定義では説明できず、二機能性RNAと呼ばれています(図1B)。二機能性RNAの存在はコーディング/ノンコーディングRNAの境界が本質的に曖昧であり、むしろ連続的であることを示唆しています。しかし、RNAのどのような性質がこの「連続性」に関与するのかは不明でした。
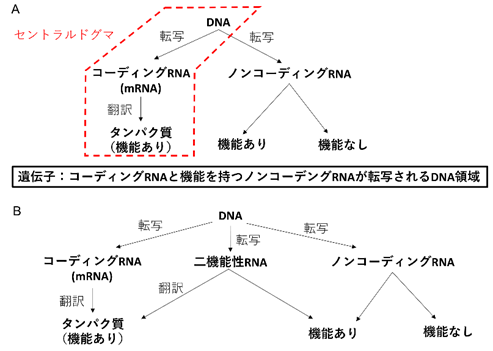
図1 遺伝子概念の拡張とRNA機能
A.セントラルドグマとノンコーディングRNAの関係。セントラルドグマ(赤枠)では遺伝子はコーディングRNAを転写するDNA領域だが、広義には機能を持つノンコーディングRNAを転写するDNA領域も遺伝子に含まれる。
B.コーディングRNAとノンコーディングRNAという二元論的な定義を不可能にする二機能性RNAの存在。
千葉県がんセンター研究所・末永雄介上席研究員らは以前、小児がんである神経芽腫のがん遺伝子MYCNを研究する過程で、MYCNの相補鎖にNCYMという遺伝子が存在することを発見しました。NCYMはヒト亜科においてノンコーディングRNAからコーディングRNAに進化した遺伝子であり、小児がんである神経芽腫の悪性化を促進しました(Suenaga et al., PLoS Genetics 2014)。新しい遺伝子はこれまで既存の遺伝子から誕生すると考えられてきましたが(図2A)、NCYMはノンコーディングRNAを転写する非遺伝子領域からコーディングRNAを転写する遺伝子に進化したと考えられています(図2右)。このような遺伝子をde novo遺伝子と呼びNCYMは生理機能が実験的に示された初めてのヒトde novo遺伝子でした。さらにNCYMはノンコーディングRNAとしても機能することが報告され、二機能性RNAであることが示されました(Suenaga et al., Jpn J Clin Oncol 2020)。
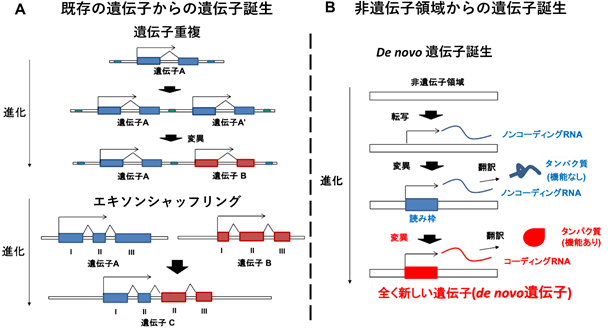
図2 進化における遺伝子誕生機構
A.既存の遺伝子からの遺伝子誕生。上のパネルは遺伝子Aが重複して遺伝子A’が誕生し、変異を蓄積して新遺伝子Bになる過程(遺伝子重複)。下のパネルは遺伝子A, Bの一部のエキソンから新遺伝子Cができる過程(エキソンシャッフリング)。
B.非遺伝子領域からの遺伝子誕生。非遺伝子領域から転写されるノイズのようなノンコーディングRNAが、変異の蓄積により読み枠を獲得して機能を持たないタンパク質に翻訳されるノンコーディングRNAになり、さらなる変異により機能を持つタンパク質に翻訳されるコーディングRNAが誕生する。このように誕生した遺伝子をde novo遺伝子と呼ぶ。
NCYMは進化において誕生したばかりの遺伝子であるため、研究グループはNCYMのRNAを調べることでノンコーディングRNAとコーディングRNAの「連続性」を説明できるのではないかと考えました。
研究内容
研究グループはRNAの配列に着目し、この「連続性」を説明しようと考えました。コーディングRNAや二機能性RNAは細胞内でリボソームによりタンパク質に翻訳されます。NCYMのRNA配列をノンコーディングRNAと比較したところ、リボソームがタンパク質を翻訳する配列である読み枠(ORF)の他には余計なORFが少ないことに気が付きました。
そこで余計なORFが少ないことを数学的に表現した指標をORFドミナンスと定義しました(図3)。
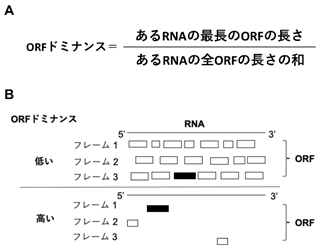
図3 ORFドミナンスの定義
A.ORFドミナンスの定義式。
B.ORFドミナンスが低いRNAと高いRNAのORFの状態。
黒い長方形は最長のORF。白い長方形は余計なORF。リボソームはRNAを5’から3’の方向に三つのフレームでタンパク質を翻訳する。
このORFドミナンスは任意のRNA配列に対して一意に計算できます。そこでORFドミナンスを100生物種、全340万以上のRNAで計算したところ細菌、古細菌、真核生物の全てのドメインでコーディングRNA(赤)は高い値、ノンコーディングRNA(青)は低い値を示しました(図4)。細菌、古細菌ではコーディングRNAとノンコーディングRNAの境界が明瞭なのに対し、真核生物では中間値を示すRNAが多く存在しコーディングRNAとノンコーディングRNAの境界が曖昧になりました。このことは真核生物の方がノンコーディングRNAから新しい二機能性RNAやコーディングRNAが誕生しやすい状態にあることを示唆します。がん抑制遺伝子p53のORFドミナンスは中間的な値を示し、その二機能性を反映していました。
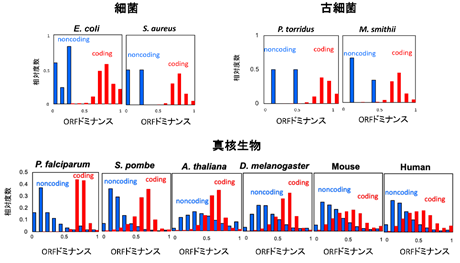
図4 ORFドミナンスの分布細菌、古細菌、真核生物におけるORFドミナンスの分布の例。生物種の全RNAに対しORFドミナンスを計算し、その相対頻度をヒストグラムとして示す。青がノンコーディングRNAの分布。赤がコーディングRNAの分布。
ORFドミナンスが高いヒトのノンコーディングRNAはde novo遺伝子の候補であり、MYCN、TGIF、ZIC2などの転写因子と脳腫瘍である膠芽腫に関連しました。MYCNは神経芽腫のがん遺伝子であると同時に脳が萎縮する遺伝病であるファインゴールド症候群の原因遺伝子です。またTGIF、ZIC2は脳の高次機能が障害される遺伝病である全前脳胞症の原因遺伝子です。これらの結果からヒトのde novo遺伝子候補は脳の発生や腫瘍化に関連することが示唆されました。
さらにコーディングRNA、ノンコーディングRNAの境界の曖昧さを数学的に表すOdomという値を定義しました。境界の曖昧さOdomはORFドミナンスの分布から計算され、各生物種ごとに1つの値が計算されます。このOdomは生物種のゲノムDNA変異率および有効個体群サイズ(個体数)とそれぞれ正または負に相関しました。またレッドリストに登録されている絶滅危惧種ではOdomが高く、絶滅危惧種以外でも個体数が減少している生物種では安定している生物種に比較してOdomが高いことが判明しました。これらの結果は個体数の減少に伴いDNA変異率が上昇し、コーディング/ノンコーディングRNA境界が曖昧になり遺伝子誕生の確率が上昇することを示唆します。すなわち生物は個体数の減少に対する対抗策として遺伝子を誕生させている可能性があります(図5)。
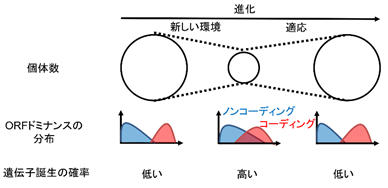
図5 本論文で提唱したモデル個体数減少への対抗策としての遺伝子誕生。新しい環境により個体数が減少するとコーディング/ノンコーディングRNAの境界が曖昧になり遺伝子誕生の確率が高くなる。
一方でORFドミナンスが中間値になることはコーディングRNA配列およびノンコーディングRNA配列としての特徴を失うことを意味し、機能のないノンコーディングRNAになるリスクを負います。すなわち遺伝子消失の確率も上昇します。急激な個体数の減少は遺伝子誕生が環境適応に貢献する前に致死的な遺伝子消失を引き起こし、生物種の絶滅を促すと考えられます。
以上のようにORFドミナンスは種の進化と遺伝子進化を統一的に理解するために有用な指標であることが明らかになりました。
本研究の意義と応用
がん細胞はその発症と進行においてDNAに変異を蓄積し、がん遺伝子を誕生させます。例えばエキソンシャッフリング(図2A)と類似の方法で多数の融合遺伝子を誕生させる場合があります。ORFドミナンスはどの融合遺伝子のRNAが翻訳され、がん進展を促進しているかを予測するために有用である可能性があります。また、がん細胞ではノンコーディングRNAから翻訳されたタンパク質はネオアンチジェンとして細胞表面に提示され、腫瘍免疫の標的になっています。ORFドミナンスがネオアンチジェンの同定に有用であれば、免疫チェックポイント阻害剤の有効性予測やがん免疫療法後の効果判定に貢献できる可能性があります。
コーディング/ノンコーディングRNAの境界の曖昧さOdomが生物の個体数と関連することから、進化学や保全生物学における絶滅予測にも有用である可能性があります。例えば希少な生物種であるために生態学的調査によってその個体数を推定することが困難である場合でも、少数個体の全RNA配列を調べてORFドミナンスを計算することで個体数や絶滅リスクの推定に貢献できる可能性があります。
共同研究チーム
国立がん研究センター研究所 生物情報学分野 分野長 加藤 護
東北大学 大学院生命科学研究科 進化ゲノミクス分野 教授 牧野 能士
研究支援
本研究は以下の支援を受けて行われました。
日本医療研究開発機構(AMED)
医療分野国際科学技術共同研究開発推進事業 Interstellar Initiative(18jm0610006h0001)
安田記念医学財団 若手癌研究助成
武田科学振興財団 医学系研究助成
原論文情報
- タイトル
- Open reading frame dominance indicates protein-coding potential of RNAs
- 著者
- Yusuke Suenaga1,*,†, Mamoru Kato2,†, Momoko Nagai2, Kazuma Nakatani1,3,4, Hiroyuki Kogashi1,3, Miho Kobatake1, Takashi Makino5
- 所属
-
- Department of Molecular Carcinogenesis, Chiba Cancer Centre Research Institute, Chiba, Japan
- Division of Bioinformatics, National Cancer Centre Research Institute, Tokyo, Japan
- Department of Molecular Biology and Oncology, Chiba University School of Medicine, Chiba, Japan
- Innovative Medicine CHIBA Doctoral WISE Program, Chiba University School of Medicine, Chiba, Japan
- Laboratory of Evolutionary Genomics, Graduate School of Life Sciences, Tohoku University, Sendai, Japan
- *. 責任著者
†. 同等貢献 - 掲載雑誌
- ヨーロッパ分子生物学機構の科学誌『EMBO Reports』
- DOI
- 10.15252/embr.202154321
- 論文発表日
- 令和4年4月19日(火)(EMBO Reports)
- 論文掲載URL
- https://www.embopress.org/doi/10.15252/embr.202154321
お問い合わせ先
本研究に関すること
千葉県がんセンター 研究所 発がん制御研究部
上席研究員 末永 雄介(すえなが ゆうすけ)
報道に関すること
千葉県がんセンター事務局医事経営課
小野 勇祐(おの ゆうすけ)
AMED の事業に関すること
医療分野国際科学技術共同研究開発推進事業Interstellar Initiative
国際戦略推進部 国際戦略推進課 国際連携推進室