2022-04-20 生理学研究所
概要
自然科学研究機構生命創成探究センター/生理学研究所の村田和義特任教授、北里大学の片山和彦教授らの共同研究チームは、集団性下痢症の原因ウイルスの一つサポウイルスの殻(カプシド)の構造を世界で初めて原子レベルで決定し、サポウイルスがノロウイルスを含む同種の下痢症ウイルスとは異なるカプシド構造を持つことを報告しました。この研究成果は、サポウイルスの感染メカニズムの解明に大きく貢献し、サポウイルスに対する治療薬やワクチンの開発を大きく加速すると期待されます。
本研究成果は、日本時間 2022年 4月 18日22時に、米国の国際学術誌「Journal of Virology」に公開されました。
1.背景
サポウイルスは、ノロウイルスと同様に世界中で流行しているウイルス性急性胃腸炎の主要な原因物質です。1997年に札幌の児童福祉施設における集団食中毒において初めて「サッポロウイルス」として報告され、2002年の国際委員会で正式にカリシウイルス科サポウイルス属サッポロウイルス種のウイルスとして分類上の名前が決まりました。ノロウイルス属ノーウォークウイルス種のウイルスの属名が“ノロウイルス”であるのと同様に、一般的には属名で“サポウイルス”と呼ばれています。
サポウイルスを電子顕微鏡で観察すると「六角星」に例えられるその特徴的な表面構造(図1左)が認められます。この粒子形態上の特徴からノロウイルスと容易に区別することが可能です。サポウイルスは、直径約40 nmの正二十面体構造をした粒子で、その粒子を形成するタンパク質の殻(カプシド)の中にウイルス遺伝子のRNAが内包されています。国内においては、散発性の流行性急性胃腸炎の他、ウイルスで汚染された食品を介して集団食中毒を引き起こすことがあり、ノロウイルスと並ぶ社会問題になっています。
抗ウイルス薬やワクチンの開発には、ウイルスがどのように宿主の細胞に感染するのか、ウイルスがどのように中和(解毒化)されるのか、を調べるためのウイルス粒子の詳細な構造解析や免疫原性研究が必要になります。ところが、サポウイルスはノロウイルスに比べ、これらを研究するためのウイルス様中空粒子(VLP)※1の作製が難しく、研究が著しく遅れていました。
この様な状況の中、同研究チームは、ヒトサポウイルスGI.6株でVLPの作製に成功し、これをクライオ電子顕微鏡※2という超高精度に構造を解析できる装置を用いて立体的に解析することで、世界で初めてサポウイルスのカプシドの構造を原子のレベルまで詳細に解明することができました。
2.研究成果
本研究では、サポウイルスの高品質なVLPを作製し、この約3000枚の高分解能画像をクライオ電子顕微鏡で収集しました(図1左)。そして、そこから約2万3千のウイルス粒子を取り出してコンピュータで立体再構成することで、2.9Å(1Åは水素原子の直径に相当)の解像度でウイルスの構造を明らかにしました(図1右)。その結果、サポウイルスのカプシドの突起は、二重のアミノ酸どうしの相互作用でできた薄い屋根構造からなるアーチ型を示すことがわかりました(図2の1,2層)。これまでサポウイルスは、アーチ型カプシド突起が三重の屋根構造を持つカリシウイルス科のベシウイルスと似た表面構造を持つと考えられてきましたが、今回の研究により、実際にはサポウイルスのカプシドの突起は、二重の屋根構造となっており、想定と大きく異なることがわかりました。
また、カプシドの突起の先端には、感染宿主によって多様に変異する4つの領域(Hypervariable region:HVR)が集中していることが明らかになりました(図2 中のHVR1-4)。そして、そのすぐ近くに、ホスト細胞との結合を担うアミノ酸のほとんどが局在すると推定されました(図2中の*)。これらの結果は、宿主の認識を行う領域と、宿主細胞と結合する領域が、より近くに存在することを示しています。これは一方で、HVR1-4を激しく変化させることで、細胞との結合を担う領域を多様な宿主の免疫の攻撃から保護する役割があるのではないかとも考えられました。今後さらに研究を進めることによってこれらの意味が明らかになってくると期待されます。

図1 サポウイルスVLPのクライオ電子顕微鏡像と2.9Å分解能の三次元再構成像。
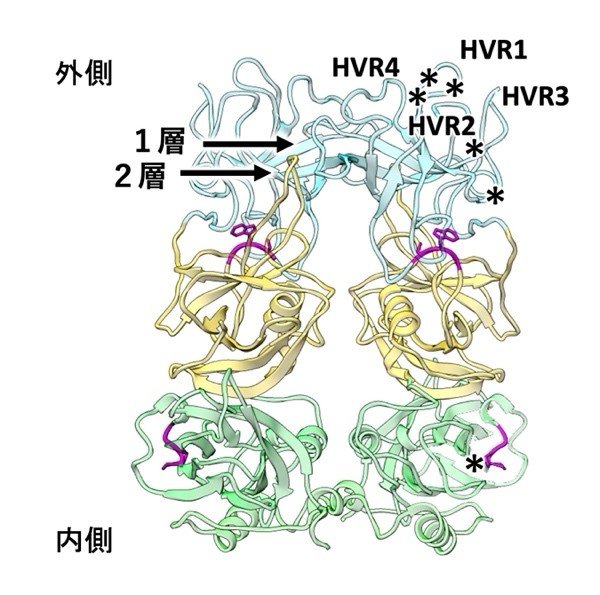
図2 サポウイルスのカプシド構造。二重のアミノ酸どうしの相互作用(1、2層)でできた薄い屋根構造からなるアーチ型を示す。HVR1-4は、感染宿主によって多様に変異する領域を示す。*はブタのサポウイルスで明らかになったホスト細胞との結合を担うアミノ酸残基。ラベルは2量体の一方のみを示す。
3.成果の意義および今後の展開
本研究では、世界で初めてサポウイルスの高品質VLPの作製に成功し、これをクライオ電子顕微鏡で解析することでカプシドの構造を原子のレベルで決定することができました。今後、この構造情報をもとに、サポウイルスの感染の仕組みが明らかになるとともに、効果的なワクチンの作製、治療薬の開発を行なえるようになります。この構造をもとにサポウイルス研究が大きく加速されると期待されます。
<助成金などの必要情報>
本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業、日本学術振興会(JSPS) 科学研究費補助金、生理研共同研究等のサポートを受けて実施されました。
今回の発見
- サポウイルスの殻(カプシド)の構造を原子レベルで決定しました。
- サポウイルスのカプシドの突起は、ノロウイルスをはじめとする同種の下痢症ウイルスとは異なり、二重のアミノ酸どうしの相互作用でできた比較的薄い屋根構造からなるアーチ型を示しました。
- カプシドの突起の先端には、感染宿主によって変異する領域(Hypervariable region)が4つ密集し、そのそばにホスト細胞との結合を担う領域が存在することが分かりました。
- この構造をもとにして、より効果的な治療薬やワクチンのデザインが可能になると期待されます。
用語解説
※1 ウイルス様中空粒子(VLP)
ウイルスのカプシドタンパク質を昆虫の細胞に大量に作らせて、ウイルス粒子を試験管の中で形成させたもの。ウイルスと同じ形を持つが、粒子内部に遺伝子を含まない中空の粒子。遺伝子を含まないため感染性がなく、ワクチンなどとして利用されることもある。一般に、VLP(Virus-like Particles)と呼ばれる。
※2 クライオ電子顕微鏡
電子顕微鏡によって生体分子の構造を、溶液中のような生理的な環境に近い状態で観察するために開発された手法。試料溶液を約-170℃の液体エタンを用いて急速凍結させ、試料を薄い非晶質氷の中に包埋する。この凍結させた試料を約-200℃での液体窒素(約-200℃)冷却のもと電子顕微鏡観察する。このように冷却することで電子線照射による試料へのダメージも軽減させることができる。
論文情報
雑誌名:Journal of Virology
論文タイトル:Atomic structure of the human sapovirus capsid reveals a unique capsid protein conformation in caliciviruses
著者: Naoyuki Miyazaki, Chihong Song, Tomoichiro Oka, Motohiro Miki, Kosuke Murakami, Kenji Iwasaki, Kazuhiko Katayama, Kazuyoshi Murata*
(*責任著者)
掲載予定日:日本時間2022年4月18日22時
DOI:https://doi.org/10.1128/jvi.00298-22
論文URL:https://journals.asm.org/doi/10.1128/jvi.00298-22
・発表者
宮崎直幸(筑波大学),Chihong Song(生命創成探究センター/生理学研究所),岡智一郎(国立感染症研究所),三木元博(デンカ株式会社),村上耕介(国立感染症研究所)、岩崎憲治(筑波大学),片山和彦(北里大学),村田和義(生命創成探究センター/生理学研究所)
お問い合わせ
<研究について>
自然科学研究機構 生理学研究所/生命創成探究センター
特任教授
村田 和義(ムラタ カズヨシ)
北里大学大村智記念研究所ウイルス感染制御学研究室/
大学院感染制御科学府ワクチン学
教授
片山 和彦(カタヤマ カズヒコ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 生命創成探究センター 研究戦略室
学校法人北里研究所 総務部広報課