2022-07-21 国立遺伝学研究所
私たちの体の生体組織は細胞と細胞外基質から構成され、細胞間の隙間はコラーゲン線維などの細胞外基質で埋め尽くされた狭い空間です。この生体組織内を移動するガン細胞から白血球の運動に至るまで、単一細胞の自律運動では細胞内から細胞外への力伝達が不可欠です。そこでは,細胞内に網目状に張り巡らされたアクチン細胞骨格の収縮力が外部の基板に伝達され、細胞を前進させます。しかし、効率的な力伝達を可能にする仕組みは細胞の複雑さのため研究が困難でした。
九州大学理学研究院 前多裕介准教授、坂本遼太同博士課程学生(現:イェール大学 ポストドクトラルフェロー)、Ziane Izri同学術研究員(現:ミネソタ大学 ポストドクトラルフェロー)らの研究グループは、京都大学白眉センター 宮﨑牧人特定准教授、情報・システム研究機構国立遺伝学研究所 島本勇太准教授らと共に、生体内を移動するガン細胞を模した、自律的に運動する「人工細胞」を開発し、力伝達の仕組みを初めて明らかにしました。本研究チームは、脂質膜に囲まれた液滴のカプセルにアクチンを閉じ込めて単純化した人工細胞を作成しました。この人工細胞を2枚のガラス板に挟むと、アクチンの流れが人工細胞の表面とガラス基板の間に摩擦力を生み、自律的に運動できることを世界で初めて発見しました。さらに、狭い空間に拘束された運動を記述する新しい理論モデルを構築し、界面摩擦力と流体抵抗のバランスで運動速度が決まることを解明しました。本研究により、効率的な力の伝達に不可欠な物理的要因を明らかにしたことは、生体組織内を運動する細胞運動の力伝達メカニズムの理解に貢献する成果です。今後、ガン細胞の転移を抑えこむ方法論の開発の一助となり、狭い空間を移動するマイクロ・ロボットの設計などへの波及効果が期待されます。
本研究はJSPS科研費 JP18H05427、JP20H01872、JP21K18605(研究代表者:前多裕介)、JP19J20035(研究代表者:坂本遼太)、JP 19H05393(研究代表者:宮﨑牧人)、JP19H03201,JP20K21404(研究代表者:島本勇太)、Human Frontier Science Program研究グラント(RGP0037/2015、研究代表者:前多裕介)、JST戦略的創造研究推進事業さきがけ(JPMJPR20ED、研究代表者:宮﨑牧人)、京都大学白眉センター(研究代表者:宮﨑牧人)の助成を受けたものです。
本研究成果は、2022年7月20日 (米国東部時間)に米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」で公開されました。
遺伝研の貢献
遊走する人工細胞作製の鍵となる細胞質抽出液をアフリカツメガエルの卵から高活性で精製する技術を提供しました。
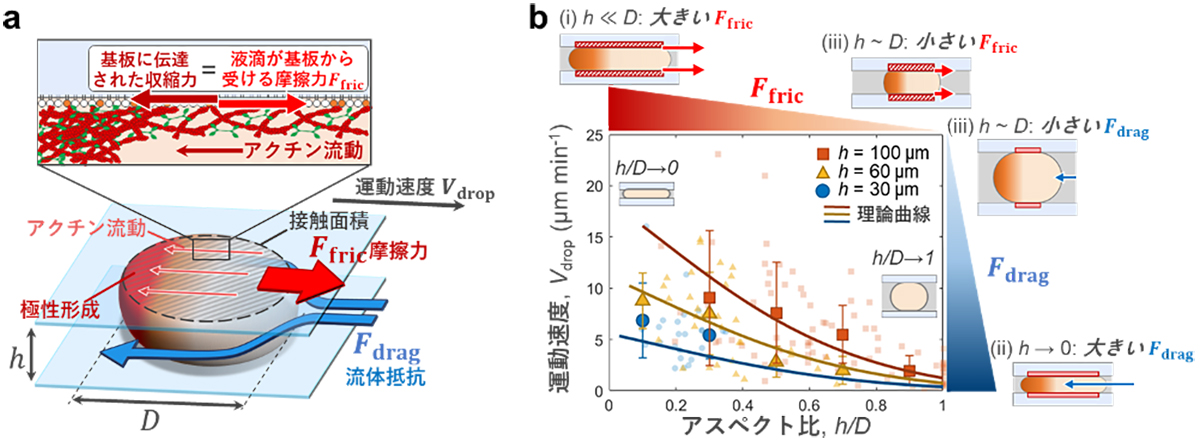
図: (a) アクチン流動による界面摩擦と流体抵抗のバランスで人工細胞の運動速度が決まるモデル。(b) 基板の高さh、人工細胞の直径Dを変化させたときの運動速度の閉じ込め形状への依存性。2つの長さの比(アスペクト比)であるh/Dが1よりずっと小さい人工細胞は扁平な形、h/Dが1に近い場合は球形をしている。同じ高さでは、図の右から左に向けて液滴の直径が大きくなることで摩擦力が増加し、運動速度が増加する。図の上から下にかけて、基板の高さが低くなることで流体抵抗の寄与が大きくなり、運動速度が減少する。
Geometric trade-off between contractile force and viscous drag determines the actomyosin-based motility of a cell-sized droplet
Ryota Sakamoto, Ziane Izri, Yuta Shimamoto, Makito Miyazaki, and Yusuke T. Maeda
PNAS (2022) 119, e2121147119 DOI:10.1073/pnas.2121147119