2022-08-02 東京大学,東京理科大学,大阪大学,理化学研究所,中部大学
発表のポイント
◆セントロメア(注1)は染色体の交差部位であり、染色体の等分配に働く重要なDNA領域です。1885年、細胞核におけるセントロメアの配置パターンが発見されて以来、130年以上もの間、分子メカニズムは謎のままでした。
◆セントロメアの空間配置を分散型パターンにする制御因子群を突き止め、空間配置の分子メカニズムを明らかにしました。セントロメアの空間配置パターンの変化は遺伝子発現に影響を与えません。その代わり、DNA損傷ストレス(注2)への耐性に関与している可能性があります。
◆今回の知見は、DNAの空間配置パターンを制御できる方法の開発につながり、将来的にストレスに強い生物を作り出すことが可能になります。
発表概要
細胞が分裂する際、DNAは凝縮して染色体になり、その後、二つの細胞に等しく分配されます。その時、染色体の交差部位にあるセントロメアという特別なDNA領域が、紡錘糸に引っ張られ両極に移動します。分裂が終了すると、染色体は脱凝縮して細胞核が構築されます。その時、両極に引っ張られたセントロメアの分布が変わらなければ、セントロメアが片方に偏在する細胞核になり(図1)、セントロメアの偏在が解消されバラバラに核膜内膜上に分散すれば、分散型の細胞核になります。
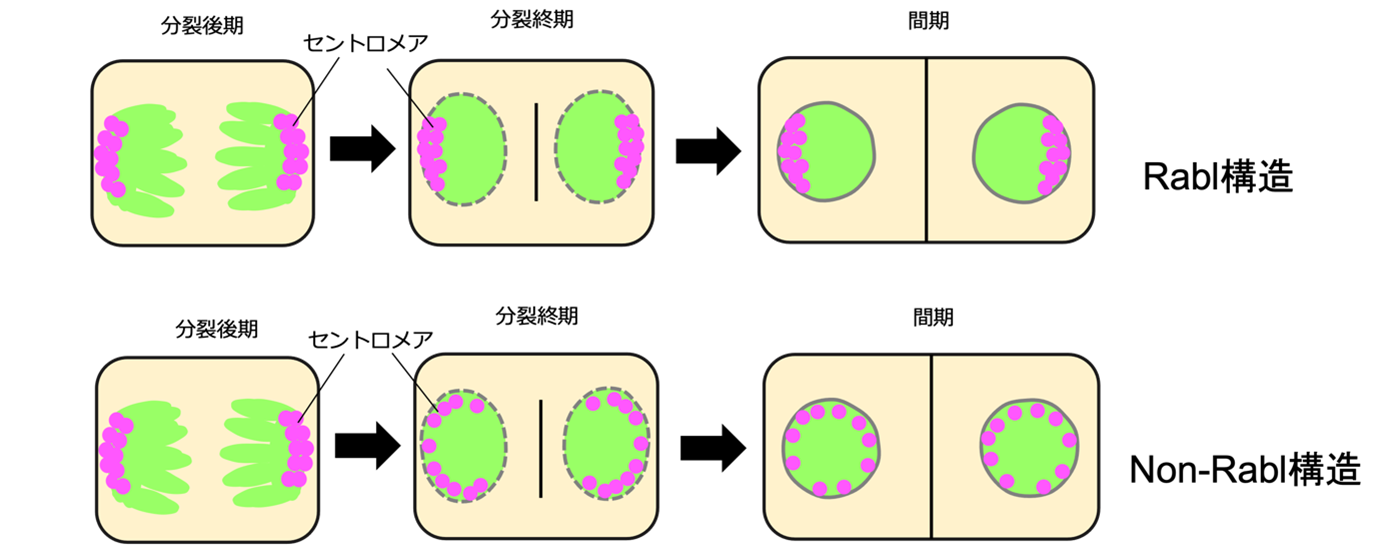
図1 Rabl構造とnon-Rabl構造
マジェンタはセントロメア、緑色はDNAを示す。
1885年、オーストリアのカール ラブル(Carl Rabl)博士は、セントロメアが偏在する細胞核構造(Rabl構造、注3)を発見しました。それ以来、細胞核には、セントロメアが偏在するRabl構造、セントロメアが分散するnon-Rabl構造の二つの空間配置パターンがあることがわかっていました。例えば、酵母、ショウジョウバエ、コムギなどのセントロメアの空間配置はRabl構造をとりますが、ヒトやシロイヌナズナなどではnon-Rabl構造をとります。どちらの配置パターンを取るかは進化系統による特徴から見出されず、これまで、なぜ、生物によってセントロメアの空間配置が変化するのか、また、その空間配置の分子メカニズムも不明でした。
東京理科大学理工学部の坂本卓也講師と東京大学大学院新領域創成科学研究科の松永幸大教授らは、大阪大学、理化学研究所、中部大学などと共同で、シロイヌナズナの変異体を使用してセントロメアを分散配置させるタンパク質群(CII-LINC複合体およびCRWN)の同定に成功し、二つの分子経路によってセントロメアの分散型パターンが形成されることを明らかにしました。1885年以来、130年以上、謎であったセントロメアの空間配置パターンの分子メカニズムが明らかになりました。この研究成果により、DNAの空間配置制御メカニズム研究の扉を開くことができました。
また、正常なセントロメアの空間配置ができなくなると、DNA損傷ストレスを受けた時に器官成長が悪くなることがわかりました。これは、生物がDNA損傷ストレスに対応するためには、細胞核内の適切なDNAの空間配置が必要なことを示しています。今後、人為的に細胞核内にDNAを適切に空間配置する技術が開発されれば、ストレスに強い生物を作り出すことが可能になると考えられます。
本研究は、文部科学省科学研究費・新学術領域「植物の成長可塑性を支える環境認識と記憶の自律分散型統御システム」(15H05955)「環境刺激によるクロマチン動態制御機構の解明」(15H05962)「植物の成長可塑性を支える環境認識と記憶の自律分散型統御システム」(15K21750)、学術変革領域A「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」(20H05911)、基盤研究A「植物再生を制御する転写待機メカニズムの分子基盤解明」(22H00415)、基盤研究B「核内構造ダイナミクスを司る染色体相互作用メカニズムの解明」(26291067)「植物再分化を制御するクロマチン構造変換メカニズムのイメージング解析」(19H03259)「染色体微細加工で逆位・転座が植物ゲノムに与える影響を見る」(20H03297)、基盤研究C「植物核ラミナによるセントロメア配置制御機構の解明」(21K06247)、JST-CREST「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」(JPMJCR20S6)、武田科学財団助成、東京理科大学国際共同研究支援費などのもとで実施されました。
発表内容
各染色体に由来するDNAは3次元的にパッケージングされ、細胞核内で決まった空間配置を取ります。この空間配置の発見は古く、1885年にオーストリアのカール ラブル(Carl Rabl)博士が、キボシサンショウウオの細胞分裂を観察している時に、染色体が見えなくなって細胞核になっても、染色体の凝縮していた方向性は維持されたまま、細胞核の中にDNAが配置されていることを発見し提唱しました。
細胞が分裂する時に、DNAは凝縮して染色体となり、両極方向に引っ張られて二等分されます。両極に引っ張られた染色体は、セントロメアと呼ばれる特殊なDNA領域です。二等分された後の染色体群は脱凝縮して、細胞核になります。その細胞核において、細胞分裂の時にセントロメアが引っ張られた状態のまま空間配置を維持することがあります。このように、セントロメアが細胞核内に偏ったまま配置される構造のことをRabl構造と呼びます。一方、セントロメアの偏った配置が解消されて、細胞核内に分散する構造をnon-Rabl構造と呼びます。
Rabl構造はすべての生物に見られるわけではなく、例えば、ヒトやシロイヌナズナなどの生物の細胞核では、セントロメアはnon-Rabl構造を取ります。Rabl構造は進化的な系統とは関係なく、酵母、ショウジョウバエ、コムギなど様々な生物種の細胞核で報告されていました。そのため、Rabl構造を取る生物と取らない生物が存在する理由や、non-Rabl構造を作る分子メカニズムの詳細は不明なままでした。
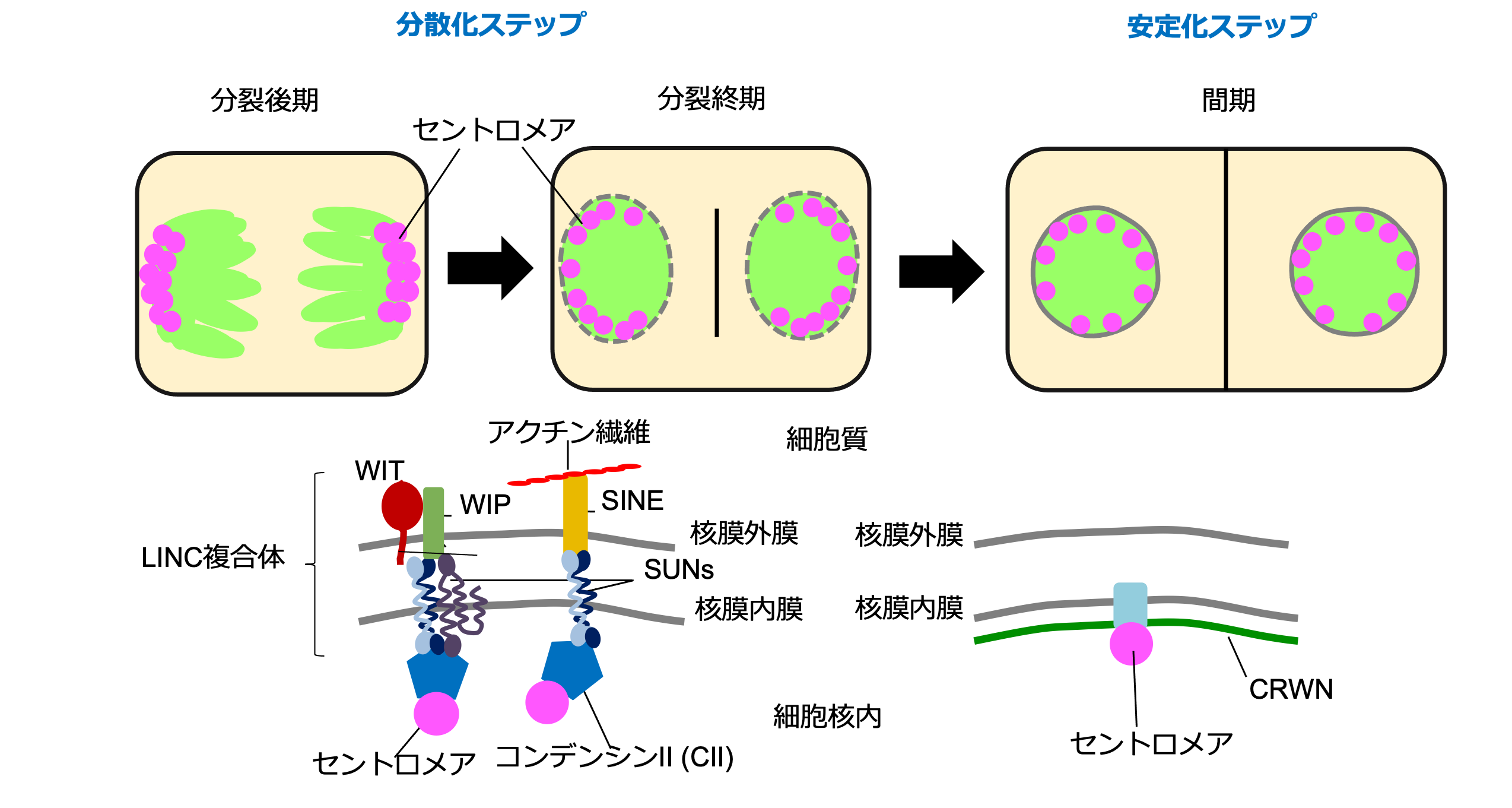
non-Rabl構造を取るシロイヌナズナの変異体の細胞核を蛍光顕微鏡で観察して、セントロメア配置を調べている時、ある変異体はRabl構造を取ることがわかりました(図2)。その変異体は、染色体凝縮に関与するコンデンシンII(CII、注4)のタンパク質が欠損した変異体でした。さらに、細胞核の膜である核膜を貫いて存在しているLINC(細胞核・細胞骨格連結複合体、注5)のタンパク質が欠損した変異体も同様にRabl構造を示すことがわかりました。
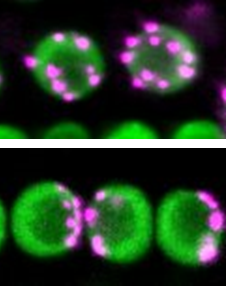
図2 細胞核(緑)内におけるセントロメア(マジェンタ)の空間配置パターン
上がnon-Rabl型(分散パターン)、下がRabl型(偏在パターン)
さらに、CIIとLINCは細胞核内で複合体を形成し、non-Rabl構造を作成するために働くことがわかり、その複合体をCII-LINC複合体と命名しました。LINC複合体は核膜に埋め込まれているため、核膜の裏打ちタンパク質であるCRWN(注6)の変異体も調べましたが、CRWN欠損変異体はnon-Rabl構造のままでした。しかし、セントロメアの動きを生きたまま解析するライブイメージング解析により、CRWNの変異体ではセントロメアの動きが活発化していることが観察され、CRWNはセントロメアの空間配置を固定化する役割を果たしていることがわかりました。
これらの結果から、細胞分裂後にセントロメアが分散型のnon-Rabl構造のような空間配置を取るためには、(1)細胞分裂後期に両極に偏って分布しているセントロメアが、CII-LINCにより細胞核内に分散する(2)細胞核が形成された後に、CRWNによって分散配置が安定化する(図3)という二つのステップが存在することがわかりました。
図3 セントロメアの分散パターンが作り出す分散化ステップと安定化ステップ
次に、non-Rabl構造を取る正常なシロイヌナズナとRabl構造を取る変異体(CII-LINCが働かなくなったシロイヌナズナ)の遺伝子発現を解析しました。セントロメアの空間配置が変化することで遺伝子の空間配置も変化するので、遺伝子発現への影響が考えられましたが、両植物間で遺伝子発現の差はほとんどなく、常識を覆す結果になりました。
ところが、DNA損傷ストレスを与えるとnon-Rabl構造を取る正常なシロイヌナズナに比較して、Rabl構造を取る変異体は器官の成長速度が遅くなりました。これは、セントロメアの空間配置制御を正確に行うことが、DNA損傷ストレスに対応して器官成長することに必要であることを示唆しています。non-Rabl構造とRabl構造を取る生物間でDNA損傷ストレスに対する耐性に差がないことから、Rabl構造の有無ではなく、生物にとってDNAが適切な空間配置を取ることがストレス対応に重要であることが示唆されたと言えます。
今後、特定のDNA領域の空間配置を変える動力源や、特定のDNAを認識する仕組みなどを明らかにする必要があります。このような知見が明らかになれば、人為的に細胞核内にDNAを適切に空間配置する技術開発に繋がります。その技術によって、ストレスに強い生物を作製できるほか、DNAの塩基配列の改変ではなく空間配置を変化させることで新しい性質や機能を付与することが可能になることが期待されます。
発表雑誌
雑誌名:Nature Plants(オンライン版:8月1日)
論文タイトル:Two-step regulation of centromere distribution by condensin II and the nuclear envelope proteins
著者:Takuya Sakamoto†*, Yuki Sakamoto†, Stefan Grob, Daniel Slane, Tomoe Yamashita, Nanami Ito, Yuka Oko, Tomoya Sugiyama, Takumi Higaki, Seiichiro Hasezawa, Maho Tanaka, Akihiro Matsui, Motoaki Seki, Takamasa Suzuki, Ueli Grossniklaus, Sachihiro Matsunaga*
†同等貢献、*責任著者
DOI番号:10.1038/s41477-022-01200-3
発表者
坂本 卓也(東京理科大学理工学部応用生物科学科 講師)
坂本 勇貴(大阪大学大学院理学研究科生物科学専攻 助教)
ステファン グロブ(チューリッヒ大学植物・微生物学部 グループリーダー)
ダニエル スラネ(東京大学大学院新領域創成科学研究科先端生命科学専攻 客員共同研究員)
伊藤 ななみ(東京大学大学院新領域創成科学研究科先端生命科学専攻 博士課程1年)
檜垣 匠(熊本大学大学院先端科学研究部附属生物環境農学国際研究センター 教授)
馳澤 盛一郎(東京大学大学院新領域創成科学研究科先端生命科学専攻 名誉教授)
関 原明(理化学研究所環境資源科学研究センター植物ゲノム発現研究チーム チームリーダー)
鈴木 孝征(中部大学応用生物学部応用生物化学科 教授)
ウエリ グロスニクラス(チューリッヒ大学植物・微生物学部 教授)
松永 幸大(東京大学大学院新領域創成科学研究科先端生命科学専攻 教授)
用語解説
(注1)セントロメア
染色体を構成する染色分体が交差した部分のこと。X字型の染色体の場合、交わった部分に相当する。このDNA部分に紡錘糸が接続して、細胞分裂の時に染色体を両極に引っ張ることで、等分配する。染色体が脱凝縮後もDNAとしてまとまって存在するため、DNAの空間配置を知るうえで重要な指標となる。
(注2)DNA損傷ストレス
DNAに傷を与えるストレス。DNAに傷が入ると、器官発生の異常が生じたり、病気を発症したりする。生物を化学物質、放射線、重金属などに暴露することで、DNA損傷ストレスを与えることができる。
(注3)Rabl構造
細胞核において、細胞分裂した時の極性を保ってDNAが空間配置された構造のこと。細胞分裂の際に、セントロメアが最初に両極に移動し、染色体末端のテロメアが最後に移動する。このため、この極性を保ったままDNAが空間配置された場合は、片方にセントロメアの塊ができた構造になる。
(注4)コンデンシンII(CII)
DNAが凝縮して染色体となることを制御しているタンパク質。
(注5)LINC
細胞核・細胞骨格連結複合体と呼ばれるタンパク質複合体。細胞核膜を貫いて存在しており、細胞質側は、細胞骨格と相互作用する。
(注6)核膜の裏打ちタンパク質CRWN
植物の細胞核の内膜に網目状に存在するタンパク質。細胞核の形態を物理的に支持するほか、タンパク質やDNAが結合して機能するプラットフォームとしての役割もある。2020年に、坂本勇貴博士と松永幸大教授の研究グループが、植物の核膜裏打ちタンパク質がCRWNであることを証明した。
お問い合わせ
新領域創成科学研究科 広報室