Gタンパク質共役型受容体は、すでに数百種類の薬剤に利用されているが、これまで知られていなかった機能を持つことがわかり、未開拓の可能性を示唆している G protein-coupled receptors are already leveraged in hundreds of diverse drugs; the discovery that they function in a way not previously known suggests untapped potential
2022-10-26 カリフォルニア大学サンディエゴ校(UCSD)
GPCRは、真核生物(核や他の小器官を含む細胞)の膜受容体の中で最大かつ最も多様なグループで、細胞表面に存在し、糖、タンパク質、脂質、ペプチドなどの形で届くメッセージの受信箱として、細胞間のコミュニケーションを根本的に制御するなど、身体機能において様々な役割を担っている。
その結果、高血圧、喘息、酸逆流などあらゆる疾患の重要な治療ターゲットとなり、糖尿病、肥満、アルツハイマー病などの症状を緩和する可能性が検討されています。
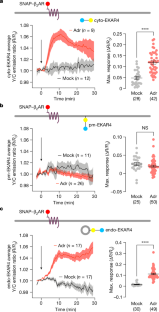
研究チームは、細胞膜では基本的にERKシグナルが発生していないことを突き止めた。GPCRを介したERKシグナルは、エンドソーム(細胞内の小器官で、細胞表面から内部への物質の輸送や、不要な物質の分解・再利用・輸送を支援する)で発生するのである。GPCRはエンドソームを通じて輸送されることが知られている。
GPCRが介在するERKシグナルは、エンドソームで活性化されると核に伝播し、そこで細胞増殖を制御する重要な遺伝子をオンにすることを発見した。
この発見は、GPCRが制御するERKシグナルは細胞表面から発生するというパラダイムを覆すものです。活性化した受容体が細胞内に存在することを示した最近の研究に加え、このデータは、GPCRを介したERKシグナルが、ホルモン結合した活性化受容体が関与するエンドソームで発生することを示している。
今回の研究により、GPCRが下流でシグナル伝達を行う方法には、より大きな多様性があることが示唆された。
<関連情報>
- https://today.ucsd.edu/story/popular-pharmaceutical-target-in-cells-may-prove-even-more-useful
- https://www.nature.com/articles/s41586-022-05343-3
エンドソームにおける非正規のβ-アドレナリンによるERK活性化 Non-canonical β-adrenergic activation of ERK at endosomes
Yonghoon Kwon,Sohum Mehta,Mary Clark,Geneva Walters,Yanghao Zhong,Ha Neul Lee,Roger K. Sunahara & Jin Zhang
Nature Published:26 October 2022
DOI:https://doi.org/10.1038/s41586-022-05343-3
Abstract
G-protein-coupled receptors (GPCRs), the largest family of signalling receptors, as well as important drug targets, are known to activate extracellular-signal-regulated kinase (ERK)—a master regulator of cell proliferation and survival1. However, the precise mechanisms that underlie GPCR-mediated ERK activation are not clearly understood2,3,4. Here we investigated how spatially organized β2-adrenergic receptor (β2AR) signalling controls ERK. Using subcellularly targeted ERK activity biosensors5, we show that β2AR signalling induces ERK activity at endosomes, but not at the plasma membrane. This pool of ERK activity depends on active, endosome-localized Gαs and requires ligand-stimulated β2AR endocytosis. We further identify an endosomally localized non-canonical signalling axis comprising Gαs, RAF and mitogen-activated protein kinase kinase, resulting in endosomal ERK activity that propagates into the nucleus. Selective inhibition of endosomal β2AR and Gαs signalling blunted nuclear ERK activity, MYC gene expression and cell proliferation. These results reveal a non-canonical mechanism for the spatial regulation of ERK through GPCR signalling and identify a functionally important endosomal signalling axis.