2023-01-04 テキサス大学オースチン校(UT Austin)
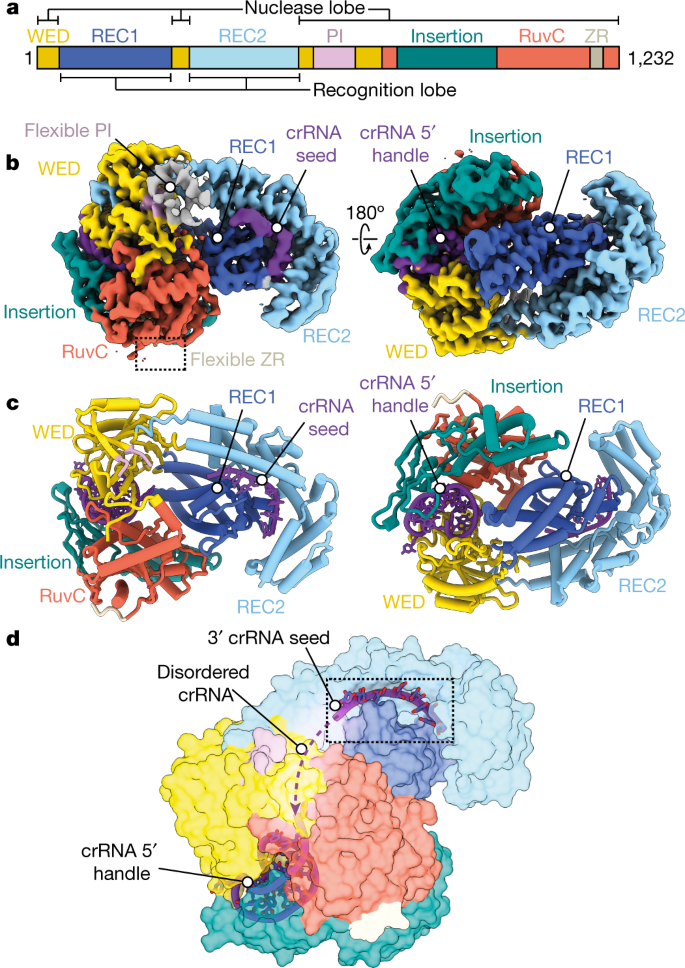
研究チームは、クライオ電子顕微鏡と呼ばれる高解像度イメージング技術を使って、Cas12a2と名付けられたこのタンパク質が、危険性のあるウイルスの標的RNAと呼ばれる特定の遺伝子配列に結合すると、Cas12a2の側面がスイングして、飛び出した刃物のような活性部位が現れることを突き止めた。そして、この活性部位が、接触したあらゆる遺伝物質を無差別に切断し始めるのである。研究チームは、Cas12a2タンパク質に1つの変異を加えることで、活性部位が一本鎖DNAのみを分解することを発見した。この特徴は、さまざまなウイルスに対応した新しい診断薬の開発に特に有効である。
この技術に基づく検査は、理論的には、ウイルスの遺伝物質を検出するPCRベースの検査の長所(高感度、高精度、活発な感染を検出する能力)と家庭用迅速診断検査の長所(特別な実験装置を必要とせず安価に製造できる)を兼ね備えている。また、新しいRNAウイルスにも簡単に適応できるだろう。
テキサス大学オースティン校の分子生物学准教授で、この研究の共同執筆者であるDavid Taylor氏は、「明日、新しいウイルスが出現した場合、そのゲノムを調べて、テスト用のガイドRNAを変更するだけで、そのウイルスに対するテストが可能になります」と語っている。
Nature誌の同号に掲載された論文では、Cas12a2の生物学的機能について述べられており、本ニュースリリースに掲載された論文では、このタンパク質がそれらを達成するメカニズムについて述べられています。
<関連情報>
- https://news.utexas.edu/2023/01/04/how-a-crispr-protein-might-yield-new-tests-for-many-viruses/
- https://www.nature.com/articles/s41586-022-05560-w
CRISPR-Cas12a2の無差別ヌクレアーゼ活性を発揮するRNAターゲティング RNA targeting unleashes indiscriminate nuclease activity of CRISPR–Cas12a2
Jack P. K. Bravo,Thomson Hallmark,Bronson Naegle,Chase L. Beisel,Ryan N. Jackson & David W. Taylor
Nature Published:04 January 2023
DOI:https://doi.org/10.1038/s41586-022-05560-w
Abstract
Cas12a2 is a CRISPR-associated nuclease that performs RNA-guided, sequence-nonspecific degradation of single-stranded RNA, single-stranded DNA and double-stranded DNA following recognition of a complementary RNA target, culminating in abortive infection1. Here we report structures of Cas12a2 in binary, ternary and quaternary complexes to reveal a complete activation pathway. Our structures reveal that Cas12a2 is autoinhibited until binding a cognate RNA target, which exposes the RuvC active site within a large, positively charged cleft. Double-stranded DNA substrates are captured through duplex distortion and local melting, stabilized by pairs of ‘aromatic clamp’ residues that are crucial for double-stranded DNA degradation and in vivo immune system function. Our work provides a structural basis for this mechanism of abortive infection to achieve population-level immunity, which can be leveraged to create rational mutants that degrade a spectrum of collateral substrates.