糖尿病におけるセリン代謝の変化が末梢神経障害を引き起こすことを発見-高リスク患者を特定する新たな方法と治療法の選択肢を提供する可能性 Scientists discover that altered serine metabolism in diabetes leads to peripheral neuropathy—a finding that may provide a new way to identify people at high risk and a potential treatment option
2023-01-25 カリフォルニア大学サンディエゴ校(UCSD)
◆この研究は、2023年1月25日発行のNature誌に掲載されたもので、しばしば過小評価される「非必須アミノ酸」の一部が神経系で重要な役割を担っているという証拠が増えつつあります。この研究結果は、末梢神経障害のリスクが高い人を特定する新たな方法を提供するとともに、治療法の選択肢となる可能性があります。研究チームは、カリフォルニア大学サンディエゴ校の生物工学教授プラシャント・マリ、マイクロバイオームの専門家ロブ・ナイト教授、病理学者ナイジェル・A・カルカットらで構成されています。
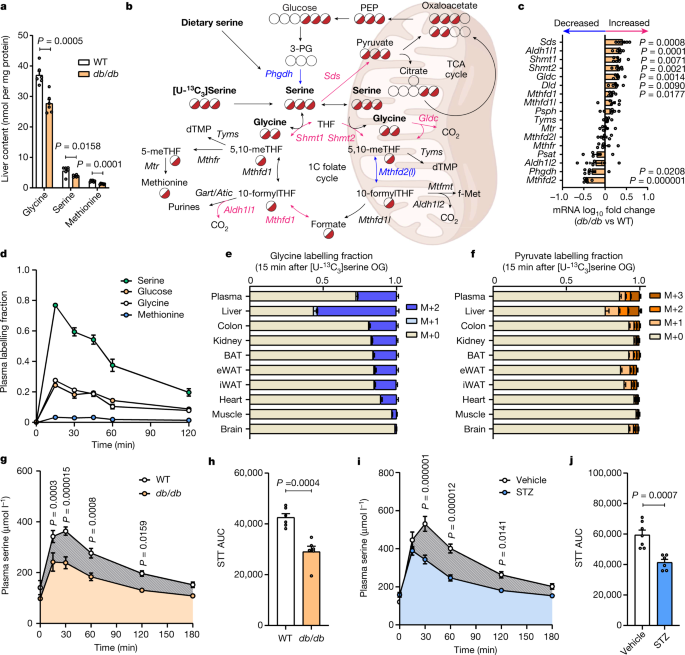
◆アミノ酸は、タンパク質と、神経系に多く存在するスフィンゴ脂質と呼ばれる特殊な脂肪分子を構成するビルディングブロックである。セリンというアミノ酸が少ないと、体はスフィンゴ糖脂質に別のアミノ酸を取り込まざるを得なくなり、構造が変化する。この非定型スフィンゴ糖脂質が蓄積すると、末梢神経の障害につながる可能性がある。研究チームは、この蓄積を糖尿病マウスで観察したが、同じアミノ酸スイッチとスフィンゴ脂質の変化は、末梢感覚神経障害を示すヒトのまれな遺伝病でも起こっており、この現象は多くの種で一貫していることがわかった。
◆研究チームは、長期にわたる慢性的なセリン不足が末梢神経障害を引き起こすかどうかを調べるため、マウスに対照食またはセリン除去食と、低脂肪食または高脂肪食のいずれかを最長12カ月間与えた。その結果、低セリンと高脂肪食の組み合わせでは、マウスの末梢神経障害の発症が促進されることが判明したのは意外であった。一方、糖尿病マウスにセリンを補給すると、末梢神経障害の進行が遅くなり、マウスの命が延びた。
◆さらに、スフィンゴ糖脂質が組み立てられる際に、セリンを別のアミノ酸に置き換える酵素を阻害する化合物ミリオシンの試験も行った。その結果、ミリオシンを投与したところ、高脂肪・無セリン食を与えたマウスの末梢神経障害の症状が軽減された。これらの結果は、健康な末梢神経系の維持には、アミノ酸代謝とスフィンゴ脂質の産生が重要であることを強調するものである。
◆また、セリンの欠乏は、さまざまな神経変性疾患と関連している。例えば、研究チームは以前、視力低下を引き起こす黄斑毛細血管拡張症2型の患者において、セリンとスフィンゴ脂質の代謝の変化との関連性を発見している。マウスでは、セリンの減少により、網膜の非定型スフィンゴ脂質のレベルが上昇し、視力が低下した。現在、セリンは、黄斑毛細血管拡張症やアルツハイマー病に対する安全性と有効性が臨床試験で検証されています。
<関連情報>
- https://today.ucsd.edu/story/serine-eases-neuropathy-in-diabetic-mice
- https://www.nature.com/articles/d41586-023-00054-9
インスリンによって制御されるセリンおよび脂質代謝が末梢神経障害を促進する Insulin-regulated serine and lipid metabolism drive peripheral neuropathy
Michal K. Handzlik,Jivani M. Gengatharan,Katie E. Frizzi,Grace H. McGregor,Cameron Martino,Gibraan Rahman,Antonio Gonzalez,Ana M. Moreno,Courtney R. Green,Lucie S. Guernsey,Terry Lin,Patrick Tseng,Yoichiro Ideguchi,Regis J. Fallon,Amandine Chaix,Satchidananda Panda,Prashant Mali,Martina Wallace,Rob Knight,Marin L. Gantner,Nigel A. Calcutt & Christian M. Metallo
Nature Published:25 January 2023
DOI:https://doi.org/10.1038/s41586-022-05637-6
Abstract
Diabetes represents a spectrum of disease in which metabolic dysfunction damages multiple organ systems including liver, kidneys and peripheral nerves1,2. Although the onset and progression of these co-morbidities are linked with insulin resistance, hyperglycaemia and dyslipidaemia3,4,5,6,7, aberrant non-essential amino acid (NEAA) metabolism also contributes to the pathogenesis of diabetes8,9,10. Serine and glycine are closely related NEAAs whose levels are consistently reduced in patients with metabolic syndrome10,11,12,13,14, but the mechanistic drivers and downstream consequences of this metabotype remain unclear. Low systemic serine and glycine are also emerging as a hallmark of macular and peripheral nerve disorders, correlating with impaired visual acuity and peripheral neuropathy15,16. Here we demonstrate that aberrant serine homeostasis drives serine and glycine deficiencies in diabetic mice, which can be diagnosed with a serine tolerance test that quantifies serine uptake and disposal. Mimicking these metabolic alterations in young mice by dietary serine or glycine restriction together with high fat intake markedly accelerates the onset of small fibre neuropathy while reducing adiposity. Normalization of serine by dietary supplementation and mitigation of dyslipidaemia with myriocin both alleviate neuropathy in diabetic mice, linking serine-associated peripheral neuropathy to sphingolipid metabolism. These findings identify systemic serine deficiency and dyslipidaemia as novel risk factors for peripheral neuropathy that may be exploited therapeutically.