ゲノム編集した患者さん由来iPS細胞・ヒトiPS細胞ストックともに成功
2018-11-16 京都大学iPS細胞研究所 ,日本医療研究開発機構
ポイント
- ヒトT細胞から作製したiPS細胞(T-iPS細胞)から、ヒトの体内のキラーT細胞により近い再生キラーT細胞注1)を誘導する新たな条件を見出した。
- しかし、再生キラーT細胞を誘導する過程の(DP胸腺細胞注2))の段階において、余計なT細胞受容体(TCR)注3)の再構築が起こり、抗原注4)を特定する能力が低下することが明らかになった。
- そこで、T-iPS細胞において、遺伝子の機能をゲノム編集で無効にすると(遺伝子ノックアウト)、余計なTCRの再構築をすることもなく、安定的なTCRを備え、がん細胞に対して有効な攻撃をするキラーT細胞を作製することができた。
- 一方で、T細胞に由来しないiPS細胞ストック注5)(HLAホモiPS細胞ストック)を用いる場合、抗原情報を備えたTCRを導入するのみで、抗原を特定できる再生キラーT細胞を作製することができた。
- TCRを安定化させて抗原を特定する能力は、副作用の回避にも有用であり、がん免疫療法への実用化が期待される。
要旨
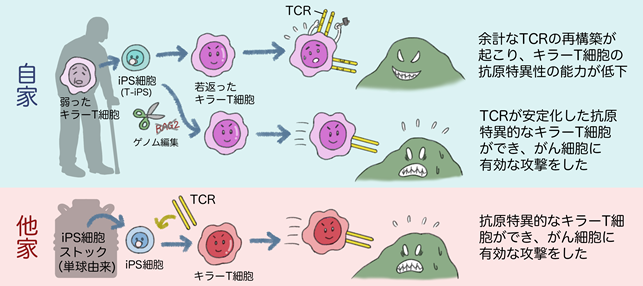
南川淳隆研究生(京都大学CiRA、東京大学大学院、T-CiRA)、および金子新准教授(京都大学CiRA、T-CiRA)らの研究グループは、ヒトT細胞由来iPS細胞細胞を用いてがん細胞を攻撃するキラーT細胞を作製し、その性質を調べました。すると、作製した再生キラーT細胞は生体内のキラーT細胞により近い性質を持つ一方で、DP胸腺細胞という前駆細胞の段階において、生体内での発生同様にT細胞受容体の再構築が起こる、つまり余計な再構築が起こるために本来の抗原を特定する能力が低下することが分かりました。そこで、T細胞受容体再構築を引き起こす遺伝子をヒトT細胞由来iPS細胞においてゲノム編集で除外することにより、余計なT細胞受容体の再構築を防ぐことに成功し、生体内/外においてがん細胞に対して有効な攻撃をしかけるキラーT細胞を誘導できることを確認しました。
一方で、T細胞に由来しないiPS細胞であるHLAホモiPS細胞ストックのiPS細胞を用いる場合、抗原情報を備えたT細胞受容体を導入するのみで抗原特異性の安定したキラーT細胞を作製することが出来ました。T細胞受容体を安定化させて抗原特異性を維持することは、治療効果の向上のみならず副作用の回避にも有用です。これらの結果は、iPS細胞由来T細胞を用いたがん免疫療法の実用化に向けた安全性と有効性を示す結果の一つとなります。
論文の概要図
(TCR:T細胞受容体)
研究の背景
がんの治療には、外科治療、放射線治療、化学療法に加えて第4の治療法として免疫療法が注目されています。がんの免疫療法ではがん細胞を攻撃するキラーT細胞が要となりますが、キラーT細胞を多数得ることが難しいことと、キラーT細胞ががん細胞に攻撃を続けることによって次第に疲弊してしまうことが課題でした。そこで、患者さんの疲弊したキラーT細胞からiPS細胞を作製し、再びキラーT細胞へ分化させることで、元気に若返らせたキラーT細胞をたくさん作る手法が開発されました。その若返らせたキラーT細胞が元のキラーT細胞の抗原についての情報を継承していることから、がん免疫治療に有効だと考えられています(Nishimura T, Kaneko S et al., 2013, Cell Stem Cell)。
しかし、これまでのT細胞の研究から、より質の高いキラーT細胞を誘導するにはDP胸腺細胞というキラーT細胞の前駆細胞を経る必要があることが示唆されていました。
本研究で研究グループは先ず、DP胸腺細胞を経て質の高いキラーT細胞を誘導する新たな手法を確立しました。そしてDP胸腺細胞の段階では余計なT細胞受容体の再構築が普遍的におこり、それによってキラーT細胞の抗原特異性の能力が落ちることを見出しました。安全で有効ながん免疫治療法開発には、キラーT細胞のがん細胞への抗原特異性を完全にする必要があるため、その安定性を高めることを目的とした実験を進めました。
研究結果
1)ヒトT細胞由来iPS細胞から作製した再生キラーT細胞では、DP胸腺細胞の段階において、余計なT細胞受容体の再構築が起こり、抗原を特定する能力が低下することが分かりました。
本研究ではまず、以前に報告した手法を用いて、がん患者さんの血液の中にあるキラーT細胞からiPS細胞を作製しました。さらに、T細胞由来iPS細胞から再びキラーT細胞に分化させる方法を確立し、DP胸腺細胞の段階とT細胞分化を終えた後でのT細胞受容体遺伝子発現を解析しました。すると、がん細胞で発現される抗原に反応するキラーT細胞(抗原特異的キラーT細胞)は、本来100%近くであるはずがCD8β注6)が発現しているT細胞のうち68.9%の割合でした(図1a-c)。また、CD8α+CD8β+ が発現している全てのキラーT細胞の中でみると、約40%が抗原特異性を失っていることが分かりました。
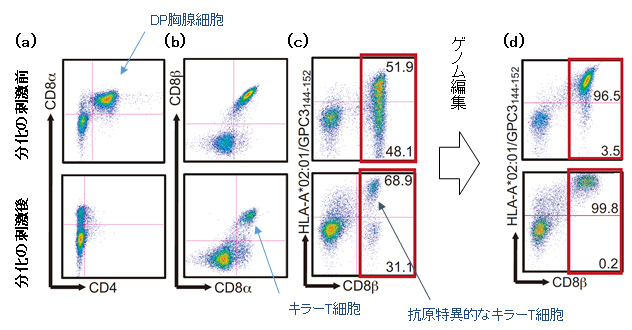
図1: iPS細胞からキラーT細胞へ分化させる刺激を与える前と与えた後での遺伝子発現の比較
(a)キラーT細胞はCD8だけを発現(CD4–CD8+)する。 また、DP胸腺細胞は、CD4とCD8を共に発現するので、図中のCD4+CD8α+に分布する細胞はDP胸腺細胞。
(b)分化刺激後の図中CD8α+CD8β+に分布する細胞はキラーT細胞。
(c)HLA-A*02:01/GPC3144-152はがん細胞で発現される抗原を認識するT細胞受容体に反応する試薬。分化刺激後にこのT細胞受容体を発現し、CD8β+に分布する細胞は抗原特異的なキラーT細胞。CD8β+の分画において68.9%の割合で分布している。(つまり、DP胸腺細胞においてT細胞受容体の再構築が起こっている)
(d)RAG2遺伝子をゲノム編集で取り除いた後の遺伝子発現の変化。CD8β+の分画において抗原特異的なキラーT細胞が99.8%の割合にまで上昇した。
2)ヒトT細胞由来iPS細胞をゲノム編集すると、余計なT細胞受容体の再構築をすることもなく、安定的なT細胞受容体を備え、がん細胞に対して有効な攻撃をする再生キラーT細胞を作製することができました。
ここまでの実験で、DP胸腺細胞の段階で余計なT細胞受容体が再構築されていることがわかり、T細胞受容体の再構築にはRAG2遺伝子が関わっていることも分かりました。そこで、研究グループは、CRISPR/Cas9注7)を用いてヒトT細胞由来iPS細胞からRAG2遺伝子を除外して、余計なT細胞受容体の再構築が起こることを防ぎました。ゲノム編集後の遺伝子を解析すると、抗原特異的キラーT細胞の割合がCD8β+の分画において99.8%まで上昇しました(図1d)。
次に、培養器内での細胞の機能を確認するため、ゲノム編集後の再生キラーT細胞とがん細胞を共培養すると、再生キラーT細胞がすばやくがん細胞を認識し、死滅させる様子が確認されました(図2)。さらに、がんのモデルマウスにゲノム編集後の再生キラーT細胞を2回に分けて投与し観察すると、投与したマウスは、投与しないマウスに比べ寿命が延び、がん腫瘍の大きさの測定結果から、がんの進行も遅くなることが分かりました(図3)。以上の結果から、ヒトT細胞由来iPS細胞のRAG2をゲノム編集で除外すると、生体内/外においてがん細胞に対して有効な攻撃をしかける再生キラーT細胞が作製できることが確認できました。
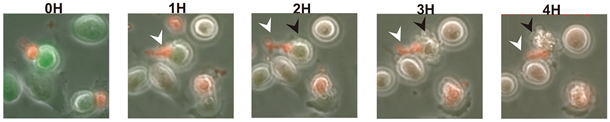
図2:ゲノム編集後の再生キラーT細胞(赤色)ががん細胞(緑色)を認識し、死滅させる様子
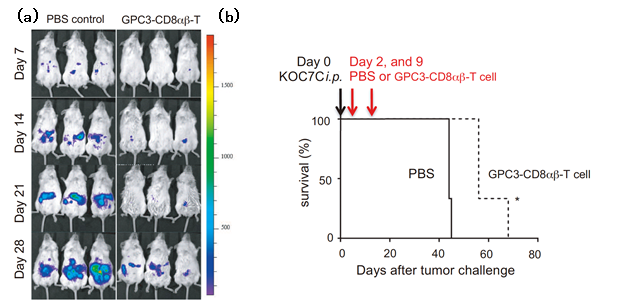
図3:がんのモデルマウスの実験
(a)がんのモデルマウスにゲノム編集後の再生キラーT細胞を2回(Day2とDay9)に分けて投与したときのがん細胞の推移(PBS control: 対照群、GPC3-CD8αβ-T: ゲノム編集後の再生キラーT細胞を移植した群)。
(b)実験におけるマウスの生存率の推移。
3)iPS細胞ストックを用いて、抗原情報を備えたT細胞受容体を導入することで、抗原を特定できる再生キラーT細胞を作製することができました。
これまでの研究は患者さん自身の細胞からヒトT細胞由来iPS細胞を作製する自家移植のがん免疫治療法を目指した研究でしたが、今後多くの方にがん免疫治療法をお届けするには、他家移植の再生医療を目指したiPS細胞ストックを用いる方法があります(免疫細胞の再生医療は、HLAホモ接合体注8)を適合した場合、他家移植における拒絶反応のリスクが低いと言われています)。研究グループは、最後に、末梢血(末梢血内の単球)由来iPS細胞ストックを用いた方法で研究を行いました。
まず、iPS細胞ストックからキラーT細胞を作製する上で、抗原特異性を持たせるため、抗原情報を持ったT細胞受容体を導入して分化の刺激を加えました。次に、分化させた細胞を遺伝子解析してキラーT細胞に特徴的な遺伝子を確認し、作製した再生キラーT細胞とがん細胞を共培養させて、再生キラーT細胞ががん細胞を攻撃することを確認しました。さらに、がんのモデルマウスに再生キラーT細胞を2回に分けて投与し観察すると、投与したマウスは、投与しないマウスや、末梢血から取り出したキラーT細胞(iPS細胞を介さない)に同じT細胞受容体遺伝子を導入して移植したマウスに比べ、寿命が延び、がん腫瘍の大きさの測定結果から、がんの進行も遅くなることが分かりました。以上の結果から、iPS細胞ストックを用いた方法でも、生体内/外においてがん細胞に対して有効な攻撃をしかける再生キラーT細胞が作製できることが確認できました。
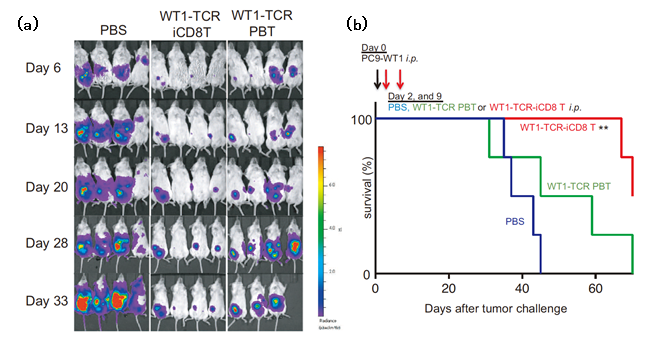
図4:がんのモデルマウスの実験
(a)がんのモデルマウスにiPS細胞ストックから作製した再生キラーT細胞を2回(Day2とDay9)に分けて投与したときのがん細胞の推移(PBS control: 対照群、WT1-TCR iCD8T: iPS細胞由来キラーT細胞を移植した群(T細胞受容体導入)、WT1-TCR PBT:末梢血から取り出したキラーT細胞を移植した群(T細胞受容体導入)。
(b)実験におけるマウスの生存率の推移
本研究の意義と今後の展望
iPS細胞などの多能性幹細胞を用いた免疫細胞の再生医療は、がんの免疫療法において自家移植、他家移植共に大きく期待されています。本研究では、がん免疫療法の一つの課題として、キラーT細胞のがん細胞への抗原特異性の能力が低下してしまうことを見出し、T細胞受容体を安定化させる手法がキラーT細胞の抗原特異性の低下を防ぐことを明らかにしました。さらに、本研究では患者さん自身の細胞とiPS細胞ストックの細胞の双方からT細胞受容体が安定した抗原特異的キラーT細胞を作製することに成功しました。本研究の成果は自家移植と他家移植におけるがんの免疫療法の実用化に向けて安全性と有効性を向上させる重要な結果の一つとなります。
論文名と著者
- 論文名
- “Enhancing T cell Receptor Stability in Rejuvenated iPSC-derived T cells improves their use in cancer immunotherapy”
- ジャーナル名
- Cell Stem Cell
- 著者
- Atsutaka Minagawa1,2,3, Toshiaki Yoshikawa4, Masaki Yasukawa5, Akitsu Hotta1, Mihoko Kunitomo3,6, Shoichi Iriguchi1,3, Maiko Takiguchi3,6, Yoshiaki Kassai3,6, Eri Imai1, Yutaka Yasui1, Yohei Kawai1, Rong Zhang4, Yasushi Uemura4, Hiroyuki Miyoshi7, Mahito Nakanishi8, Akira Watanabe1, Akira Hayashi3,6, Kei Kawana2, Tomoyuki Fujii2, Tetsuya Nakatsura4, and Shin Kaneko1,3*
- 著者の所属機関
-
- 京都大学 iPS細胞研究所(CiRA)
- 東京大学大学院 医学系研究科・医学部 生殖・発達・加齢医学専攻産婦人科学講座
- T-CiRA 共同プログラム
- 国立がん研究センター 先端医療開発センター
- 愛媛大学大学院医学系研究科 血液・免疫・感染症内科学
- 武田薬品工業株式会社
- 慶應義塾大学 医学部・医学研究科 生理学教室
- 国立研究開発法人産業技術総合研究所 創薬基盤研究部門
*:責任著者
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)「免疫機構をターゲットとした創薬」(がん特異抗原glypican-3を標的としたiPS細胞由来再生T細胞療法の開発)
- 国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業 領域3「iPS細胞に由来するキメラ抗原受容体(CAR)発現再生T細胞の非臨床試験」
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点
- 文部科学省 科学研究費補助金 新学術領域研究
- 文部科学省 科学研究費補助金 基盤研究(B)
- 文部科学省 科学研究費補助金 挑戦的萌芽研究
- 国立がん研究センター研究開発費
- 公益財団法人 武田科学振興財団
用語説明
- 注1)キラーT細胞、ヘルパーT細胞
- 免疫においてはたらく細胞の一種。ヘルパーT細胞は抗原注4)を認識してその情報を他の免疫細胞に伝えるはたらきをもつ。すると、その抗原に対応するキラーT細胞が活性化し、異物を攻撃して分解する。
- 注2)DP胸腺細胞(double positive thymocyte)
- ヘルパーT細胞とキラーT細胞へ分化できる未成熟なT細胞。胸腺というリンパ器官で分化・成熟する。
- 注3)T細胞受容体
- T細胞の細胞膜上に発現している抗原受容体分子のことを示す。
- 注4)抗原
- 生体内に入ると免疫系を刺激して、特異的な反応を誘発させる物質の総称。がん細胞も抗原であり、その抗原に結合できるT細胞受容体注3)を持つキラーT細胞だけが、がん細胞の抗原に結合して活性化し、がん細胞を攻撃できる。抗原に合ったT細胞受容体を持たないキラーT細胞は活性化されず、がん細胞を攻撃できない。
- 注5)再生医療用iPS細胞ストック
- HLAホモ接合体の細胞を有する健康なドナーからiPS細胞を作製し、あらかじめ様々な品質評価を行った上で、再生医療に使用可能と判断できるiPS細胞株を保存するプロジェクト。
- 注6)CD4、CD8
- 細胞表面上のマーカー分子。ヘルパーT細胞や樹状細胞、マクロファージなどで発現している。ヘルパーT細胞は、CD4だけを発現(CD4+CD8–)し、キラーT細胞はCD8だけを発現(CD4–CD8+)する。 また、ヘルパーT細胞とキラーT細胞の共通の祖先であるDP胸腺細胞は、CD4とCD8を共に発現していることからDP胸腺細胞(CD4+CD8+)と呼ばれる。
- 注7)CRISPR/Cas9
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)という塩基配列とCas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。ゲノム編集技術の一つ。
- 注8)HLAホモ接合体
- ヒトの主要組織適合遺伝子複合体であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する型。ヒトの免疫に関わる重要な分子として働く。自身の持っている型と異なるHLA型の人から細胞や臓器の移植を受けると、体が「異物」と認識し、免疫拒絶反応が起こる。そのため、細胞や臓器を移植する際にはHLA型をできるだけ合わせることで、免疫拒絶反応を弱めることができると考えられる。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
大内田 美沙紀
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
戦略推進部 がん研究課