2019-02-05 東京大学,理化学研究所,大阪大学,東北大学,岩手医科大学,日本医療研究開発機構
発表者
門脇 孝(東京大学大学院医学系研究科 糖尿病・生活習慣病予防講座 特任教授)
山内 敏正(東京大学大学院医学系研究科 内科学専攻 代謝・栄養病態学/医学部附属病院 糖尿病・代謝内科 教授)
鈴木 顕(大阪大学大学院医学系研究科 遺伝統計学 助教(2018年3月までは、東京大学大学院医学系研究科 内科学専攻 代謝・栄養病態学 博士課程))
堀越 桃子(理化学研究所 生命医科学研究センター 腎・代謝・内分泌疾患研究チーム チームリーダー)
鎌谷 洋一郎(理化学研究所 生命医科学研究センター 統計解析研究チーム チームリーダー/京都大学大学院医学研究科 京都大学・マギル大学ゲノム医学国際連携専攻)
岡田 随象(大阪大学大学院医学系研究科 遺伝統計学 教授)
発表のポイント
- 20万人規模の日本人集団の遺伝情報を用いたゲノムワイド関連解析を行い、糖尿病治療薬の標的分子であるGLP-1受容体のミスセンス変異など、2型糖尿病の危険性を高める遺伝的変異を新たに同定しました。
- 2型糖尿病の遺伝において、日本人集団と欧米人集団に共通する、または相違がある分子生物学的パスウェイを明らかにしました。
- 本研究成果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防の応用につながることが期待されます。
発表概要
2型糖尿病は脳卒中・心筋梗塞・腎不全・がんなど、万病の危険性を高める重大な病気であり、日本国内で1,000万人、世界中で4億人以上が2型糖尿病と言われています。2型糖尿病のかかりやすさは、遺伝と環境の両方によって影響されますが、日本人集団における2型糖尿病の遺伝の理解は不十分でした。
東京大学大学院医学系研究科の門脇孝特任教授、山内敏正教授、理化学研究所生命医科学研究センターの堀越桃子チームリーダー、鎌谷洋一郎チームリーダー、大阪大学大学院医学系研究科 岡田随象教授、鈴木 顕助教らの研究グループは、20万人規模の日本人集団の遺伝情報を用いた大規模ゲノムワイド関連解析(GWAS、注1)を行い、2型糖尿病の危険性を高める遺伝子領域を新たに28箇所同定しました。また、2型糖尿病治療薬の標的分子であるGLP-1受容体のミスセンス変異(注2)が2型糖尿病の危険性と関わることを見出しました。このミスセンス変異は薬剤投与後のインスリン分泌を増加させるため、薬の効き方を予測する指標に応用できる可能性があります。
2型糖尿病の遺伝において、膵臓のβ細胞(注3)が日本人集団と欧米人集団に共通して重要である一方、インスリン分泌を調節する経路など日本人集団においてより大きな影響を有する分子生物学的パスウェイを見出しました。
これらの結果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防に応用できる可能性があります。
本研究は国立研究開発法人日本医療研究開発機構(AMED)のゲノム医療実現推進プラットフォーム事業「先端ゲノム研究開発」(GRIFIN)領域における研究開発課題「糖尿病の遺伝・環境因子の包括的解析から日本発次世代型精密医療を実現するプロジェクト」(研究開発代表者:門脇孝)、「オーダーメイド医療の実現化プロジェクト」の「糖尿病・メタボリックシンドローム関連疾患の個別化医療実現」(研究開発代表者:門脇孝)の一環で行われました。その成果は日本時間2019年2月5日午前1時(米国東部標準時 2019年2月4日午前11時)に米国科学雑誌 Nature Geneticsオンライン版に掲載されます。
発表内容
2型糖尿病は、慢性的な高血糖状態が続くことにより、脳卒中・心筋梗塞・腎不全・がんなど、万病の危険性を高める重大な病気であり、遺伝的・環境的要因を含む複数の原因によって引き起こされることが知られています。今日、日本国内で約1,000万人、世界中で4億人以上が2型糖尿病を患っていると推測されており、世界的にも重要な医学的問題となっています。これまでゲノムワイド関連解析(genome-wide association study; GWAS)により、多くの2型糖尿病の危険性を高める遺伝子領域が同定されていますが、これらは主に欧米人集団を対象とした研究で同定されてきました。しかし、ウエスト周囲長または体格指数(body mass index; BMI)が同程度の場合、日本人集団では欧米人集団よりも2型糖尿病発症の危険性が高く、日本人集団と欧米人集団では2型糖尿病の疫学は異なることが知られています。この違いは、2つの民族集団における2型糖尿病の病因が異なる可能性があることを示しています。
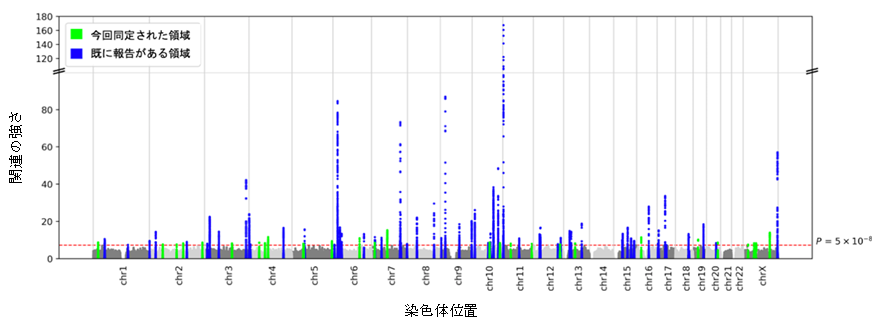
そこで日本人集団の2型糖尿病の遺伝素因を解明するために、日本人集団における4種類の2型糖尿病のゲノムワイド関連解析の結果を統合し、メタ解析を行いました(2型糖尿病 36,614例および対照群 155,150例)。本研究で解析対象となった検体はバイオバンク・ジャパン、東北大学東北メディカル・メガバンク機構、岩手医科大学いわて東北メディカル・メガバンク機構、多目的コホート研究、日本多施設共同コーホート研究より提供されました。メタ解析では、88の遺伝子領域がゲノムワイドの有意水準をもって2型糖尿病と関連しており、うち28領域はこれまでに報告のない新規領域でした(図1)。同一領域に存在する複数の独立した関連シグナルを見つけるために、段階的条件付き分析を行ったところ、さらに27個のシグナルを追加で検出し、シグナルの総数は115となりました。
各シグナルにおける原因変異および原因遺伝子についての洞察を得るために、同定した115の2型糖尿病シグナルと重なるミスセンス変異を検索しました。各2型糖尿病シグナルにおいて最も強い関連を示した変異と重なる、28種類のミスセンス変異を同定し、このうち15のミスセンス変異については2型糖尿病との関連が未報告の変異でした。15の新規ミスセンス変異には膵腺房細胞(注4)にだけ発現し、分化を誘導するGP2や、インスリン分泌に関連するインクレチンの一つであるGLP-1の受容体(GLP-1R)が含まれていました。特筆すべきはGLP-1RのR131Q変異(注5)であり、これは日本人集団では多くの人が持っている変異でしたが、欧米人集団ではほとんどの人が持っていない稀な変異でした(図2a, b)。2型糖尿病の危険性を下げるGLP-1R R131Q変異(図2c, d)は、GLP-1によって誘導されるインスリン分泌を2倍以上にすることが報告されており、個人毎の薬剤反応性マーカーとして応用できる可能性があります。また、日本人集団では欧米人集団と比較してGLP-1受容体作動薬を含むインクレチン関連薬の有効性が高いことが知られており、そのメカニズム解明につながる可能性があります。
次に、Roadmap Epigenomicsプロジェクトが提供する細胞や組織におけるエピゲノム(注6)情報を活用し、2型糖尿病のゲノムワイド関連解析の結果と統合する横断的オミックス解析を実施しました。この解析では層別化LDスコア回帰(注7)を用いてそれぞれの細胞・組織のヒストン修飾領域における2型糖尿病の遺伝率(注8)の集積を定量化し、各細胞・組織が2型糖尿病発症に関してどれだけ重要であるかを評価しました。220種類の細胞・組織エピゲノム情報のうち、膵島(注9)のH3K27acにおいて最も強く2型糖尿病の遺伝率が集積していました。H3K27acは遺伝子発現を調節するエンハンサーに特徴的なエピジェネティック修飾であることが知られています。
2型糖尿病と他の疾患や形質との間に共通する遺伝的背景を評価するために、二変量LDスコア回帰(注10)を用いて、日本人集団における2型糖尿病と91の多因子形質(32の多因子疾患および59の量的形質)との間の遺伝的背景の相関関係を計算しました。既に知られている心血管疾患やBMIなどとの相関を認めたほか、2型糖尿病と後縦靭帯骨化症および白血球数との間に有意な正の相関があることを見出しました。
2型糖尿病の遺伝素因における分子生物学的な洞察を得るために、日本人集団と欧米人集団の2型糖尿病GWASを対象に民族横断的な分子生物学的パスウェイ解析(注11)を実施しました(表1)。1,077のパスウェイのうち、日本人集団および欧米人集団において2型糖尿病と有意に関連していたパスウェイ数は、それぞれ17と13でした。特に、若年成人発症型糖尿病(maturity onset diabetes of the young; MODY)に関わるパスウェイが両民族集団において2型糖尿病と最も強く関連していることを世界で初めて見出しました。 MODYはβ細胞機能の障害を特徴とする、たった一つの遺伝子異常により発症する遺伝性の糖尿病です。また、β細胞の発生、発生生物学、前立腺がん、およびG1期に関わるパスウェイも、両方の民族集団において2型糖尿病と関連していました。一方、インスリン分泌調節に関わるパスウェイは、日本人集団においてのみ、2型糖尿病と有意な関連を示しました。
これらの結果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防に応用できる可能性があります。
本研究の論文投稿中に2型糖尿病の感受性領域に関する研究が複数報告され、本研究で同定した新規2型糖尿病感受性領域の一部と重なりが認められました(文献1~4)。特に、ごく最近発表された欧米人集団の2型糖尿病を対象とした90万人規模のGWAS(文献1)では、新規に135領域が報告されていますが、本研究グループが日本人集団で新規に同定した28領域との重なりは8領域のみでした。残り20領域は日本人集団におけるGWASにおいてのみ有意な関連が認められる領域であることが確認されました。
発表雑誌
- 雑誌名:
- 「Nature Genetics」
- 論文タイトル:
- Identification of 28 new susceptibility loci for type 2 diabetes in the Japanese population.
- 著者:
- Ken Suzuki, Masato Akiyama, Kazuyoshi Ishigaki, Masahiro Kanai, Jun Hosoe, Nobuhiro Shojima, Atsushi Hozawa, Aya Kadota, Kiyonori Kuriki, Mariko Naito, Kozo Tanno, Yasushi Ishigaki, Makoto Hirata, Koichi Matsuda, Nakao Iwata, Masashi Ikeda, Norie Sawada, Taiki Yamaji, Motoki Iwasaki, Shiro Ikegawa, Shiro Maeda, Yoshinori Murakami, Kenji Wakai, Shoichiro Tsugane, Makoto Sasaki, Masayuki Yamamoto, Yukinori Okada, Michiaki Kubo, Yoichiro Kamatani*, Momoko Horikoshi*, Toshimasa Yamauchi*, Takashi Kadowaki*
- DOI番号:
- 10.1038/s41588-018-0332-4
用語解説
- (注1)ゲノムワイド関連解析(Genome-wide association study; GWAS)
- 糖尿病などの疾患や体重などの量的な形質に影響があるゲノム上の変異を、網羅的に検索する手法。2002年に、理化学研究所が世界に先駆けて報告を行っており、以降、さまざまな疾患や量的形質に関連する感受性遺伝子領域の同定に貢献している。
- (注2)ミスセンス変異
- タンパク質を構成するアミノ酸が別のアミノ酸に変化するような変異。
- (注3)β細胞
- 膵臓の内分泌腺に存在し、血糖値を下げるホルモンであるインスリンを分泌する細胞。
- (注4)膵腺房細胞
- 膵臓の外分泌腺に存在して消化酵素などを産生分泌する細胞で、膵臓全体の90%以上を占める。十数個の細胞で腺房とよばれる1つの構造単位を形成する。膵腺房細胞は膵β細胞などの内分泌細胞と発生学的には同一の膵前駆細胞から分化することが知られている。
- (注5)R131Q変異
- GLP-1Rの131番目のアミノ酸がアルギニンからグルタミンに変わる変異。
- (注6)エピゲノム
- 細胞の中にあるゲノムDNAや、DNAが巻き付いているヒストン蛋白質に後天的に施されるメチル化やアセチル化などの化学修飾。
- (注7)層別化LDスコア回帰
- ゲノム領域を機能やエピゲノム情報などに基づきカテゴリーに分け、疾患や形質の遺伝率がどのカテゴリーに集積しているかを評価する方法。
- (注8)遺伝率
- 身長や体重、糖尿病などの、多くの遺伝的変異が関与する形質において、遺伝的変異の影響が占める割合のこと。
- (注9)膵島
- 膵臓の内部に島の形で散在する、インスリンなどのホルモンを分泌する細胞群。
- (注10)二変量LDスコア回帰
- 2つの疾患や形質のGWASのデータを基に、遺伝的背景がお互いどの程度相関しているかを評価する方法。
- (注11)分子生物学的パスウェイ解析
- 分子生物学的な機能ごとに遺伝子やタンパク質の相互作用をまとめたものを分子生物学的パスウェイと呼ぶ。分子生物学的パスウェイ解析とは、既存の分子生物学的パスウェイのデータベースを利用し、GWASで有意となった変異がどのパスウェイに集積しているかを定量的に評価する手法である。
引用文献
- Mahajan, A. et al. Fine-mapping type 2 diabetes loci to single-variant resolution using high-density imputation and islet-specific epigenome maps. Nat. Genet. 50, 1-14 (2018).
- Grarup, N. et al. Identification of novel high-impact recessively inherited type 2 diabetes risk variants in the Greenlandic population. Diabetologia 61, 2005–2015 (2018).
- Xue, A. et al. Genome-wide association analyses identify 143 risk variants and putative regulatory mechanisms for type 2 diabetes. Nat. Commun. 9, 1–14 (2018).
- Kwak, S. H. et al. Nonsynonymous variants in PAX4 and GLP1R are associated with type 2 diabetes in an East Asian population. Diabetes 67: 1892-1902 (2018).
添付資料
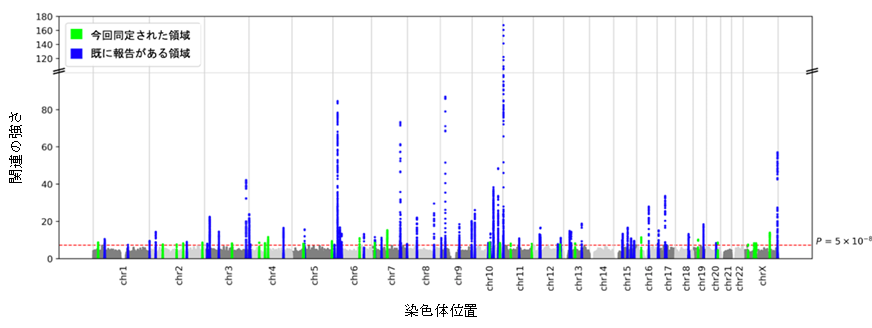
図1 本研究で実施した日本人集団の2型糖尿病GWASのマンハッタンプロット
本研究に参加した20万人規模の日本人集団の遺伝情報を用いて実施した2型糖尿病GWASの結果。図では、横軸は染色体上の位置を表し、縦軸は変異の関連の強さを表している。
GWASの有意水準を超えた領域は、青色と緑色で色付けされており、青色は過去の研究で報告された領域、緑色は本研究で初めて有意な関連が観察された領域である。
図2 GLP-1受容体遺伝子周囲の関連解析プロットとGLP-1受容体蛋白の構造
(a)日本人集団および(b)欧米人集団の2型糖尿病GWASにおけるGLP-1受容体遺伝子領域の関連解析プロット。横軸は変異の染色体上の位置を表し、縦軸は各変異と2型糖尿病の関連の強さを表す。(c)GLP-1受容体の三次元モデル。灰色の領域は細胞膜の境界を表す。膜貫通領域は水色、細胞外領域は茶色、残基E127-K130は黄色、R131は赤色、G132-S136は橙色、E207-W214はピンク色で色分けされている。(d)GLP-1受容体のスネークプロット。各アミノ酸は、リボンモデルと同じ方法で色分けされている。
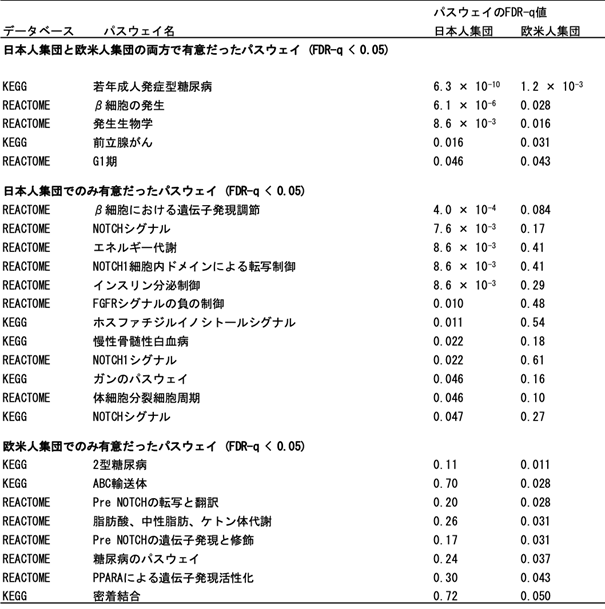
表1 日本人集団と欧米人集団の2型糖尿病GWAS結果の分子生物学的パスウェイ解析
問い合わせ先
研究内容に関するお問い合わせ先
東京大学大学院医学系研究科 糖尿病・生活習慣病予防講座
特任教授 門脇 孝(かどわき たかし)
東京大学医学部附属病院 糖尿病・代謝内科
教授 山内 敏正(やまうち としまさ)
理化学研究所 生命医科学研究センター 腎・代謝・内分泌疾患研究チーム
チームリーダー 堀越 桃子(ほりこし ももこ)
京都大学大学院医学研究科 京都大学・マギル大学ゲノム医学国際連携専攻 准教授
/理化学研究所 生命医科学研究センター 統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
大阪大学大学院 医学系研究科 遺伝統計学
教授 岡田 随象(おかだ ゆきのり)
大阪大学大学院 医学系研究科 遺伝統計学
助教 鈴木 顕(すずき けん)
広報担当者連絡先
東京大学医学部附属病院
パブリック・リレーションセンター(担当:渡部、小岩井)
理化学研究所 広報室 報道担当
大阪大学大学院医学系研究科 広報室
東北大学
東北メディカル・メガバンク機構
広報戦略室長/総務・企画事業部副部長(広報・倫理法令担当)
特任教授 長神 風二(ながみ ふうじ)
岩手医科大学
いわて東北メディカル・メガバンク機構
広報・企画部門長
教授 遠藤 龍人(えんどう りゅうじん)
事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 バイオバンク課