既存の医薬品がマラリアの予防薬となる可能性を示す結果
2019-06-12 大阪大学,日本医療研究開発機構
研究成果のポイント
- 肝臓細胞では宿主因子であるCXCR4(※1)によってマラリア原虫(※2)の形態変化が起きることを発見
- CXCR4発現増強によって肝臓細胞内のカルシウムイオン濃度が上昇し、原虫が赤血球期(※3)に分化することを発見
- 既に医薬品として用いられているCXCR4阻害剤がマラリアの新しい予防薬となることが期待される
概要
大阪大学微生物病研究所の山本雅裕教授(免疫学フロンティア研究センター兼任)らの研究グループは、肝臓期(※4)のマラリア原虫が赤血球期に分化するためには、宿主因子であるCXCR4が必須であることを明らかにしました。
マラリア原虫は、蚊を媒介してヒトやマウスに感染し、肝臓を経て赤血球に侵入、さらに増殖してマラリアを引き起こします。しかし、肝臓で起きる昆虫期から赤血球期への原虫の分化に関与する宿主因子とそのメカニズムは不明でした。
今回、山本教授らの研究グループは、
①肝臓細胞では、昆虫期のマラリア原虫がCXCR4依存的に赤血球期原虫に分化すること
②CXCR4発現増強により肝臓細胞内でのカルシウムイオン濃度が上昇することが、マラリア原虫の分化を引き起こしていること
③CXCR4阻害剤を予め投与したマウスでは、マラリアの発症が抑えられ、生存率が改善すること
を明らかにしました。
これにより、既存のCXCR4阻害剤が新しいマラリア予防薬となることが大いに期待されます。
本研究成果は、米国科学誌「Journal of Experimental Medicine」に、6月12日(水)午後10時(日本時間)に掲載されます。
研究の背景
マラリアは、結核、エイズとともに三大感染症と呼ばれるヒトの代表的な感染症の一つです。マラリアの原因であるマラリア原虫は蚊に媒介されアフリカや東南アジア、中南米を中心に1年間で2億人が新たに感染し、2017年のWHOの報告では年間40万人以上がマラリアによって死亡しているとされ、現在、世界中の研究機関や製薬会社が抗マラリア薬やワクチンの開発のためにしのぎを削っています。しかし、未だ決定打となる抗マラリア薬やワクチンの開発には至っていません。
マラリアは胞子虫類(※5)に属するマラリア原虫によって引き起こされます。マラリア原虫には、蚊の体内に潜伏する「昆虫期」と、マラリアの症状を引き起こす「赤血球期」の間に、蚊の唾液腺から宿主内に放出された昆虫期原虫(スポロゾイト)がまず宿主の肝臓へと移動して肝臓細胞に侵入した「肝臓期」と呼ばれる3つの異なるステージがあることが知られています。肝臓期では、寄生胞(※6)を形成し、その中でスポロゾイトが赤血球原虫(メロゾイト)に分化します。
この肝臓期のマラリア原虫を詳細に見ていくと、元々、紡錘形(バナナ型)だったスポロゾイトの形態の中央部が円形に膨らみ、完全な球型に形態変化した後、最終的にメロゾイトへと分化することが30年前に報告されていました(図1A)。しかし、このバナナ型から球型への形態変化がいかにしておきるのか、その分子メカニズムについては、これまで全く分かっていませんでした。
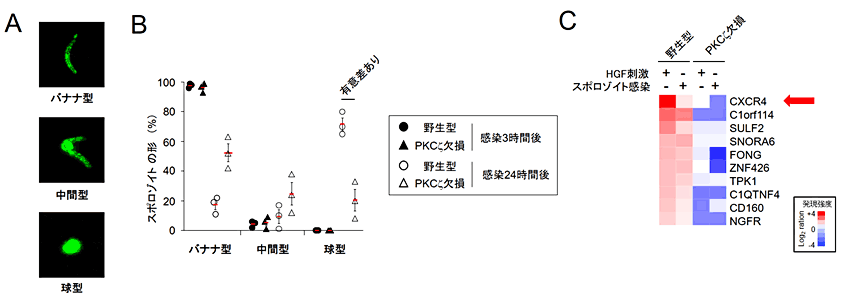
図1 PKCζ欠損肝臓細胞ではスポロゾイトが球型にあまり変化せず、CXCR4も誘導されない
(A)蚊の唾液腺から分離したマウスマラリア原虫(Plasmodium berghei)のスポロゾイトの形状はバナナ型であるが、肝臓細胞に感染後中央部が膨らみ中間型となり、完全に球型となり増殖し、メロゾイトへと分化する。
(B)野生型肝臓細胞ではスポロゾイト感染3時間後で虫体の形状はバナナ型のままであるが、感染24時間後は70%が球型となる。一方、PKCζ欠損肝臓細胞では感染24時間後に球型になっているのは20%に留まっていた。
(C)スポロゾイト感染またはHGF刺激した野生型細胞またはPKCζ欠損肝臓細胞の遺伝子発現を比較した結果、CXCR4が共通してPKCζ欠損細胞で発現上昇がみられなかった。
研究内容の詳細
山本教授らの研究グループでは、バナナ型スポロゾイトの球型メロゾイトへの形態変化がPKCζ(※7)に依存的することに着目し、研究を進めました。その結果、PKCζシグナルの標的分子であるCXCR4が肝臓細胞内のカルシウムイオン濃度の上昇を引き起こし、その結果、球型のメロゾイトへと分化することを発見しました。
肝臓期のマウスマラリア原虫(Plasmodium berghei)の分化には、宿主因子であるHGF(肝臓細胞増殖因子)やその下流のシグナル伝達分子であるPKCζが関与することが報告されています。まず、これらの分子が肝臓期マラリア原虫の分化においてどのステップに関与しているのか詳細に調べました。その結果、PKCζを欠損させた細胞では、スポロゾイトの侵入には影響がありませんでしたが、スポロゾイト侵入後に起こるバナナ型から球型への形態変化が著しく阻害されることを見出しました(図1B)。そこで、これらの増殖因子やシグナル伝達因子により発現誘導される遺伝子群を網羅的に解析した結果、CXCR4の発現が最も顕著に誘導されていることが分かりました(図1C)。
次に、CXCR4のスポロゾイト形態変化における役割を調べました。CXCR4を欠損させた肝臓細胞やCXCR4の阻害剤を用いた結果、スポロゾイトはこれらの細胞に進入できてもバナナ型のまま分化が進まないことが明らかになりました(図2A及び図2B)。また、CXCR4阻害剤を予め投与したマウスではスポロゾイト感染後の生存率が有意に改善しました(図2C)。
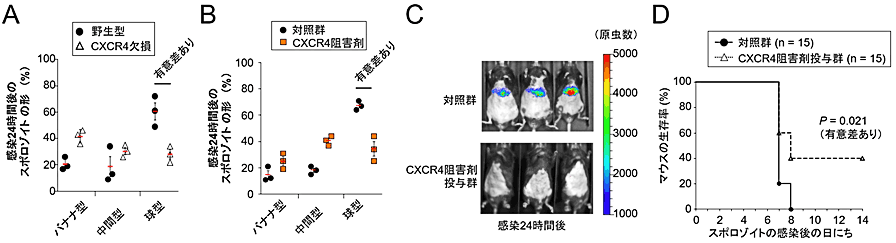
図2 CXCR4の阻害により、スポロゾイトの形状変化と感染マウスでの増殖が抑制される
(A)マウスマラリア原虫のスポロゾイト感染24時間後のCXCR4欠損肝臓細胞では球型になっている虫体の割合が、野生型細胞に比べて大幅に低下していた。
(B)スポロゾイト感染24時間後のCXCR4阻害剤(既に医薬品として広く使われている化合物、AMD3100)を処理した肝臓細胞では球型になっている虫体の割合が、対照群に比べて有意に低下していた。
(C)CXCR4阻害剤を予め投与したマウスではスポロゾイト感染24時間後の肝臓での原虫の増殖が抑制されていた。なお、使用したマラリア原虫はホタルルシフェラーゼを発現しており、ルシフェラーゼシグナルを検出することで原虫の存在をモニター可能である。
(D)CXCR4阻害剤を投与したマウス(15匹)と対照薬投与群(15匹)のスポロゾイト感染後の生存率を測定したところ、対照群では全数死亡したが、CXCR4阻害剤投与マウスでは40%(6匹)が生き残った。
ケモカイン受容体(※1参照)であるCXCR4は、活性化すると細胞内カルシウムイオン濃度の上昇が起きることでよく知られています。そこで、スポロゾイト感染により肝臓細胞でCXCR4に依存してカルシウムイオン濃度の上昇が起きるかどうかを検討しました。その結果、野生型細胞ではスポロゾイト感染によりカルシウムイオン濃度の上昇が認められましたが、CXCR4欠損細胞またはCXCR4阻害剤を処理した細胞ではスポロゾイト感染によるカルシウムイオン濃度の上昇は全く認められませんでした(図3A)。また肝臓細胞に感染させていない状態のスポロゾイトを高カルシウムイオン溶液で培養すると、バナナ型から球型への形態変化が起き(図3B)、さらに質的にもメロゾイトへの分化が起きました(図3C)。これらの結果から、カルシウムがスポロゾイトからメロゾイトへの分化を決定することが分かりました。
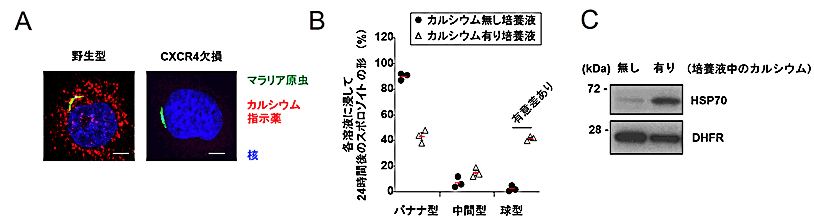
図3 CXCR4依存的な細胞内カルシウムイオン濃度の上昇が、スポロゾイトの形状変化とメロゾイトへの分化に重要である
(A)マウスマラリア原虫のスポロゾイトが感染した野生型肝臓細胞では細胞内カルシウムイオン濃度の上昇が認められたが、CXCR4欠損細胞では認められなかった。
(B)スポロゾイトを蚊の唾液腺から分離して、肝臓細胞には感染させず、カルシウムを含まない培養液とカルシウムを含む培養液のみで24時間培養したところ、カルシウム非存在下ではほとんどのスポロゾイトはバナナ型のままであったが、カルシウム存在下では球型に形状が変化した。
(C)初期メロゾイトのマーカーであるHSP70タンパク質の発現を、肝臓細胞に感染させずカルシウムを含む又は含まない条件で培養した原虫で検討したところ、カルシウム有りの条件でHSP70の発現が大幅に上昇した。
また、ヒトの熱帯熱マラリアを引き起こすマラリア原虫(Plasmodium falciparum)のスポロゾイトの形状も、CXCR4依存的に球型に変化し(図4Aと図4B)、性質的にもメロゾイトへ分化することが分かりました(図4C)。
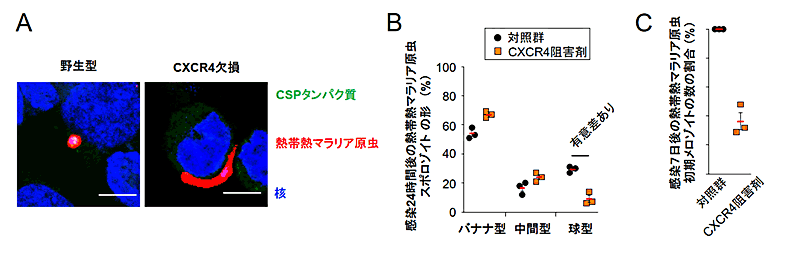
図4 ヒトの熱帯熱マラリア原虫のスポロゾイトも肝臓細胞でCXCR4依存的にメロゾイトに分化する
(A) ヒト熱帯熱マラリア原虫(Plasmodium falciparum)のスポロゾイトが感染した野生型肝臓細胞では感染後24時間では原虫の形状は球型となったが、CXCR4欠損細胞ではバナナ型のままであった。CSPタンパク質は細胞外の原虫が染色されるタンパク質であり、細胞内に存在する(つまり、細胞に感染している)原虫と感染していない原虫を染め分けるために使用している。
(B) ヒト熱帯熱マラリア原虫のスポロゾイト感染24時間後のCXCR4阻害剤(AMD3100)を処理した肝臓細胞では球型になっている虫体の割合が、対照群に比べて有意に低下していた。
(C) ヒト熱帯熱マラリア原虫のスポロゾイト感染7日後に初期メロゾイトのマーカーであるAMA1タンパク質の発現している原虫数をがCXCR4阻害剤存在下では対照群に比べて大幅に低下していたことから、ヒト熱帯熱マラリア原虫のスポロゾイトの肝臓期におけるメロゾイトへの分化も、マウスマラリア原虫と同様にCXCR4によって制御されていることが分かった。
以上の結果から、肝臓細胞に侵入したバナナ型スポロゾイトはCXCR4を誘導し、肝臓細胞でのカルシウムイオン濃度の上昇を引き起こして、球型のメロゾイトへと分化することが示唆されました。CXCR4が肝臓期のマラリア原虫の分化に決定的な役割を果たす宿主因子であることが明らかとなりました(図5)。
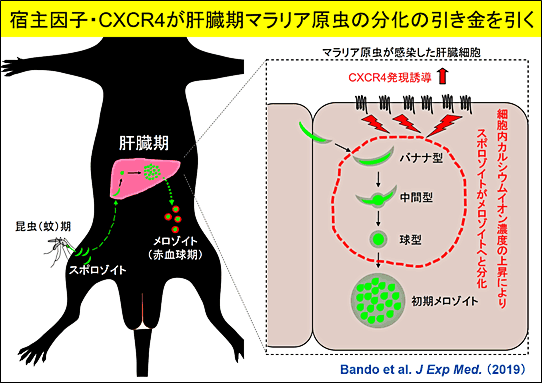
図5 CXCR4はスポロゾイトが肝臓でメロゾイトへと分化するのに関与する宿主因子である図の説明
蚊に由来する昆虫期マラリア原虫(スポロゾイト)は宿主感染後、肝臓期を経て、赤血球期原虫(メロゾイト)となり、宿主においてマラリアを発症させる。肝臓において、スポロゾイトからメロゾイトへの分化が起きるが、その過程でスポロゾイト感染により肝臓細胞のCXCR4の発現が誘導され、さらにCXCR4依存的な細胞内カルシウムイオン濃度の上昇が起き、スポロゾイトがバナナ型から中間型を経て球型と形状の変化を伴うメロゾイトへの分化が起きることを見出した。
本研究成果が社会に与える影響(本研究成果の意義)
既に医薬品として使われているCXCR4阻害剤(※1参照)が、アフリカ・東南アジア・南米の発展途上国を中心に猛威をふるうマラリアの新たな予防薬となることが大いに期待されます。
特記事項
本研究成果は、2019年6月12日(水)午後10時(日本時間)に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されます。
- タイトル:
- “CXCR4 regulates Plasmodium development in mouse and human hepatocytes”
- 著者名:
- Hironori Bando, Ariel Pradipta, Shiroh Iwanaga, Toru Okamoto, Daisuke Okuzaki, Shun Tanaka, Joel Vega-Rodriguez, Youngae Lee, Ji Su Ma, Naoya Sakaguchi, Akira Soga, Shinya Fukumoto, Miwa Sasai, Yoshiharu Matsuura, Masao Yuda, Marcelo Jacobs-Lorena, Masahiro Yamamoto
なお、本研究は、日本医療研究開発機構(AMED) 感染症研究革新イニシアティブ(J-PRIDE)「新規治療戦略基盤創出に資する病原性原虫のPCV破壊・形成・維持に関与する宿主因子群の解明」及びAMED 地球規模保健課題解決推進のための研究事業(日米医学協力計画の若手・女性育成のための日米共同研究公募)「In vitro and in vivo characterization of host factor candidates targeting liver-stage malaria」の研究支援を受け、米国・ジョンスホプキンス大学のMarcelo Jacobs-Lorena教授と三重大学・油田正夫教授の協力を得て実施されました。
用語説明
- ※1 CXCR4(シーエックスシーアールフォー)
- 白血球など特定の細胞に作用し、細胞の遊走を制御する活性(走化性)を持つ分泌性のタンパク質をケモカインという。ケモカイン受容体は細胞膜上に存在し、ケモカインと結合して機能を発現するタンパク質。ケモカインはシステイン残基が形成するモチーフにより、CXC、CC、CX3C、Cの4つのサブファミリーに分類されているが、CXCR4は4つのサブファミリーのうちCXCに対する受容体(‘R’eceptor)で、エイズの原因であるHIVの受容体としてもよく知られている。7回膜貫通型受容体であり、活性化により細胞内のカルシウムイオン濃度の上昇を起こす。本研究で使ったCXCR4阻害剤(AMD3100)はある種の白血病患者への自己造血幹細胞移植の際に使用される医薬品。
- ※2 マラリア原虫
- マラリアを起こす病原体で、胞子虫類(アピコンプレックス門、※4参照)のPlasmodiumに属する原虫。これまでに約200種が知られている。本研究では、その中からマウスのマラリアを起こすPlasmodium bergheiとヒトで熱帯熱マラリアを起こすPlasmodium falciparumを用いている。
- ※3 赤血球期
- マラリア原虫が赤血球に侵入、増殖するステージ。赤血球に侵入したマラリア原虫は8~32個に分裂した段階で赤血球を破壊して放出されて次の赤血球に侵入するというサイクルを繰り返す。マラリアを発症した際の宿主の発熱は、赤血球が破壊した際に起き、ヒトで致死的なマラリア脳症はマラリア原虫に感染した赤血球が脳へと移動した際に起きる。
- ※4 肝臓期
- 媒介昆虫である蚊の唾液腺からヒトやマウスの体内に放出されたマラリア原虫は、血流にのってまず肝臓に到達し、肝臓細胞に侵入する。肝臓細胞内で、昆虫期のマラリア原虫が赤血球期のマラリア原虫へと形態を変えながら分化する。この肝臓細胞中にマラリア原虫がいるステージを特に「肝臓期」と呼ぶ。
- ※5 胞子虫類
- 生活環の中で必ず胞子を作る原生動物の総称。すべてが寄生性であると考えられており、特に宿主の細胞内に寄生するものが多く、マラリア原虫やトキソプラズマ、クリプトスポリジウムなどヒトや動物の病原体も多く含まれている。
- ※6 寄生胞
- 胞子虫類原虫が宿主細胞内に感染した際に形成する膜構造体。スポロゾイト感染と同時に肝臓細胞で形成され、寄生胞内でバナナ型スポロゾイトの球型への形状変化と初期メロゾイトへの分化ならびにメロゾイトの増殖が起きる。
- ※7 PKCζ(ピーケーシーゼータ)
- ヒトやマウスに存在するタンパク質リン酸化酵素の一つ。HGF(ヒト肝臓細胞増殖因子)刺激によって活性化され、CXCR4を含めて様々な遺伝子発現を誘導する細胞内シグナル伝達物質。
お問い合わせ先
本件に関するお問い合わせ先
大阪大学 微生物病研究所
教授 山本 雅裕(やまもと まさひろ)
報道に関するお問い合わせ先
大阪大学 微生物病研究所 企画広報推進室
中込 咲綾(なかごみ さや)
事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 感染症研究課
国際事業部 国際連携研究課
地球規模保健課題解決推進のための研究事業(日米医学協力計画)