2019-09-24 東京大学,日本医療研究開発機構
発表者
篠田 夏樹(東京大学大学院薬学系研究科 薬科学専攻 特任助教)
三浦 正幸(東京大学大学院薬学系研究科 薬科学専攻 教授)
発表のポイント
- 細胞死を実行する因子として知られるカスパーゼが、非細胞死性に器官の成長を促進し、器官サイズの安定性に寄与することを、ショウジョウバエの翅(はね)をモデル器官として用いることにより、明らかにしました。
- 同じアミノ酸配列を特異的に切断するカスパーゼファミリーにおいて、それぞれの蛋白質が特異的な細胞生理機能を担うことを見出すとともに、このファミリー蛋白質それぞれに近接依存性標識手法TurboIDを導入することでその解析基盤を整えました。
- 健常な細胞にも基礎的なカスパーゼの蛋白質分解活性が存在し、カスパーゼの基質の切断による蛋白質の代謝が器官成長に重要であることを明らかにしました。
発表概要
カスパーゼ(注1)は、アポトーシスによる細胞死を実行する蛋白質分解酵素として有名ですが、近年の研究から、細胞死実行とは別の機能(非細胞死性の機能)として多彩な生理現象に関係していることが明らかとなってきています。しかしながら、細胞を殺すことなく生理機能の発揮を可能とする分子基盤は不明な点が多く残されていました。今回、東京大学大学院薬学系研究科の篠田夏樹特任助教、三浦正幸教授らは、ショウジョウバエをモデル生物として用いた遺伝学的解析により、カスパーゼが非細胞死性に器官の成長を促進し、左右相称性によって評価される器官サイズの安定性に寄与することを明らかにしました。その分子基盤として、同じアミノ酸配列を特異的に切断するカスパーゼファミリー蛋白質であるDrice, Dcp-1, Decayのうち、Driceは細胞死の実行に重要であるものの器官成長を促さない一方で、Dcp-1とDecayが非細胞死性に器官成長を促進することを見出しました。この結果は、カスパーゼファミリー蛋白質群の生理機能に応じた使い分け機構の存在を明らかにするものです。さらに、健常な細胞にも基礎的なカスパーゼの蛋白質分解活性が存在し、切断によるAcinus蛋白質の代謝が器官成長を促す一因であることを発見しました。器官サイズの制御は器官再生にも重要であり、また、カスパーゼの非細胞死性の活性化は、細胞浸潤や神経機能とも深く関係していることから、本研究成果はがんや神経変性、再生医学の基礎的な理解にも繋がることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域(※)における研究開発課題「個体における組織細胞定足数制御による恒常性維持機構の解明」(研究開発代表者:三浦正幸)、老化メカニズムの解明・制御プロジェクト、文部科学省科学研究費補助金基盤研究(S)及び挑戦的萌芽研究、の一環で行われました。
(※)当該開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
発表内容
①研究背景
カスパーゼは多細胞生物に広く保存された蛋白質分解酵素であり、蛋白質の切断を介してアポトーシスによる細胞死を実行します。一方で、近年の研究からカスパーゼが非細胞死性に制御する生理機能も明らかとなってきています。その生理機能の例として、細胞移動や細胞の運命決定、精子の成熟や神経軸索の刈り込みなどがあげられます。しかしながら、カスパーゼが非細胞死性に担う生理機能の分子基盤、特に、細胞を殺すことなく生理機能の発揮を可能とする分子基盤は不明な点が多く残されていました。
モデル生物として用いられるショウジョウバエは、遺伝学を用いた解析手法に非常に適しており、カスパーゼの細胞死性および非細胞死性の機能解析にとって優れたモデルです。ショウジョウバエ成虫の翅および胸部の前駆体である翅成虫原基(注2)は、器官成長の研究に適した上皮細胞器官であり、成長の過程においてカスパーゼの活性化が引き起こす細胞死が散発的に生じることが知られています。また、翅成虫原基ではカスパーゼが非細胞死性に細胞の運命決定に関与することも報告されています。すなわち、翅成虫原基はカスパーゼの細胞死性/非細胞死性の両方の機能が発揮される器官です。
本研究グループでは、ショウジョウバエの翅成虫原基をモデル器官として、器官成長に対するカスパーゼの関与を検討しました。その結果、本研究ではカスパーゼが有する新規な非細胞死性の生理機能を見出し、その分子基盤を明らかにしました。
②研究内容
本研究ではまず、翅成虫原基の器官成長に関するカスパーゼの蛋白質分解活性の効果を検討しました。翅成虫原基の成長過程で、遺伝学的操作によってカスパーゼの活性化を阻害すると、成虫の翅サイズが有意に小さくなることが明らかとなりました(図1のB)。反対に、カスパーゼを弱く活性化すると、翅サイズは有意に大きくなることが明らかとなりました。以上の結果から、カスパーゼの蛋白質分解活性は細胞死を誘導して翅の成長を妨げるというよりは、むしろ予想に反して、翅の成長を促進するということがわかりました(図1のC)。また、興味深いことに、カスパーゼの活性化の阻害は翅サイズの左右相称性を乱すことがわかりました(図1のD)。左右相称性の乱れは、発生を通して経験するさまざまな撹乱を緩衝し、頑強な器官サイズを保証する定足数制御機構の乱れを示すことから、カスパーゼは器官サイズの調節も担うことが示唆されました。
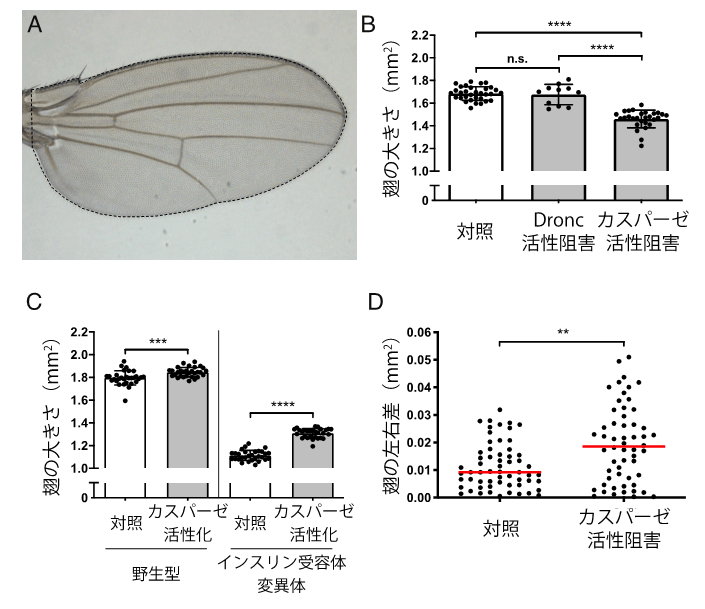
図1. カスパーゼの蛋白質分解活性がショウジョウバエの翅の成長を促進する。
(A)ショウジョウバエの成虫翅の写真。破線で囲まれた領域を翅の大きさとして定量した。
(B)カスパーゼの蛋白質分解活性の阻害により、翅のサイズが減少した。
(C)カスパーゼの蛋白質分解活性の微弱な活性化により、翅のサイズが増大した。観察された効果は、翅が小さい変異体(インスリン受容体の変異体)でより顕著であった。
(D)カスパーゼの蛋白質分解活性の阻害により、本来は左右で同じサイズであるべき翅の左右相称性が乱れた。
研究グループは次に、ショウジョウバエで報告されている7つのカスパーゼファミリー蛋白質の中から、器官成長に必要なカスパーゼを探索しました。その結果、カスパーゼ3のホモログ(注3)であるDcp-1とDecayが翅の成長を担うカスパーゼであることがわかりました(図2のB)。一方で同じカスパーゼ3のホモログで、細胞死の実行に重要であるDriceは翅の成長に関与しないことがわかりました(図2のB)。また、成長過程における細胞死を遺伝学的に抑制しても、抑制の度合いと翅のサイズとは相関しないことから、見出された現象は細胞死と独立した現象であることが明らかとなりました(図2のC-F)。また、カスパーゼ3ファミリー蛋白質の活性化および細胞死の実行には、アポトーシス開始に必要なカスパーゼ9のホモログであるDroncが必要であると考えられていましたが、Dronc非存在下でもカスパーゼ3ファミリー蛋白質群の基礎的な蛋白質分解活性があることを明らかにしました(図2のG-H)。
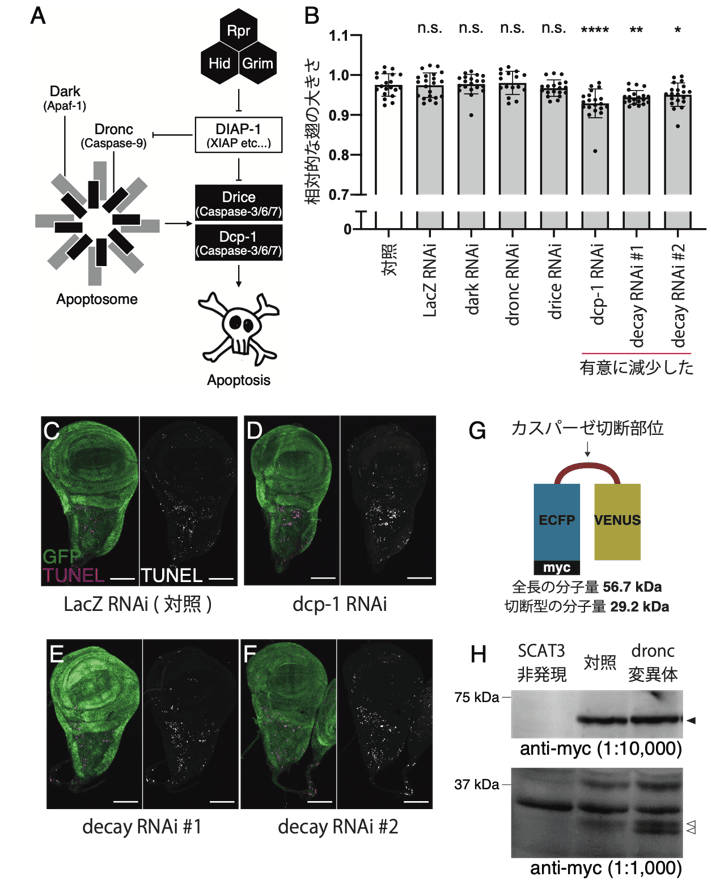
図2. Dcp-1とDecayが非細胞死性に翅の成長を促進する。
(A)ショウジョウバエの細胞死経路の模式図。
(B)Dcp-1とDecayのノックダウンにより、翅のサイズが減少した。
(C-F)ショウジョウバエ翅成虫原基の組織染色写真。GFPで標識される細胞で遺伝子操作を行った。マゼンタはTUNEL法で検出される死細胞を示す。Dcp-1とDecayのノックダウンは、対照群と比較して翅成虫原基の細胞死には影響を及ぼさなかった。
(G)カスパーゼの蛋白質分解活性を検出するプローブ(SCAT3)の模式図。
(H)幼虫の全身に発現したSCAT3に対するウエスタンブロット。Dronc変異体においても、切断型SCAT3が検出された。黒矢頭:全長、白矢頭:切断型。
器官成長を促進するDcp-1と細胞死を実行するDriceは、同じアミノ酸配列を特異的に切断することが知られていました。その両者が、なぜ異なる生理機能を発揮するのかという問いに答えるために、近接依存性標識法TurboID(注4)を導入しました。TurboIDをそれぞれのカスパーゼのC末端にノックインしたショウジョウバエの系統を作出し(図3のB、C)、Dcp-1とDriceが担う生理機能の違いを説明しうる要因を探索しました。翅成虫原基において、それぞれのカスパーゼの発現量とパターンには大きな差が認められませんでした(図3のD-F)。一方で、それぞれのカスパーゼの近傍に存在する蛋白質に差があることが示されました(図3のG)。以上の結果から、カスパーゼを取り巻く細胞内微小環境の違いが生理機能の違いを生み出すことが示唆されました。
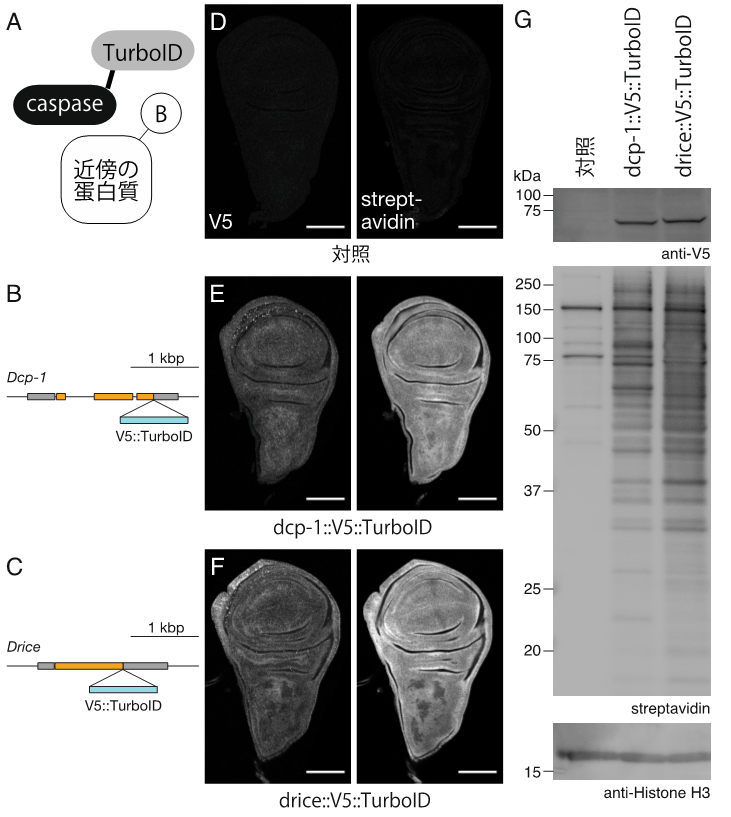
図3.同じアミノ酸配列を特異的に切断するカスパーゼ3ホモログであるDcp-1とDriceは、近傍に存在する蛋白質に差がある。
(A)TurboIDの模式図。カスパーゼ(caspase)にTurboIDを融合することで、カスパーゼの近傍に存在する蛋白質のビオチン化(B:Biotin)が可能になる。
(B, C)Dcp-1とDriceの遺伝子領域の模式図。それぞれの遺伝子のC末端にTurboIDをノックインした。
(D-F)ショウジョウバエ翅成虫原基の組織染色写真。Dcp-1蛋白質とDrice蛋白質は、翅成虫原基に一様に観察された。
(G)翅成虫原基の蛋白質に対するウエスタンブロット。Dcp-1とDriceでは、それぞれの近傍に存在するビオチン化された蛋白質(ストレプトアビジンにより検出された)が異なっていた。
Dcp-1に特異的なカスパーゼの基質としてAcinusが報告されていました。そこで、翅サイズに対するAcinusの寄与を検討したところ、カスパーゼ(Dcp-1)によるAcinusの切断が器官成長に関与することがわかりました(図4のA)。Acinusの機能としてオートファジー(注5)の促進が報告されていることから、カスパーゼはいくつかの基質蛋白質を切断することで、細胞内の蛋白質代謝を制御することが考えられます。以上の結果から、生きている細胞には基礎的なカスパーゼの蛋白質分解活性が存在し、カスパーゼによる蛋白質の切断を介して蛋白質の恒常性を維持することが、器官成長を促す上で重要であることが示唆されました(図4のB)。また、カスパーゼの非細胞死性の生理機能を考えるにあたり、カスパーゼファミリー蛋白質それぞれに特異的な作用分子を明らかにすることが重要であることが示唆されました。
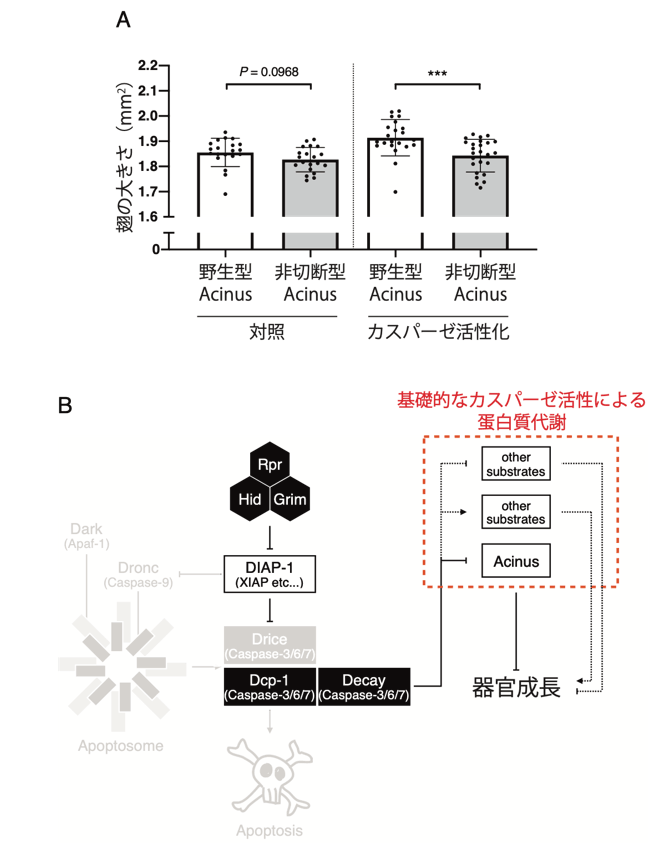
図4. 基礎的なカスパーゼの蛋白質分解活性による蛋白質代謝が、器官成長を促進する。
(A)Acinusの非切断型変異体は、野生型に比較して翅サイズが小さかった。
(B)本研究のまとめの模式図。健常な細胞には細胞死経路とは独立した基礎的なカスパーゼの蛋白質分解活性が存在し、Acinusを含む蛋白質の切断を介して蛋白質代謝を調節することで器官成長を促進する。
③今後の展望
生物のからだが作られる発生過程では、カスパーゼの活性化を経験した後も生存し続ける細胞が生体にかなり多く存在することが、カスパーゼの活性化を経験した細胞の系譜を追跡する研究から明らかとなってきつつあります。すなわち、カスパーゼの非細胞死性の生理機能は想像していたよりもはるかに多岐にわたる可能性があります。今回の研究で明らかとなった、「似た構造を持ち細胞死を実行するカスパーゼは生理機能を使い分ける」という考え方は、今後発見されるカスパーゼ非細胞死性の生理機能の分子基盤を理解する上で重要です。カスパーゼの非細胞死性の活性化は、本研究で明らかになった器官サイズの制御に加え、細胞浸潤や神経機能とも深く関係しています。本研究成果が今後、がんや神経変性、再生医学の基礎的な理解にも繋がることが期待されます。
発表雑誌
- 雑誌名:
- Proceedings of the National Academy of Sciences of the United States of America. (2019) in press
- 論文タイトル:
- Dronc-independent basal executioner caspase activity sustains Drosophila imaginal tissue growth.
- 著者名:
- Natsuki Shinoda, Nozomi Hanawa, Takahiro Chihara, Akiko Koto, and Masayuki Miura.
用語解説
- (注1)カスパーゼ:
- アポトーシスを実行する一群の蛋白質分解酵素(システインプロテアーゼ)。活性中心にシステイン残基をもち、基質となる蛋白質のアスパラギン酸残基のカルボキシ基側のペプチド結合を加水分解する。
- (注2)翅成虫原基:
- 昆虫の幼虫の体内に存在し、変態を経て成虫の胸部および翅を構成する上皮細胞器官。4日間の幼虫期間の間に、その細胞数を50細胞から50,000細胞まで増大させる。
- (注3)ホモログ:
- 類似した機能を持つ蛋白質など、2つ以上の生物種を対象とした時に、共通祖先から派生したと考えられるもの。
- (注4)近接依存性標識法TurboID:
- 目的の蛋白質の近傍に存在する蛋白質を標識する手法。近傍に存在する蛋白質のリシン残基を非特異的にビオチン化する大腸菌由来の酵素BioIDを改良した酵素がTurboIDであり、ショウジョウバエでも適用が可能となった。
- (注5)オートファジー:
- 細胞内の主要な分解機構の1つであり、蛋白質や細胞小器官などさまざまな細胞内容物を分解する。
お問い合わせ先
研究に関すること
東京大学大学院薬学系研究科 薬科学専攻
教授 三浦 正幸(みうら まさゆき)
報道に関すること
東京大学薬学部庶務チーム
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課