2018-02-22 理化学研究所
要旨
理化学研究所(理研)環境資源科学研究センター機能開発研究グループの篠崎一雄グループディレクター、明賀史純研究員らの国際共同研究グループ※は、植物の光合成を担う光化学系Ⅱ複合体(PSII)[1]の分子集合に関与する新しい因子を発見しました。
植物、藻類、光合成細菌は光合成を利用して、太陽エネルギーを化学エネルギーに転換し、有機物を合成します。光合成は非常に複雑な生化学プロセスのため、これまで完全には理解されておらず、特に複雑なPSIIの新しい合成過程や、光エネルギーの過剰吸収による損傷後のPSIIの修復過程については、不明な点が多く残されています。PSIIに含まれる集光性クロロフィルタンパク質複合体(LHC)[2]は、PSIIに結合して光を吸収し、そのエネルギーを光合成へ供給します。一方、LHC 様(Lil)タンパク質は、光合成に必要なタンパク質の仲間であると考えられていますが、機能についてはまだよく分かっていません。
今回、国際共同研究グループは、Lilタンパク質の一つであり、LHCの膜貫通へリックス[3]を一つ持つOHP1とOHP2が欠損した植物体の解析から、これらのタンパク質がPSIIコアタンパク質の分子集合に必須であることを明らかにしました。さらに、OHP1はOHP2、HCF244(シアノバクテリアYcf39の推定相同体)とタンパク質複合体を形成し、この複合体にPSIIコアタンパク質D1/D2、HCF136、HCF173と他のいくつかの植物特異的タンパク質が会合することを見いだしました。これにより、OHP1/OHP2-HCF244複合体がPSIIの分子集合過程において重要な役割を果たしていることが示されました。
本研究は、植物の光合成の初期反応の中心的な役割を担うPSIIの分子集合を助ける補助的なタンパク質の役割を解明し、PSIIを合成するための分子メカニズムの一端を明らかにしました。低温下や乾燥などのストレス環境下では、PSIIが合成できないため光合成活性が低下します。本研究を発展させることにより、ストレス環境下で光合成を維持する作物の作出への利用が期待できます。
本成果は、米国の科学雑誌『Plant Physiology』オンライン版(2月1日付け)に掲載されました。
※国際共同研究グループ
理化学研究所 環境資源科学研究センター
機能開発研究グループ
グループディレクター 篠崎 一雄 (しのざき かずお)
研究員 明賀 史純 (みょうが ふみよし)
植物プロテオミクス研究ユニット(研究当時)
ユニットリーダー 中神 弘史 (なかがみ ひろふみ)(現マックスプランク研究所 グループリーダー)
研究員 野村 有子 (のむら ゆうこ)(現横浜市立大学 木原生物学研究所 特任助手)
北海道大学 低温研究所
准教授 田中 亮一 (たなか りょういち)
大学院生(研究当時) 高橋 香織 (たかはし かおり)
日本女子大学
教授 永田 典子 (ながた のりこ)
スウェーデン ウメオ大学 ウメオ植物科学研究センター
教授 ステファン・ヤンソン(Stefan Jansson)
教授 クリスティーナ・ファンク(Christiane Funk)
研究員 アネット・キス(Anett Z. Kiss)
背景
植物、藻類、光合成細菌は光合成を利用して、太陽エネルギーを化学エネルギーに転換し、有機物を合成します。光合成は非常に複雑な生化学プロセスのため、これまで完全には理解されておらず、特に複雑な光化学系Ⅱ複合体(PSII)の新しい合成過程や、光エネルギーの過剰吸収による損傷後のPSIIの修復過程については、不明な点が多く残されています。PSIIの修復および分子集合の複数の過程を補助する多くのタンパク質は、まだ単離されていない、あるいは完全に特徴づけられていません。
光吸収は光合成プロセスの第一歩です。光化学系Ⅰ複合体(PSI)[1]とPSIIの集光性クロロフィルタンパク質複合体(LHC)の詳しい構造は、植物、藻類およびシアノバクテリアにおいて解明されています。しかし、酸素発生を伴う光合成を行う全ての生物は、光エネルギーを吸収する働きの代わりに光保護(強い光からの損傷を防ぐこと)に関与する可能性があるLHC様(Lil)タンパク質も含んでいます。これらのタンパク質の普遍性と豊富さにもかかわらず、植物における分子レベルでの正確な機能の理解は限られています。
Lilは遺伝子ファミリーを形成し、ほとんどのLil遺伝子は強光下で発現されるのに対し、LHC遺伝子の発現は抑制されているため、強光ストレスに対してLilタンパク質は重要な役割を担っていると考えられます。このグループは、タンパク質の内部に①三つの膜貫通ヘリックスを含むELIP1とELIP2(Lil1)、②二つの膜貫通ヘリックスを含むSEP1とSEP2(Lil4とLil5)、Lil3.1とLil3.2タンパク質、③一つの膜貫通ヘリックスを含むOHP1とOHP2(Lil2とLil6)からなります(図1左)。Lilファミリーの全てのメンバーにおける共通の構造は、LHCの色素結合特性に必要な集光性クロロフィルa/b結合(CAB)ドメインです。
篠崎グループディレクターらは、これまでに葉緑体タンパク質をコードする遺伝子内にトランスポゾン[4]DsまたはT-DNA[4]タグ挿入変異体[4]を収集し、その表現型を網羅的に解析した結果を「Chloroplast Function Database」として一般公開しました注1,2)。 今回、国際共同研究グループは、これらのタグ挿入変異体コレクションの中から緑色の野生型の植物体と比べて、明らかな異常を示す薄緑色のapg変異体(apg16)を見いだしました。そこで、この変異体の原因遺伝子であるOHP1と相同なOHP2とがPSIIの生合成および修復においてどのように機能するのか解析を試みました。
注1)Myouga F, Akiyama K, Motohashi R, Kuromori T, Ito T, Iizumi H, Ryusui R, Sakurai T, Shinozaki K (2010) The Chloroplast Function Database: a large-scale collection of Arabidopsis Ds/Spm- or T-DNA-tagged homozygous lines for nuclear-encoded chloroplast proteins, and their systematic phenotype analysis. Plant J 61: 529-542
注2)Myouga F, Akiyama K, Tomonaga Y, Kato A, Sato Y, Kobayashi M, Nagata N, Sakurai T, Shinozaki K (2013) The Chloroplast Function Database II: a comprehensive collection of homozygous mutants and their phenotypic/genotypic traits for nuclear-encoded chloroplast proteins. Plant Cell Physiol 54: e2
研究手法と成果
国際共同研究グループはまず、シロイヌナズナの核コードの葉緑体タンパク質の変異体コレクションから、OHP1(Lil2)遺伝子にT-DNAを挿入したapg16変異体を単離しました。さらに、シロイヌナズナT-DNA挿入変異体を単離し、これら二つの変異体アレル[5](ohp-1-1変異体とohp-1-2変異体)を得ました。それらは、寒天培地プレート上で生育した場合、野生型(WT)と比較して、成長遅延および淡緑色の表現型、細胞内の葉緑体の発達・分化が影響を受けていることが分かりました(図2)。
また、OHP1と同じ一つの膜貫通ドメインを持つLHC様タンパク質のOHP2(Lil6)のT-DNA挿入突然変異体も、OHP1と同様に寒天培地プレート上で淡緑色の表現型を示し成長遅延がみられました(図2)。一方、ohp1およびohp2変異体を土壌に移した場合には、全ての植物が枯死しました。これはOHP1およびOHP2が、葉緑体の発達と栄養生長において必須の役割を果たすことを示しています。
さらに、転写産物蓄積量の解析などから、OHP1は通常の生育条件下での葉緑体発達の初期段階で主に機能し、強光ストレスにさらされた場合にはOHP1産生が全ての栄養組織において強く誘導されることが示されました。また、さまざまな光強度下でのクロロフィル蛍光測定により、これらの突然変異がPSII機能に影響を及ぼすことが分かりました。
次に、BN-ポリアクリルアミドゲル電気泳動(BN-PAGE) [6]を用いて光合成タンパク質複合体を解析したところ、ohp1変異体では、LHCII三量体以外の他の色素-タンパク質複合体はほとんどまたは全く検出されませんでした(図3左)。またohp1変異体には、PSIIスーパーコンプレックス、PSII二量体、PSII単量体は存在せず、PSI単量体のみが存在していました。これらの結果は、OHP1がPSII複合体の蓄積に必要であることを示しています。
さらに、免疫ブロット法[7]により光合成タンパク質の蓄積を調べると、ohp1変異体ではPSIIコアタンパク質(PsbA、PsbB、PsbC、PsbD)のレベルは検出限界以下であり、PSIコアタンパク質(PsaA、PsaF)はやや減少していましたが、大部分のLHCIIタンパク質は正常に蓄積しており、OHP1の欠損はPSIIコアサブユニットの蓄積に強く影響を与えていました(図3右)。また、高速液体クロマトグラフィー(HPLC)[8]による色素の代謝プロファイリングにおいても、ohp1変異体ではクロロフィルa[9]の含量が減少していました。これは、ohp1変異体ではクロロフィルaが結合するPSIIコアタンパク質が欠如するという結果と一致するものです。
また、OHP1-Myc[10]融合タンパク質を産生するohp1植物から、チラコイド膜タンパク質[11]を調製し、二次元電気泳動実験[12]を行ったところ、OHP1を含む複合体の形成が示されました。そこで、PSII中のOHP1と相互作用するタンパク質を同定するために、CaMV 35Sプロモーター[13]の制御下でOHP1-FLAG[10]融合タンパク質を産生する形質転換体を作出し、この形質転換体のチラコイド膜タンパク質を可溶化し、得られた抽出物を抗FLAGアフィニティーカラム[14]に通しました。得られた抽出物を十分に洗浄した後、溶出した物質をSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)[6]とBN-PAGEによって分離し、質量分析(MS)[15]によりOHP1-FLAGと結合するタンパク質を同定しました(図4左)。
OHP1の複合体を示す大小の二つの主要タンパク質バンドから、HCF244(シアノバクテリアYcf39の推定相同体)、OHP1、OHP2、HCF173(HCF244のパラログ)、HCF136(シアノバクテリアYcf48の推定相同体)、PSIIのD1 / D2コアタンパク質(PsbA、PsbD)が得られました。一方、大きなOHP1複合体には、これらに加えてD1/D2に強く結合するPsbE、PSII複合体の組み立てまたは修復に関与するAPE1および LQY1が含まれていることが分かりました(図4右)。
さらに、OHP1とHCF244との相互作用をin vitro(試験管内)タンパク質間相互作用アッセイで確認しました。これらの結果は、OHP1-OHP2-HCF244-HCF136-HCF173およびPSIIのコア成分の複合体形成が、PSIIの最小の光合成反応中心複合体[16]の集合を形成していることを示しています(図5)。
今後の期待
本研究から、これまで藻類で知られていたPSIIコアタンパク質の新しい合成過程に関与する因子が、高等植物のシロイヌナズナにおいても相同タンパク質が存在し機能していることが明らかになりました。一方、シロイヌナズナでは藻類では見つかっていない植物特異的な新奇な構成因子が存在していたことから、植物のPSII合成には藻類とは別の因子が関わる可能性が示されました。シアノバクテリアでは、OHP1複合体に依存せず、他の因子に依存し得る代替のPSII集合経路を持つことが知られていますが、それとは対照的に植物では、OHP1複合体がPSIIの新しい合成過程でタンパク質蓄積の安定化に不可欠であり、PSII機構の合成および分子集合に関与している可能性が高いと考えられます。本研究は、植物でOHP1を含むPSII反応中心複合体が精製された最初の報告であり、植物におけるPSII分子集合の機構解明に貢献するものです。
本成果によって、植物の光合成のPSII複合体の分子集合過程の新たな補助的タンパク質の解明が進み、低温下や乾燥などのストレス環境下で光合成を維持する作物の作出への利用が期待できます。
原論文情報
- Fumiyoshi Myouga, Kaori Takahashi, Ryoichi Tanaka, Noriko Nagata, Anett Z. Kiss, Christiane Funk, Yuko Nomura, Hirofumi Nakagami, Stefan Jansson and Kazuo Shinozaki, “Stable accumulation of photosystem II requires ONE-HELIX PROTEIN1 (OHP1) of the light harvesting-like family”, Plant Physiology, doi: 10.1104/pp.17.01782
発表者
理化学研究所
環境資源科学研究センター 機能開発研究グループ
グループディレクター 篠崎 一雄 (しのざき かずお)
研究員 明賀 史純 (みょうが ふみよし)
お問い合わせ先
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 光化学系Ⅱ複合体(PSII)、光化学系Ⅰ複合体(PSI)
- 光合成の明反応は、光化学系と呼ばれるタンパク質とクロロフィルなどの色素分子の複合体によって触媒されている。光化学系は2つあり、それぞれ光化学系Ⅰ、光化学系Ⅱと呼ばれる。これらは、シアノバクテリアから緑色植物までの酸素発生型光合成生物のチラコイド膜上に存在する膜タンパク質の超分子複合体である。それぞれの光化学系では、光エネルギーを利用して、二酸化炭素を固定するために必要な還元力を作っている。PSはPhotosystemの略。
-
- 集光性クロロフィルタンパク質複合体(LHC)
- 光化学系I・Ⅱの周辺集光装置を構成する主要な色素タンパク質複合体で、クロロフィルaとクロロフィルbを含んでおり、単量体・二量体・三量体で存在している。LHCタンパク質は3回膜貫通αヘリックスを持っている。光化学系Ⅰの集光性クロロフィルタンパク質複合体(LHCI)は4種のタンパク質(20~24 kDa)からなり、Lhca1~Lhca4の4遺伝子にコードされている。一方、光化学系Ⅱの集光性クロロフィルタンパク質複合体(LHCII)は6種のタンパク質(24~28 kDa)からなり、Lhcb1~Lhcb6の遺伝子にコードされている。LHCはlight harvesting complexの略。
-
- 膜貫通ヘリックス
- 生体膜には、多数のタンパク質が表在または内在している。生体膜は脂質二重層であり、頭部が外側に出て水分子と接しており(親水性)、尾部が内側(疎水性)に入っている。このため、これらの膜タンパク質には膜を通過するための疎水性のへリックスと呼ばれるフォールディング構造をとる特別なアミノ酸配列(膜貫通ドメイン)を持っている。
-
- トランスポゾン、T-DNA、タグ挿入変異体
- トランスポゾンは、転移などによりゲノム上を移動することができる特定の塩基配列のこと。T-DNAは、土壌細菌アグロバクテリウムが持つプラスミドDNAの一部である。細菌が植物に感染するとT-DNA 領域が植物ゲノムの中に組み込まれる。タグ挿入変異体は、トランスポゾンやT-DNAの約10kbのDNA断片がゲノム上の特定の位置に挿入した植物体。DNA断片が遺伝子内に挿入した場合には、その遺伝子の機能を欠損させた変異体となる。シロイヌナズナでは、約24,000の全遺伝子のほとんどにタグ挿入変異体が作出され整備されている。
-
- アレル
- 対立遺伝子のこと。通常は1つの遺伝子座を構成するDNA全領域を複数個体で比較したときに、異なっているものが存在した場合にそれぞれを指す。アレルには「異なった」という意味がある。
-
- BN-ポリアクリルアミドゲル電気泳動(BN-PAGE)、SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)
- どちらも、複合体構造をとるタンパク質および膜タンパク質複合体の大きさや分子種を調べる際に有用な手法。SDS-PAGEは変性状態のタンパク質を分離するに対し(タンパク質の分子量が分かる)、BN-PAGEは、未変性状態のタンパク質を高次構造や複合体構造を保持したまま分子の大きさに従って分離することができる。BN-PAGEは、Blue Native Polyacrylamide Gel Electrophoresisの略。SDS-PAGEは、Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresisの略。
-
- 免疫ブロット法
- タンパク質をSDS-PAGEで分離した後に、PVDF膜に転写し、任意のタンパク質に対する抗体で膜上のタンパク質の存在を検出する手法。
-
- 高速液体クロマトグラフィー(HPLC)
- 液体の移動相をポンプなどによって加圧してカラムを通過させ、物質が固定相とこれに接して流れる移動相との相互作用(吸着、分配、イオン交換、サイズ排除など)の差を利用して、各物質を高性能に分離して検出する分析方法。本研究では光合成色素の分離に利用した。HPLCは、High Performance Liquid Chromatographyの略。
-
- クロロフィルa
- 光合成色素はタンパク質と複合体を形成している。クロロフィルは葉緑体のチラコイドに多く存在する色素であり、光合成の明反応で光エネルギーを吸収する役割を持つ。クロロフィルのうち、陸上植物はクロロフィルaとクロロフィルbを持つ。クロロフィルaは、光合成反応中心での電荷分離、電子移動に関与している。
-
- Myc、FLAG
- タンパク質に付ける短いポリペプチドのタグ。目的のタンパク質にこれらの目印(タグ)を付けて植物体内で発現させることで、他の類似のタンパク質と区別することができる。
-
- チラコイド膜タンパク質
- 緑色植物の葉緑体のチラコイドは円盤状の膜であり、積み重なってグラナと呼ばれる構造を作っている。チラコイド膜は、膜内部の内腔タンパク質のほかに、多くの表在性および内在性膜タンパク質を持つ。また、チラコイド膜上には、光合成における光受容や光化学反応において重要な役割を果たすPSIIタンパク質複合体、PSIタンパク質複合体、Cytb6f複合体、ATP合成酵素などが存在する。
-
- 二次元電気泳動実験
- 二段階の電気泳動によりタンパク質を二次元に分離し、高分解能でタンパク質を分離することができる。一次元めは等電点電気泳動によりタンパク質を分離し、二次元めはSDS-PAGEにより分子量で分離する2D IEF/ SDS-PAGEや、一次元めはBN-PAGEにより未変性状態のタンパク質を分離し、二次元めはSDS-PAGEにより変性状態のタンパク質を分離する2D BN/SDS–PAGEなどがある。
-
- CaMV 35Sプロモーター
- カリフラワーモザイクウイルス(Cauliflower mosaic virus:CaMV)由来の35S RNAの転写プロモーター。非常に強力で、植物の遺伝子工学によく用いられている。このプロモーターの下流に遺伝子をつなげたコンストラクトを導入した形質転換体では、植物体内で下流の遺伝子を恒常的に大量に転写することができる。
-
- 抗FLAGアフィニティーカラム
- カラム中にFLAG配列に対する抗体が固定され、そこにタンパク質溶液を添加すると、抗体に結合するタンパク質だけがカラムに保持され、高純度に精製することができる。今回は、OHP1-FLAG融合タンパク質およびこれに結合したタンパク質複合体を精製した。
-
- 質量分析(MS)
- 各種のイオン化法で分子をイオン化し、その質量数と数(質量対電荷比, m/z)を測定することによってイオンや分子の質量を測定する分析法。これにより物質の同定や定量を行うことができる。MSによるタンパク質分析は、タンパク質の構造、機能、修飾などの解析に利用される。MSはMass Spectrometryの略。
-
- 光合成反応中心複合体
- 酸素発生型光合成における最小の光化学系Ⅱ複合体のこと。D1タンパク質(psbA遺伝子産物)およびD2タンパク質(psbD遺伝子産物)を中心に構築されており、cytochrome b559(psbEおよびpsbF遺伝子産物)とpsbI遺伝子産物との低分子量のタンパク質を含んでいる。この複合体は、色素成分として反応中心当たり6分子のクロロフィルa、2分子のフェオフィチンa、2分子のβ-カロテンを含む。
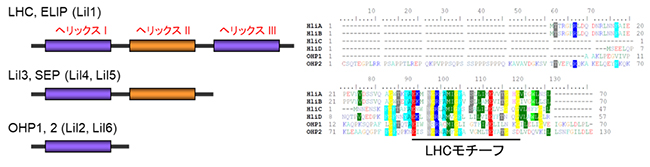
図1 LiI遺伝子ファミリーの膜貫通へリックスの模式図
左)Lil遺伝子ファミリーは、タンパク質の内部に①LHCと同じく三つの膜貫通ヘリックスを含むELIP1とELIP2(Lil1)、②二つの膜貫通ヘリックスを含むSEP1とSEP2(Lil4およびLil5)、Lil3.1とLil3.2タンパク質、③一つの膜貫通ヘリックスを含むOHP1とOHP2(Lil2とLil6)からなる。
右)シロイヌナズナOHP1、OHP2、およびシアノバクテリア HliA~HliDの成熟タンパク質の配列比較を示す。下線部は、膜貫通ドメイン(Lilタンパク質のLHCモチーフ)であり、アミノ酸が一致する配列には同じ色を使っている。LHCモチーフの領域のみが六つのタンパク質において、高い相同性を持つことを示す。
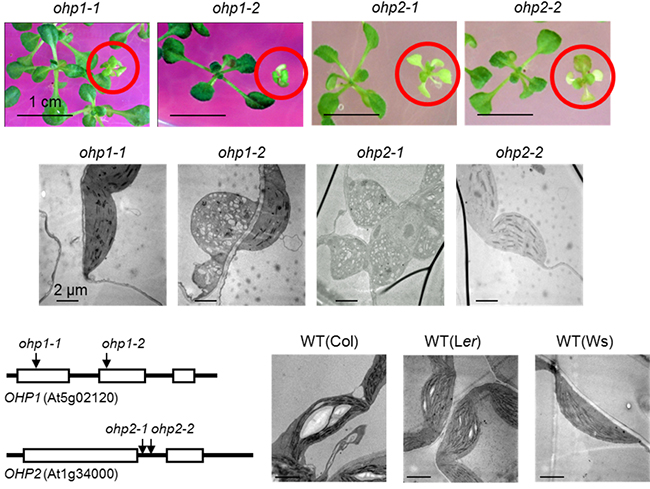
図2 シロイヌナズナohp1およびohp2 変異体の寒天育成培地上の表現型
上段)OHP1(Lil2)とOHP2(Lil6)のT-DNA挿入突然変異体を、1%ショ糖を加えた寒天培地プレートで生育したときの4週齢のシロイヌナズナの写真。赤の丸印内の植物体が変異体(ホモ接合体)であり、淡緑色の表現型を示し成長遅延がみられた。左側の緑色の植物体はヘテロ接合体。ohp1-1変異体はLandsberg erecta (Ler)生態型、ohp1-2変異体とohp2-2変異体とはColumbia(Col)生態型、ohp2-1はWassilewskija(Ws)生態型である。
中段、下段右)変異体(中段)と野生型(下段右、WT)の色素体の透過電子顕微鏡写真。野生型では葉緑体内部のチラコイド膜が多数存在しているのに対して、変異体では葉緑体の発達および分化に悪影響が出ている。
下段左)OHP1遺伝子(上)とOHP2遺伝子(下)構造とT-DNAの挿入位置の模式図。ボックスは遺伝子のエキソン(タンパク質をコードしている部分)、線はイントロン(タンパク質をコードしていない部分)、矢印は四つの変異体におけるT-DNA挿入の位置を示す。
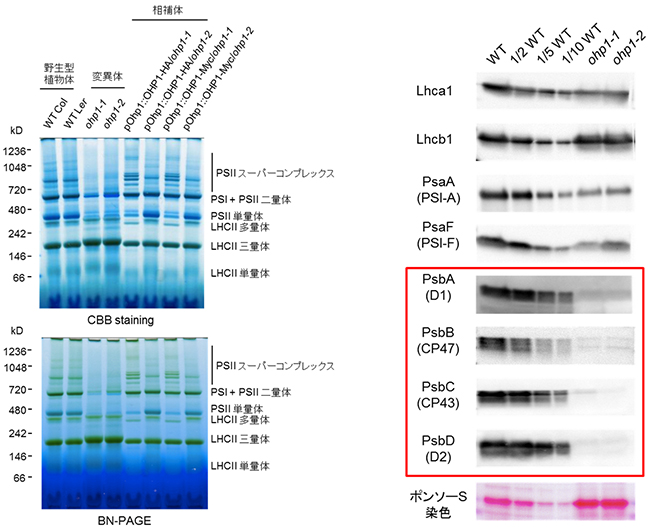
図3 ohp1 変異体における光化学系Ⅱ複合体の消失
左) Blue Native-PAGE(BN-PAGE)およびクマシーブリリアントブルー(CBB)染色によって、チラコイド膜タンパク質の分離を行い、野生型植物(WT、Col; コロンビア生態型、Ler; ランズバーグ生態型)およびohp1変異体における光合成タンパク質複合体を解析した。ohp1変異体では、LHCII三量体以外の他の色素-タンパク質複合体はほとんど、または全く検出されなかった。
右) WTおよびohp1変異体の2つの対立遺伝子(ohp1-1とohp1-2)における光合成タンパク質の蓄積は、膜の左側で記す特異抗体(Lhca1以下PsbD(D2)まで)による免疫ブロット法によって解析した。レーンあたり10μgのクロロフィルを用いた。WTは三種類のクロロフィル含有量1~10倍で三つに希釈した。1/2WT、1/5WT、1/10WT)を調べた。ポンソーS染色は、ニトロセルロース膜上のタンパク質を検出し、各レーンに存在するチラコイドタンパク質の量を示す。変異体ではPSIIコアタンパク質(赤い四角で囲む)のレベルは検出限界以下であり、PSIコアタンパク質(PsaA、PsaF)はやや減少していたが、大部分のLHCIIタンパク質は正常に蓄積していた。
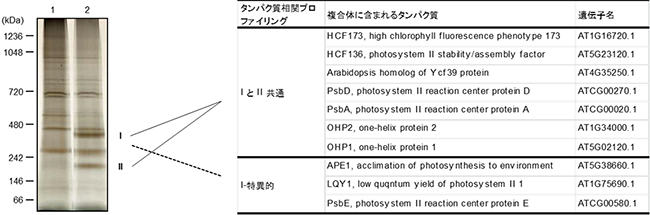
図4 OHP1と相互作用するタンパク質の同定
左) シロイヌナズナ野生型(WT、レーン1)とOHP1-FLAGを強発現させた形質転換体(レーン2)のチラコイド膜を1.0%(w/v)ジギトニン処理による未変性状態で可溶化し、FLAG特異抗体によるプルダウンアッセイで溶出したタンパク質をSDS-PAGE とBN-PAGEにより分離した。
右) WTと異なる二つの大きなタンパク質複合体(IとII)のバンドを質量分析で解析し、複合体に含まれるタンパク質を同定した。「IとII共通」はI・II複合体の両方に含まれるタンパク質を示し、「I-特異的」は大きなI複合体のみに含まれるタンパク質を示す。
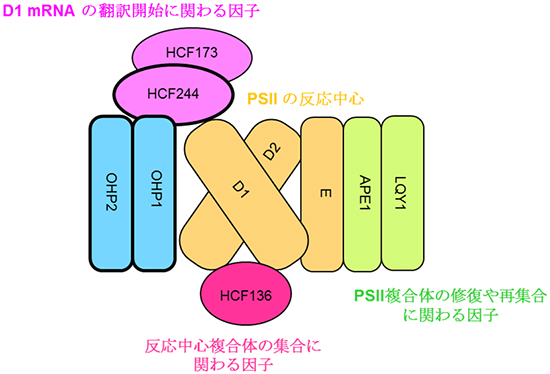
図5 本研究から提案された植物の光化学系Ⅱ(PSII)の分子集合の初期過程のモデル
OHP1/OHP2は、PSIIの反応中心D1/D2(それぞれpsbAとpsbD遺伝子産物)と密接に接触している。OHP1-HCF244/HCF173を介して、PsbE(E)を含むがCP47(psbB遺伝子産物)およびCP43(psbC遺伝子産物)を欠く最小反応中心複合体のD1/D2に取り込まれる。 HCF244およびHCF173は、RNA結合タンパク質として作用し、psbA(D1)mRNAの翻訳開始を促進する。D1前駆体(pD1)は合成され、トランスロコンを伴うリボソームによりチラコイド膜に挿入される。HCF136はpD1と結合してD1モジュールを形成し、D2モジュールに結合し反応中心の集合に関与している。OHP1で単離された他のメンバー(APE1、LQY1)もまた、反応中心の組み立てまたは修復に関与している。 LQY1はPSII修復に関与し、APE1は光環境に対する光合成馴化に関与している。