ヒトiPS細胞においてDMD遺伝子の修復に成功
2019-12-06 京都大学iPS細胞研究所(CiRA),
ポイント
- 真核細胞で利用できる新しいゲノム編集ツールCRISPR-Cas3を開発し、実際にヒトiPS細胞の遺伝子修復に利用できることを確認。
- CRISPR-Cas3は、世界中で利用されているCRISPR-Cas9とは異なり大きくゲノムを削る特徴を持ち、さらに認識標的配列が長いためオフターゲットへの影響も極めて低いことを明らかにした。
- 従来よりも安全性の高い新しい日本発ゲノム編集基盤ツールとして、新たな創薬や遺伝子治療などへの利用、農水産物への利用など、さまざまな分野への応用が期待される。
1. 概要
大阪大学医学部附属動物実験施設/東京大学医科学研究所の真下知士教授、大阪大学微生物病研究所の竹田潤二招へい教授、京都大学iPS細胞研究所(CiRA)の堀田秋津講師らの研究チームは、新たに大腸菌由来Type I-E CRISPRシステム(CRISPR-Cas3)を開発し、ヒト細胞でゲノム編集ツールとして利用できることを見い出しました。
CRISPR-Cas9を代表とするゲノム編集ツールは、さまざまなライフサイエンス分野に応用されています。一方でこれまでのゲノム編集技術は、狙っていない場所に変異が入るオフターゲット変異といった安全性への懸念や、知的財産の問題があり、新しいゲノム編集ツールの開発が求められていました。今回開発したCRISPR-Cas3は、狙ったゲノム配列の上流側を大きく削る性質を持ち、オフターゲットへの影響も極めて低いことを明らかにしました。さらに、CRISPR-Cas3を使ってデュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy: DMD)注1)遺伝子に変異を持つヒトiPS細胞の遺伝子修復にも成功しました。今回開発した日本発の新しいゲノム編集ツールCRISPR-Cas3システムは、従来よりも安全性が高く新たな創薬や遺伝子治療などへの利用、農水産物への利用などさまざまな分野で応用されることが期待されます。
本研究成果は、英国科学誌「Nature Communications」に12月6日(金)19時に公開されました。
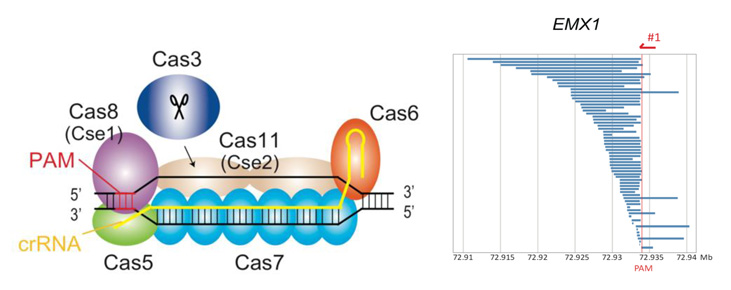
図1:CRISPR-Cas3の模式図(左)とEMX1領域に導入された欠失パターン(右)
2. 研究の背景
ゲノム情報を操作することができるゲノム編集技術は、遺伝子の機能を理解するだけでなく、農水産業における品種改良や、遺伝子治療、再生医療での新規治療法開発など、幅広い分野における活用が期待されています。代表的なゲノム編集ツールであるCRISPR-Cas9は簡単で効率的にゲノムを操作することができるため、世界中でさまざまな生物や細胞に用いられています。ゲノム編集技術はさまざまな分野に応用されている一方で、標的配列以外のゲノム領域を誤って編集してしまうオフターゲット変異のリスクや、狙うことのできる標的配列の制限といった技術的問題があります。加えて、アメリカ主導で開発されたことによる知的財産の課題があり、日本における医療応用や産業用への利用が制限される懸念があります。こうした状況から、従来のゲノム編集技術とは異なる特徴を持った新しいゲノム編集ツール、特に国産の新規ゲノム編集ツールの開発が強く求められていました。
3. 本研究の成果
本来、CRISPR-Casシステムは細菌、古細菌に存在する獲得性免疫システムと考えられており、細菌に感染するウイルス等のゲノムを切断することで、自らを守っています。CRISPR-Casシステムは、複数タンパク質の複合体でDNAを切断するClass 1と、一つのタンパク質で切断するClass 2に分かれていますが、これまで開発されてきたCRISPR-Cas9やCpf1、Cas13などはClass 2に分類されます。一方、Class 1の真核細胞でのゲノム編集技術はこれまで報告されていませんでした。そこで本研究チームは、Class 1に属するType I CRISPRに着目し、ヒト細胞でゲノム編集に利用できないか検討した結果、大腸菌由来のType I-E CRISPR-Cas3がヒト細胞内で変異を導入できることを見出しました。
CRISPR-Cas3によって導入される切断パターンをキャプチャーシーケンスで解析したところ、標的配列の上流側に数百から数万塩基にわたって広範囲に配列が失われる欠失変異が導入されていることがわかりました。この性質はCas9の標的部位に短い変異を導入する性質と大きく異なります。Type I-E CRISPR-Cas3は、27塩基を標的として認識するcrRNAと5つの因子から成るCascade複合体がゲノム上の標的配列を認識して、その後Cas3がDNA切断を誘導します。このCas3はヘリカーゼ注2)ドメインを持つことから、二本鎖DNA構造をほどきながら標的配列の上流側で広範囲にわたってDNA切断を起こしたと考えられます。
CRISPR-Cas3のオフターゲットへの影響について、全ゲノムシーケンス解析、また100カ所以上の類似領域のシーケンスを調べたところ、Cas9ではわずかにオフターゲット変異が確認された一方、Cas3ではオフターゲット変異は確認されませんでした。すなわち、CRISPR-Cas3はオフターゲットへの影響がCas9と比較して少なく正確性が高いことが示唆されました。 さらに、CRISPR-Cas3の遺伝子疾患に対する治療応用として、デュシェンヌ型筋ジストロフィー患者由来iPS細胞に利用した結果、エクソンスキッピング注3)によりDMDタンパク質の発現が改善することを確認できました。
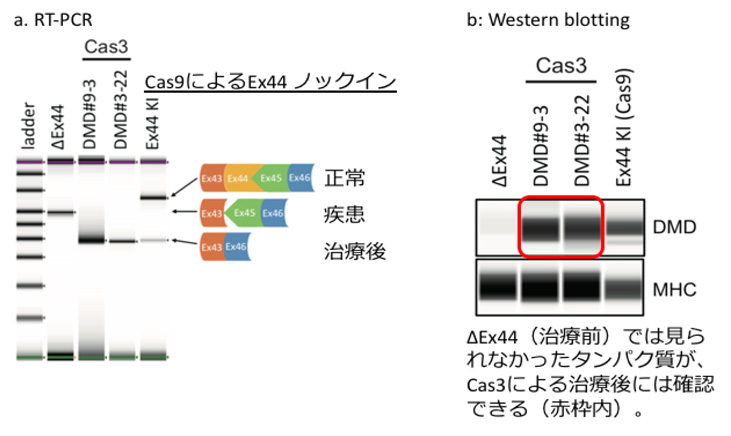
図2:CRISPR-Cas3によるDMD患者由来iPS細胞でのエクソンスキッピング治療
4. 本研究成果が社会に与える影響(本研究成果の意義)
CRISPR-Cas3はゲノムを大きく削ることから遺伝子や外来ウイルスなどを完全に破壊する、もしくは大規模領域をノックイン注4)することに適していると考えられます。また標的を認識する配列が、Cas9が20塩基に対してCas3は27塩基と多く、オフターゲットへの影響の少ない安全なゲノム編集基盤ツールと考えられます。このようにCas9とは全く違った特徴を持つ日本発のゲノム編集ツールを今後さらに改良することで、医療や食品産業など多くの分野で応用できることが期待されます。
5. 論文名と著者
- 論文名
CRISPR-Cas3 induces broad and unidirectional genome editing in human cells - ジャーナル名
Nature Communications - 著者
Hiroyuki Morisaka1,2,#, Kazuto Yoshimi3,4,#, Yuya Okuzaki5,#, Peter Gee5, Yayoi Kunihiro3,
Ekasit Sonpho4, Huaigeng Xu5, Noriko Sasakawa5, Yuki Naito6, Shinichiro Nakada7,
Takashi Yamamoto8, Shigetoshi Sano2, Akitsu Hotta5,*, Junji Takeda1,9,* and Tomoji Mashimo3,4,10,*
# 同等貢献
* 責任著者 - 著者の所属機関
- 大阪大学大学院医学系研究科・医学部 遺伝子治療学分野
- 高知大学医学部附属病院皮膚科
- 大阪大学大学院医学系研究科・医学部 ゲノム編集センター
- 大阪大学医学部附属動物実験施設
- 京都大学iPS細胞研究所(CiRA)
- ライフサイエンス統合データベースセンター(DBCLS)
- 大阪大学高等共創研究院
- 広島大学大学院医学研究科 数理分子生命理学専攻
- 大阪大学微生物病研究所(RIMD)
- 東京大学医科学研究所 先進動物ゲノム研究分野
6. 用語説明
注1)デュシェンヌ型筋ジストロフィー
筋ジストロフィーとは骨格筋の壊死・再生を主病変とする遺伝性筋疾患の総称であり、デュシェンヌ型筋ジストロフィーは、ジストロフィンと呼ばれるタンパク質が全くもしくはほとんどないために起こる。ジストロフィンは筋細胞が壊れにくくする役割を持つタンパク質で、ジストロフィンが少ないと筋細胞が壊れ、炎症、線維化が起こり、筋力の低下による運動障害、呼吸筋障害、心筋障害などが引き起こされる。ほとんどの患者さんは20歳前後で死亡する。
ジストロフィン遺伝子はX染色体に存在し、220万塩基の巨大遺伝子で、79のエクソンを持つ。
注2)ヘリカーゼ
DNAなどの核酸をほどく酵素の総称。DNAに結合して、ATP、GTPなどを加水分解して得られるエネルギーを利用して、決まった方向へ核酸をほどいていく。
注3)エクソンスキッピング
遺伝子の中でタンパク質合成の情報を担う部分をエクソンと呼び、直接タンパク質をコードしていない領域をイントロンと呼ぶ。例えばデュシェンヌ型筋ジストロフィーの患者では、いくつかのエクソンがなくなっていたり、重複していたり、塩基が変異していたりしており、正常なジストロフィンタンパクが作れなくなっている。異常のあるエクソンを読み飛ばしてやる(スキップする)ことで、機能的なジストロフィンタンパクを作らせることで治療する方法。
注4)ノックイン
狙ったDNA配列の場所に、特定の配列を導入したり置き換える技術。外来遺伝子の導入や、標的遺伝子の標識化、病気に関連した配列への変換など、様々な目的に利用されており、新しい疾患モデルの作成や遺伝子治療に向けて必要不可欠な技術である。


