ミトコンドリア異常に伴う疾患や病態の創薬応用に期待
2019-09-06 量子科学技術研究開発機構
概 要
私たちの体(細胞)の中には、ミトコンドリアとよばれるエネルギーを創り出すために重要な働きをしている場所(細胞小器官)が存在しています。ミトコンドリアの機能は、特に私たちの健康と密接に関係しており、その働きが低下することで神経変性疾患、糖尿病、さらにはがんなど様々な疾患や病態と関係することが分かっています。福岡大学理学部化学科(元九州大学理学研究院)の小柴 琢己教授らの研究グループは、ミトコンドリアの機能を司るプロヒビチン複合体の立体構造の一端を世界で初めて解明し、同複合体によるミトコンドリア機能の調節の分子レベルでの仕組みを明らかにしました。プロヒビチン複合体は、ミトコンドリア疾患に関与する複数のタンパク質とも結合することが本研究で確認されており、今回の研究成果は今後の疾患や病態の創薬開発への応用を進めていく上での手助けになることが期待されます。
本研究成果は、九州大学大学院理学研究院、国立研究開発法人 量子科学技術研究開発機構量子生命科学領域、及び徳島大学 先端酵素学研究所との共同研究によるものであり、2019年9月5日(木)に米国・Cell Pressの学術誌『iScience』オンライン版に公開されました。
背 景
私たちの体は多数の細胞の集まりによって構成されており、その細胞内にはミトコンドリアとよばれる細胞小器官が存在します。ミトコンドリアの主な働きは代謝活動に必要なエネルギーを創り出すことです。さらに、ミトコンドリアの機能にはエネルギー産生以外にも重要な役割を兼ね備えており、例えば体内カルシウム濃度の調節や脂肪酸の酸化、また最近の研究では、インフルエンザウイルスをはじめとしたRNAウイルス(※1)に対する免疫応答にも関係していることが知られるようになってきました。
プロヒビチン(PHB)(※2)は、ミトコンドリアに局在する進化的に保存されたタンパク質であり、ヒトをはじめとして多くの動植物において高度に類似した二つのタイプ(PHB1及びPHB2)が存在します。これまでの国内外での研究において、PHBは多面的な機能(細胞増殖、転写活性、細胞死、ウイルス侵入の制御)を持っていることが調べられており、構造面では二つのタイプのPHBが互い違いに環状化結合して巨大な会合体を形成していることが知られていました。しかしながら、PHBの構造実態が細胞内でのミトコンドリアの働きにおいてどのように関わっているのか、その詳しいメカニズムはよく分かっていませんでした。
内 容
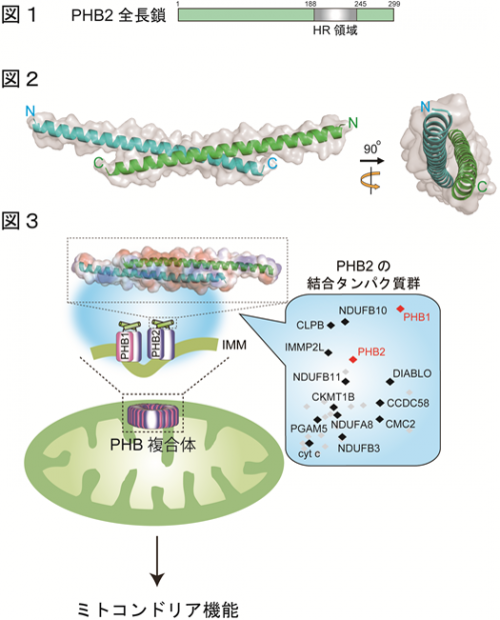
今回、研究グループは、PHB2内に存在するHeptad repeat領域(HR領域)(※3)(解説図;図1)に着目して、この領域を通じてPHB複合体の形成やミトコンドリア機能への関与について以下のような解析を行いました。
1. ヒト由来の培養細胞を用いて、HR領域の欠損したPHB2変異体、及びその野生型を発現させる実験から、HR領域の会合体形成に及ぼす影響について調べました。その結果、PHB2変異体では、野生型で形成される巨大な会合体形成は観察されませんでした。
2. ミトコンドリア内でPHB2のHR領域(PHB2/HR)に特異的に結合する分子種を質量分析法(※4)により網羅的に調べたところ、数十種類のタンパク質が結合していることを発見し、その中にミトコンドリア疾患に関与する複数のタンパク質も含まれていることを確認しました。
3. PHB2/HR領域の組換えタンパク質を調製し、その立体構造を調べたところ、二量体構造を形成していることを見出しました(図2)。さらに、この二量体構造を崩壊させるようなアミノ酸置換をPHB2に導入すると、上記1.で見られたPHB2の会合体形成は行われませんでした。
4. PHB2を人為的に欠損した変異細胞株では、ミトコンドリア形態の異常が観察され、さらにミトコンドリアの機能が著しく損なわれていました。特に、RNAウイルス感染に伴う免疫応答において、変異細胞株では明らかにその反応が低下しており、ウイルスへの抵抗が弱まっていました。
以上の結果より、PHB2はHR領域を介して多数のタンパク質と結合し、巨大な複合体を形成することでミトコンドリアの機能を司っていることが明らかになりました(図3)。
今 後
今回の結果より、PHB複合体はミトコンドリア疾患に関与する複数のタンパク質とも結合することが確認されており、今後のミトコンドリア疾患や病態の創薬開発への応用を進めていく上での手助けになることが期待されます。
発 表 論 文
〇 論文名
Structural basis of mitochondrial scaffolds by prohibitin complexes: Insight into a role of the coiled-coil region.
〇 ジャーナル名
iScience(Cell Pressのオープンアクセス誌)
〇 著者
Takahiro Yoshinaka1, Hidetaka Kosako2, Takuma Yoshizumi1, Ryo Furukawa1, Yu Hirano3, Osamu Kuge1, Taro Tamada3, Takumi Koshiba1,4
〇 著者の所属機関
1.徳島大学 先端酵素学研究所
2.国立研究開発法人 量子科学技術研究開発機構 量子生命科学領域
3.福岡大学理学部化学科
解 説 図
用 語 解 説
(※1) RNAウイルス
遺伝物質としてリボ核酸(RNA)をゲノムに持つウイルスの総称で、一般にRNAウイルスは感染した細胞の細胞質で増幅する。代表的なウイルスとしては、インフルエンザウイルスやC型肝炎ウイルスなどが属する。
(※2) プロヒビチン(PHB)
酵母からヒトに至るまで進化的に広く保存された膜局在性のタンパク質で、高度に類似した二つのタイプ(PHB1及びPHB2)が存在する。主にミトコンドリア内に局在している。
(※3) HR領域
連続した7個のアミノ酸の繰り返し構造により形成される領域。この領域を持つ多くのタンパク質はコイルドコイル構造とよばれる複数の-ヘリックス構造からなる強固な会合体を形成する。
(※4) 質量分析法
化合物の分子量や分子構造情報などを得るための一つの手法であり、同手法をタンパク質などの解析に用する手法の開発で2002年に田中耕一氏らがノーベル化学賞を受賞した。