2019-10-23 理化学研究所,科学技術振興機構(JST)
理化学研究所(理研) 環境資源科学研究センター バイオ高分子研究チームのチョンパラカン・タグン 特別研究員、ジョアン・チュア 研究員(研究当時)、沼田 圭司 チームリーダーらの研究チームは、2種類の機能性ペプチドを組み合わせることで、DNAを植物細胞の多様な色素体注1)に導入できることを明らかにしました。
本研究成果は、色素体を利用した物質生産や、色素体に関連する遺伝子解析などを迅速化する技術として期待できます。
従来、色素体への遺伝子やタンパク質の導入は、金粒子などに目的の分子を付着させ、高い圧力により細胞内部に打ち込むことで偶発的に起こさせるものでした。そのため、色素体へのDNA導入効率に改善の余地がありました。
今回、研究チームは、細胞膜透過性ペプチド注2)に加え、ポリカチオン性ペプチド注3)と葉緑体移行配列注4)を融合した機能性ペプチドを組み合わせたクラスターを用いて、プラスミドDNA注5)を植物細胞内部の色素体に導入することを試みました。その結果、色素体の葉緑体、クロモプラスト、アミロプラストに選択的に導入することに成功しました。また、レポーター遺伝子注6)から目的のタンパク質が生産されていることも確認しました。
本研究成果は、ドイツの科学雑誌「Advanced Science」のオンライン版(10月23日付け:日本時間10月23日)に掲載されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田 圭司)」による支援を受けて行われました。
「色素体」は、植物細胞および真核藻類に見られる細胞小器官であり、光合成やその他の代謝プロセスにおいて極めて重要な役割を果たしています。色素体は、環境や必要な機能に応じて、葉緑体、クロモプラスト、アミロプラストなどいくつかの種類に分化します。葉緑体は、葉や茎などの緑がかった植物組織に見られる最も一般的な色素体であり、光合成および酸素の生成に関与しています。クロモプラストは、色素のカロテノイドを合成・蓄積し、花の果実や花弁が分化した細胞を赤から黄色に変えます。アミロプラストは、根、地下茎、塊茎などの植物の貯蔵部分に見られる無色の色素体であり、デンプンの貯蔵を担当しています。
このように、色素体は、植物細胞に酸素や代謝物を供給する細胞工場として機能するとともに、多様な物質を生産する能力を持っています。色素体を改変すれば、多様な代謝物を効率的に生産することが可能になります。しかし、色素体へDNAを導入し、改変する基盤技術は、非常に限定的であり、作物などの実用植物に利用できる状況ではありませんでした。
これまでに沼田チームリーダーらは、細胞膜透過性ペプチドを用いた遺伝子導入法を開発してきました。この方法は細菌から動植物細胞に至るまで広く適用できることが明らかになっており、ミトコンドリアといった細胞小器官へ選択的に遺伝子を導入できることが報告されてきました。今回、この遺伝子導入法を活用し、色素体へのDNA導入を試みました。
研究チームはまず、葉緑体移行配列とポリカチオン性ペプチドを融合した機能性ペプチドとプラスミドDNAを混合し、イオン性の複合体を調製しました。さらに、細胞膜透過性配列を含むペプチドを添加し、ペプチドとDNAからなるクラスターを調製しました。このクラスターの直径は、200ナノメートル(nm、1nmは10億分の1メートル)ほどでした。このクラスターをまずは、モデル植物のシロイヌナズナの葉へ注入した結果、DNAを葉緑体へ導入することに成功しました(図1)。
次に、葉緑体に加えて、他の色素体へも同様の手法でDNAを導入可能か評価しました。モデル植物で、DNA導入が確認されたため、次は実植物へのDNA導入を試みることにしました。Nicotiana benthamiana(タバコ)の葉に存在する葉緑体、トマトの果実に存在するクロモプラスト、ジャガイモの地下茎に存在するアミロプラストを用いて、ペプチドによるDNA導入効率を解析しました(図2)。その結果、効率や導入時間などに差はあるものの、全ての系において、DNAの導入によるレポーター遺伝子の発現によるタンパク質の合成が確認されました。葉緑体およびクロモプラストにおけるレポーター遺伝子の発現を共焦点レーザー顕微鏡注7)で観察した例を図2に示します。
本研究では、葉緑体移行配列を利用することで、葉緑体だけではなく、他の色素体に対してもDNAを選択的に導入することを可能にしています。これは、色素体の分化にかかわらず、同一の移行配列により、選択的な送達が可能であることを意味しています。さらに、細胞膜透過配列を併用することで、簡便に植物細胞内へクラスターが導入可能となり、色素体の改変がよりいっそう効率化していると考えられます。
従来の葉緑体改変技術は、植物材料の調製に手間がかかり、高価な実験機器を必要とし、目的の生体分子を生産する形質転換植物体を取得するのに時間がかかります。
本研究ではペプチドを、DNAを運搬する遺伝子キャリアとして利用し、新しい色素体への遺伝子導入技術を提案しました。細胞透過性ペプチドと葉緑体標的化ペプチドの両方の機能を組み合わせたペプチドとプラスミドのDNAクラスターを利用することで、DNA分子は植物細胞膜を通過し、小胞形成と細胞内小胞輸送を介して色素体に効率的に導入されていると予想されます。高圧力をかける必要がなく、単純な浸潤法により、植物を傷つけることなく複雑な溶液を導入することができ、多様に分化した色素体における遺伝子発現を迅速に観察もしくは確認することができます。
このように、研究チームが開発している遺伝子導入技術は、植物細胞の色素体を迅速に改変し、効率的な物質生産や、未知の遺伝子機能の基礎研究などに役立つと期待できます。
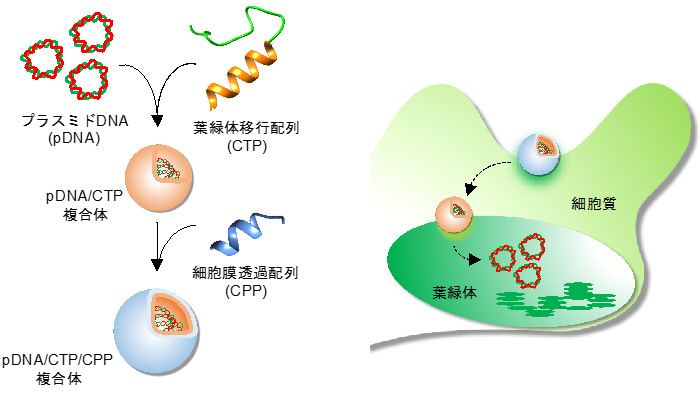
図1 ペプチドによるプラスミドDNAの葉緑体への導入
プラスミドDNAと葉緑体移行配列を含むペプチドを複合化し、さらに細胞膜透過配列を含むペプチドを添加することで、2つの機能性ペプチドを含むクラスターを形成し、それを植物内部の色素体へ導入することに成功した。
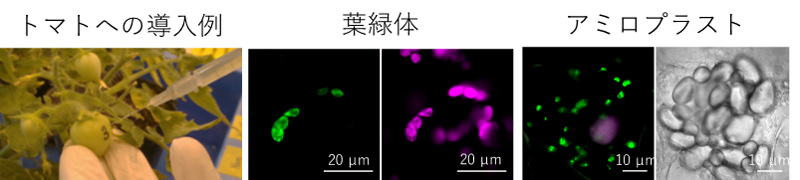
図2 ペプチドとDNAのクラスターをトマト果実とタバコ葉に導入
左画像は、トマト果実にペプチドとDNAのクラスターを導入している様子。中央画像はタバコ葉の葉緑体の共焦点レーザー顕微鏡画像。右側のマゼンタが葉緑体、左側の緑がレポーター遺伝子の発現を示す。右画像はジャガイモの地下茎のアミロプラストの画像。左側の共焦点レーザー顕微鏡画像では、マゼンタがレポーター遺伝子の発現、緑がクロロフィルを示し、右側の明視野像で無色のアミロプラストが集まっている様子を示している。
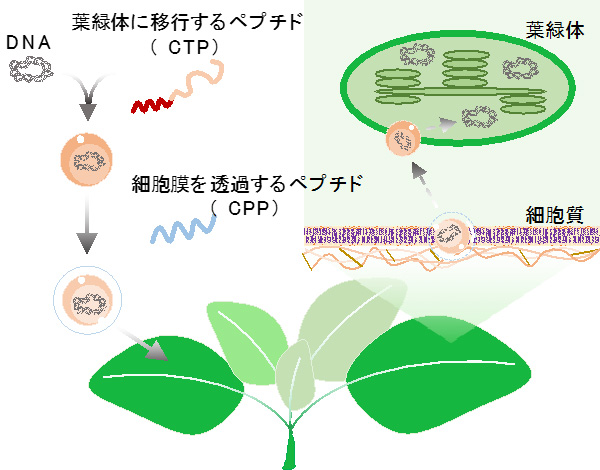
図3 ペプチドを利用した色素体の改変
- 注1)色素体
- 色素体は細胞小器官の1つで、葉緑体、アミロプラスト、クロモプラストなど異なる分化形態の総称。プラスチドとも呼ばれる。色素体は独自のゲノムを保有し、多くの代謝産物の合成の場としても知られている。
- 注2)細胞膜透過性ペプチド
- 細胞膜を透過して細胞内へ移行できるペプチドの総称。10~100個ほどのアミノ酸からなる。
- 注3)ポリカチオン性ペプチド
- 正に帯電したアミノ酸であるリジンなどが10~20残基程度つながったペプチド。
- 注4)葉緑体移行配列
- 細胞質中のタンパク質などの分子を葉緑体へと運ぶために必要なペプチド。ペプチドの長さ(アミノ酸の数)は、配列によって大きく異なる。
- 注5)プラスミドDNA
- 細菌や酵母の細胞質中に存在し、染色体DNAからは独立して自律的に複製されるDNA分子の総称。環状の構造を持ち、単独では細胞内に移行しにくい。
- 注6)レポーター遺伝子
- 解析したい遺伝子の発現を簡便に検出、定量する目的で利用される遺伝子のこと。
- 注7)共焦点レーザー顕微鏡
- 高解像度の蛍光画像を取得できる顕微鏡。光軸方向と二次元走査型の情報を組み合わせることで、立体イメージも構築できる。
- “Targeted gene delivery into various plastids mediated by clustered cell-penetrating and chloroplast-targeting peptides.”
- 著者名:Chonprakun Thagun, Jo-Ann Chuah, Keiji Numata
- DOI:10.1002/advs.201902064
チョンパラカン・タグン(Chonprakun Thagun)
理化学研究所 環境資源科学研究センター バイオ高分子チーム 特別研究員
ジョアン・チュア(Jo-Ann Chuah)
理化学研究所 環境資源科学研究センター バイオ高分子チーム 研究員(研究当時)
沼田 圭司(ヌマタ ケイジ)
理化学研究所 環境資源科学研究センター バイオ高分子チーム チームリーダー
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
理化学研究所 広報室 報道担当
科学技術振興機構 広報課