2020-08-20 国立精神・神経医療研究センター,ハイデルベルク小児がんセンター,日本医療研究開発機構
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所、病態生化学研究部(部長・星野幹雄)の川内大輔室長の研究グループは、「小脳の小児悪性脳腫瘍である『髄芽腫』において、BCOR1)遺伝子で見られる傷(変異)がその悪性化に関わる」ことを発見しました。
がんは遺伝子が何らかの原因で傷つき、機能しなくなったり、正常とは異なる機能を持ったりすることで自分自身の細胞が異常に増殖し始め、時に様々な組織に機能不全をもたらす疾患です。しかしながら、同じ種類のがんと診断された場合でも、それぞれのがんは現在の標準治療である放射線治療や化学療法に対して常に同じ反応を示すわけではありません。個々のがんは見た目が同じでも性質が全く違うことがあるため、それぞれのがんの個性に応じた個別の治療戦略が求められています。
脳腫瘍の場合も例外ではなく、その個性を理解するために、国際的ながんのゲノム解読プロジェクトや遺伝子解析プロジェクトが発足し、同じ脳腫瘍と分類された場合でも異なった多様な遺伝子が傷ついていることが明らかになってきました。これまで異なる遺伝子部位でのダメージが腫瘍の個性を決めているという仮説が提唱されてきましたが、実際に「どの遺伝子の傷(変異)ががん細胞の増殖をコントロールしているのか」については不明な点が多いのが現状です。しかし、この問題を明らかにすることによって、腫瘍の遺伝子変異からどのような抗がん剤を用いて化学療法をすべきかを考える手助けになると思われます。
本研究グループは、ドイツがん研究センター、米国聖ジュード小児研究病院との国際共同研究により、小児の小脳に生じる悪性腫瘍である「髄芽腫」でヒトBCOR遺伝子が高頻度で傷ついていることに着目し、この遺伝子変異が腫瘍形成に与える影響について、がんのモデル動物を作出して解析を行いました。正常な脳ではBCOR遺伝子は髄芽腫の起源細胞である小脳顆粒細胞2)が増殖している時にスイッチがオンになりますが、髄芽腫のモデル動物においてこの遺伝子の機能を阻害すると、細胞増殖を強く刺激することが知られているインシュリン様成長因子2(IGF2)の発現が高まり、がんの進展速度が加速することを明らかにしました。さらに分子レベルでの解析から、BCORタンパク質が通常はがんが生じる初期過程で複合体を形成してIGF2遺伝子を抑えていることがわかり、BCOR遺伝子に傷がつくことでその本来の機能が損なわれ、IGF2を抑えることができなくなることを発見しました。さらに、ハイデルベルグ小児がんセンターとの共同研究により、BCOR遺伝子に変異がある他のヒト脳腫瘍や一部の肉腫においてもIGF2が高いレベルで存在していることを見出し、髄芽腫だけでなく様々な固形がんで同じがん進展機構があることを示唆しました。このことから、BCOR遺伝子に変異を持つ腫瘍ではIGF2によって増殖するがん細胞が多く存在すると考えられるため、IGF2シグナルの阻害剤などの効果を検証するなど、遺伝子の傷の場所に応じた治療法を確立する手助けに繋がると考えられます。
この研究成果は、BCOR遺伝子の変異とIGF2を介したがんシグナルの密接な関係性について、その分子機構を含め、初めて明らかにしたものとなります。将来的には、このBCOR遺伝子の変異は、髄芽腫に限らず様々ながんに対して、その個性に応じた治療のための分子診断マーカーとして役立つことが期待されます。
本研究成果は、科学誌「Genes and Development」オンライン版に米国東部標準時・夏時間2020年8月20日午後3時(日本時間2020年8月21日午前4時)に掲載されます。
研究の背景
髄芽腫は十数年前までは見た目(病理学的な解析)からがんを評価してきましたが、近年は見た目に加えて中身(遺伝子発現パターン、ゲノムの変異やメチル化状態)を詳細に解析することにより、大きく分けて四つのグループに分類できることがわかってきました。そのうちの一つのグループであるソニック・ヘッジホッグ(SHH)3)型と呼ばれる髄芽腫は、細胞増殖を刺激するSHHシグナルが小脳顆粒細胞の前駆体(GNP)で異常に活性化することで生じると考えられてきましたが、近年の研究でSHHシグナルだけでは悪性腫瘍への形質転換は不十分であり、二次的な他の遺伝子のダメージが必要であることが明らかになってきました。言い換えると、どの遺伝子が傷つくかによって、腫瘍が異なった個性(がんシグナル)を持ち始めると考えられます。これまでそういった二次的な遺伝子の変異が何であるかを証明した研究は数えるほどしかなく、SHH型髄芽腫の多様な個性を完全に説明できるには至っていません。そのため、本研究で行われたようなゲノム遺伝学や発生工学を駆使した学際的な研究チームによる更なる解析が必要とされています。
研究の内容
(1)ヒトSHH型髄芽腫でみられるBCORの遺伝子変異ががん進展を促進することを発見
まず本研究グループは以前報告したデータベースからヒトSHH型髄芽腫において高頻度で変異している遺伝子をリストアップし、その中から特に他の腫瘍でも高頻度に変異が報告されているBCOR遺伝子に着目し、その変異箇所を詳細に解析しました。その結果、約69%(13例中9例)の患者で共通して遺伝子の変異がBCORタンパク質のカルボキシル末端(C末端)を欠損させていることがわかりました(図1A)。これを基に、本研究グループはマウス遺伝学の技術を用いて、小脳顆粒細胞でのみC末端を欠損したBCORタンパク質(BCORΔE9-10)を生み出すマウス(Atoh1-Cre/BcorΔE9-10マウス)を作出しました(図1B)。SHH型髄芽腫はPtch1欠損マウス4)の約30%で形成されますが、このPtch1欠損マウスとAtoh1-Cre/BcorΔE9-10マウスを交配(Ptch1欠損BcorΔE9-10マウス)すると、100%のマウスで3ヶ月以内に腫瘍が形成されるという結果を得ました(図1C)。Bcor遺伝子に変異があるPtch1欠損マウスの腫瘍と、Bcor遺伝子が正常なPtch1欠損マウスでの腫瘍では、前者の方が同じ細胞数を免疫不全マウスの脳に移植した場合に、はるかに早くがんを形成する能力があることもわかりました(図1D)。また、Atoh1-Cre/BcorΔE9-10マウス自身は髄芽腫を形成することはないので(図1C)、BCOR遺伝子の変異そのものは小脳顆粒細胞をがん化する能力はなく、むしろSHH型髄芽腫の進展を促し、悪性度に関わることが明らかになりました。
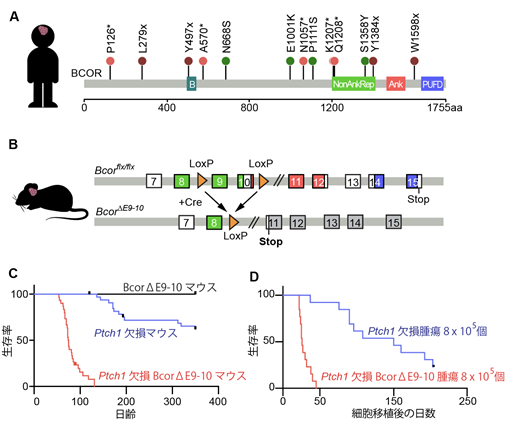
図1:(A)国際がんゲノム解読プロジェクトから得られたヒトSHH型髄芽腫でみられるBCOR遺伝子変異の位置情報。数字の後ろの*(赤色の丸)及びx(茶色の丸)は、それぞれその場所以降の領域でBCORタンパク質が正しく作られないフレームシフトとナンセンス変異を示す。これらの変異では共通してPUFDドメイン(水色)と呼ばれるタンパク質の相互作用に関わる領域が欠けている。緑色の丸は一つのアミノ酸が置き換わる変異を示している。(B)小脳顆粒細胞前駆体でBCORタンパク質のC末端((A)で示されるNonAnkRepの一部、Ank、PUFDドメイン)が欠けたBCORを作るAtoh1-Cre/BcorΔE9-10マウス。(C)遺伝子組換え髄芽腫マウスモデルの生存曲線。(D)8×105個の腫瘍細胞を脳に移植された免疫不全マウスの生存曲線。
(2)BCOR遺伝子変異が細胞増殖因子IGF2を産み出し、SHH型髄芽腫の進展を加速させることを発見
次に本研究グループは、Bcor遺伝子の変異によって腫瘍がなぜ悪性化するのかを調べるため、Bcor遺伝子に変異があるPtch1欠損マウスの腫瘍(Ptch1欠損BcorΔE9-10腫瘍)と、変異が無いPtch1欠損マウスでの腫瘍における遺伝子発現の違いについて調べました。その結果、Bcor遺伝子に変異がある腫瘍では、細胞の増殖を促進することが知られているタンパク質IGF2が高レベルで生み出されていることがわかりました(図2A、B)。次にIgf2遺伝子を強制的に作り出すレトロウイルス(Igf2ウイルス)を腫瘍の起源細胞であるPtch1欠損GNPに感染させ、その感染させた細胞を免疫不全マウスに移植すると、Igf2ウイルスを感染させた細胞はそうでない比較対照の細胞と異なり100%のマウスで腫瘍を形成することを発見しました(図2C)。この腫瘍のIgf2の発現量はPtch1欠損BcorΔE9-10腫瘍よりもはるかに少なかったため(図2D)、Ptch1欠損BcorΔE9-10腫瘍の悪性度が高い理由の一つとして、高レベルのIGF2が原因であることが示唆されました。
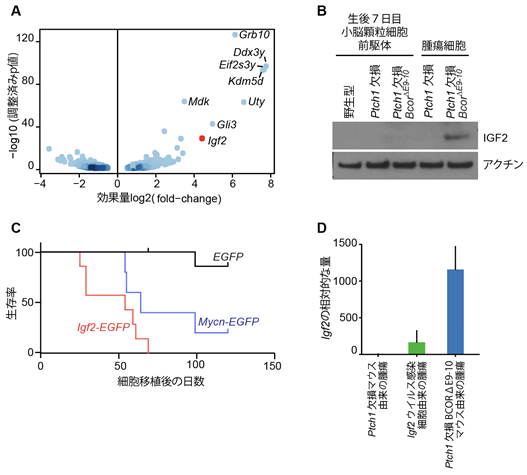
図2:(A)正常なBcor遺伝子を持つPtch1欠損髄芽腫モデルとPtch1欠損BcorΔE9-10腫瘍における遺伝子発現の違い(火山プロットと呼ばれる散布図での表記)。(B)各細胞間でのIGF2タンパクの発現比較。Ptch1欠損BcorΔE9-10腫瘍でのみIGF2が観察される。(C)図に示された遺伝子を作り出すウイルスを感染させた1×106個のPtch1欠損小脳顆粒細胞を脳に移植された免疫不全マウスの生存曲線。(D)図に示された腫瘍におけるIgf2の発現量。
(3)BCOR遺伝子に変異を持つ多くのヒト腫瘍でIGF2が高レベルで発現している
さらに本研究グループは、今回の髄芽腫モデルで得られた「SHHシグナルの活性化」と「BCOR遺伝子の変異」、そして「IGF2発現の異常上昇」の正の関係性が、ヒトの脳腫瘍や他の固形がんで共通して見られるかどうかを調べました。髄芽腫モデルと最も高い相同性を持つヒト髄芽腫(Y497xの変異を持つもの)でIGF2が非常に高いレベルで発現しており(図3A)、BCORタンパク質のC末端に変異を持つ脳腫瘍である原始神経外胚葉腫瘍でも同様の傾向を確認しました(図3B)。またSHHシグナルが顕著かつ、BCOR遺伝子に変異を持つ腎明細胞肉腫においても、IGF2が高レベルで観察されたことから(図3B)、BCORは腫瘍の形成過程の様々な場面でIGF2の発現を抑制している可能性が示唆されました。
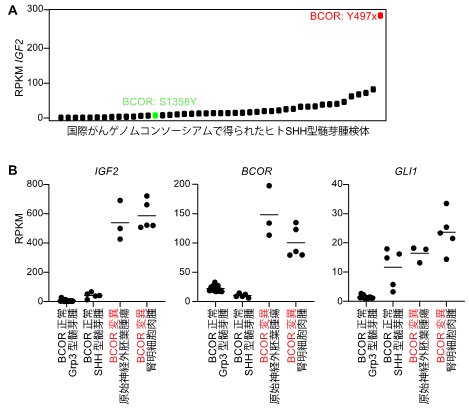
図3:(A)国際がんゲノムコンソーシアムで得られた検体45例に対するRNAシーケンスデータ。縦軸は正規化されたIGF2のリード数。C末端が無傷な変異(S1358Y、緑色)と比較して、欠けているBCOR(Y477x、赤色)が発現している検体でIGF2は高い発現を示す。(B)ハイデルベルク小児がんセンター(KiTZ)における小児再発がんの個別化治療プロジェクト(INFORM)で得られた原始神経外胚葉腫瘍と腎明細胞肉腫の検体を用いたRNAシーケンスデータ。SHHシグナルが活性化した(GLI1高レベル)BCOR変異腫瘍においてIGF2が高レベルで観察される。
(4)BCORはPRC1.1複合体の形成を介してIGF2を抑制する
BCORは、ゲノム上でヒストンのユビキチン化(H2AK119Ub)を介して遺伝子の発現を抑えるPRC1.1複合体5)として機能していることが知られています。また、PRC1.1複合体形成に必須であるPUFDドメインがヒトSHH型髄芽腫において高頻度で欠けていることから(図1A)、今回、本研究グループはPtch1欠損BcorΔE9-10マウスから得られた腫瘍でBCORΔE9-10タンパクはPRC1.1複合体タンパクであるPCGF1と結合できないことを確認した上で、腫瘍モデルにおいてBCOR分子やヒストン修飾H2AK119Ubのゲノム上での存在位置を免疫クロマチン沈降法(ChIP)6)で解析しました。その結果、正常なBCORが存在するPtch1欠損マウス由来の腫瘍ではBCOR及びH2AK119UbはIgf2遺伝子座に観察されましたが、Ptch1欠損BcorΔE9-10マウスで生じる髄芽腫では、これらの局在が著しく減少していました(図4A)。このことから本研究グループは、BCORのC末端に存在するPUFD領域が欠如するとPRC1.1複合体が形成されず、様々な腫瘍でIGF2の発現を抑えることができなくなるモデルを提唱しました(図4B)。
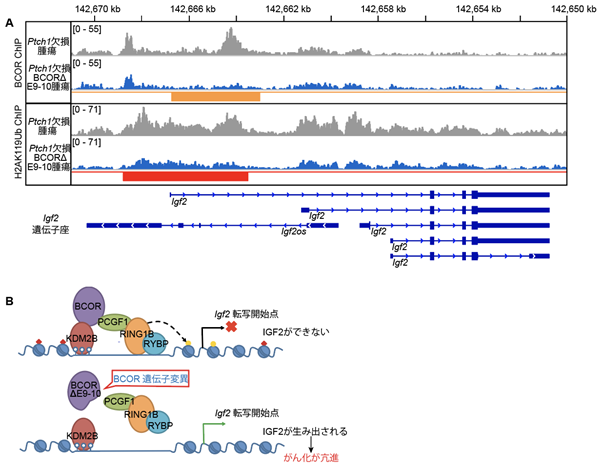
図4:(A)クロマチン免疫沈降法シーケンスによるBCORとユビキチン化ヒストンHeAK119UbのIgf2遺伝子座での局在。Ptch1欠損BcorΔE9-10腫瘍では橙色と赤色で示される領域でこれらのタンパク質の局在が減少している。(B)SHH型髄芽腫におけるBCOR-PRC1.1複合体によるIGF2抑制機構の破綻モデル。
研究の意義と今後の展望
脳腫瘍の化学療法は、腫瘍細胞が増えるメカニズムに応じて治療薬を使い分けていく戦略が効果的であると期待されています。今回の研究成果は、BCORのC末端が機能不全である髄芽腫で誘導されるがんシグナルとしてIGF2を特定した点で、大きな意義があります。一方でIGF2の発現を積極的に亢進させる遺伝子変異や分子メカニズムは未だはっきりしておらず、その分子機構を明らかにすることで、さらに正確にIGF2がんシグナルの診断が可能になるものと思われます。今回の研究成果は、髄芽腫の治療法を検討する際の分子診断マーカーとしてだけでなく、BCOR遺伝子に変異を持つ他のがんの増殖メカニズムをより深く理解するための手助けとなることが期待されます。
用語解説
- 1)BCOR
- 転写因子であるBCL6と共調して、標的遺伝子の転写抑制に働くタンパク質。髄芽腫だけでなく、白血病や肉腫、網膜芽細胞腫や脳腫瘍など様々な腫瘍で変異が観察されるが、個々の腫瘍の発がんに関与する機構についての共通性は未だ不明な点が多い。このタンパク質をコードする遺伝子は、ヒトではBCOR、マウスではBcorと表記される。
- 2)小脳顆粒細胞
- SHH型髄芽腫の起源細胞と考えられている小脳における興奮性介在ニューロンであり、成人の脳細胞で最も数が多い。生後においても発生が継続し、小脳表面で周りの環境からもたらされるSHHにより増殖が刺激される。
- 3)ソニック・ヘッジホッグ(SHH)
- 細胞増殖シグナルを伝達する細胞外タンパク質の一つ。受容体であるPtch1と結合すると、Ptch1のSHHシグナル抑制能を阻害し、細胞内に増殖シグナルが伝わる。神経系の様々な細胞でスイッチがオンになり、増殖シグナルとしてだけでなく神経系細胞の個性決定、軸索誘導など多様な機能があることも知られている。
- 4)Ptch1欠損マウス
- SHHシグナルを負に制御する受容体タンパク質であるPtch1をコードした遺伝子が片側のゲノムで欠損したマウス。細胞増殖を担うSHHシグナルが亢進することで髄芽腫や横紋筋腫を一定の頻度で自然発症するため、これらの疾患の研究のために広く用いられる。
- 5)PRC1.1複合体
- DNAのクロマチン構造を変化させ、遺伝子変異によらない遺伝子の発現制御に関わる重要な機構である。本研究で解析されたユビキチン化ヒストン修飾H2AK119UbはPRC1.1複合体により行われるため、修飾領域の遺伝子の抑制と強い相関があることが知られている。
- 6)クロマチン免疫沈降法(ChIP)
- 目的のタンパク質がゲノムの特定の領域に結合しているかどうかについて抗体を用いて検証する方法。最近では、ゲノムワイドな解析を行うために次世代シーケンスと組み合わせたChIPシーケンスがポピュラーである。
原論文情報
- 論文名:
- Functional loss of a non-canonical BCOR-PRC1.1 complex accelerates SHH-driven medulloblastoma formation
- 著者:
- Lena M. Kutscher, Konstantin Okonechnikov, Nadja V. Batora, Jessica Clark, Patricia B. G. Silva, Mikaella Vouri, Sjoerd van Rijn, Laura Sieber, Britta Statz, Micah D. Gearhart, Ryo Shiraishi, Norman Mack, Brent A. Orr, Andrey Korshunov, Brian L. Gudenas, Kyle S. Smith, Audrey L. Mercier, Olivier Ayrault, Mikio Hoshino, Marcel Kool, Katja von Hoff, Norbert Graf, Gudrun Fleishhack, Vivian J. Bardwell, Stefan M. Pfister, Paul A. Northcott, Daisuke Kawauchi
- 掲載雑誌:
- Genes and Development
- DOI:
- 10.1101/gad.337584.120
- URL:
- http://genesdev.cshlp.org/content/early/recent
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
Deutsche Forschungsgemeinschaft grant (KA4472/1-1)
国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業(JP20ck0106534h0001)
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立精神・神経医療研究センター神経研究所 病態生化学研究部
川内大輔
報道に関するお問い合わせ
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課