2020-11-06 理化学研究所,ロート製薬株式会社
理化学研究所(理研)生命機能科学研究センター器官誘導研究チームの辻孝チームリーダー、ロート製薬株式会社の木村駿研究員らの共同研究チームは、皮膚に存在する細胞同士の「張力均衡」を生体外で再現した人工皮膚モデルを開発し、張力均衡が皮膚組織の構造と機能を制御していることを明らかにしました。
本研究成果は、皮膚の張力均衡の役割など皮膚科学研究に貢献するとともに、今回開発した人工皮膚モデルを利用することで、皮膚の生理機能解析だけでなく、線維症[1]や老化による皮膚のたるみや機能低下など、張力均衡が関与する疾患や老化の治療といった健康長寿に向けたヘルスケア領域の研究開発にも貢献すると期待できます。
皮膚は、生体外から受ける圧迫などの物理的刺激に応答し、生体を保護する役割を持ち、その機能異常と疾患の関連性が一部、明らかになっています。一方、「肌のハリ」として知られているように、皮膚内部では細胞同士が皮膚の面に対して平行な方向に引っ張り合う張力均衡と呼ばれる刺激も存在します。しかし、張力均衡の役割については、生体外で研究モデルを構築する困難さから、これまで十分に解析されていませんでした。
今回、共同研究チームは、生体の張力均衡を再現した人工皮膚モデルを開発し、張力均衡を生体外で人為的に操作することにより、この張力均衡が皮膚の構造や機能に密接に関係していることを明らかにしました。この張力均衡は、メカニカルストレスシグナル分子群を介して、表皮[2]ターンオーバー[3]や細胞外基質[4]合成、機能性薬物への応答性機能に関与することを実証しました。
本研究は、オンライン科学雑誌『Communications Biology』(10月30日付)に掲載されました。

張力均衡を再現した人工皮膚モデル(中央の白い部分)
(表面は角質化した表皮層、内部は線維芽細胞からなる真皮層など6層の構造を持つ)
背景
生体には、外界や生体内におけるさまざまな物理的刺激が存在しています。それらの物理的刺激は、メカニカルストレス(機械的ストレス)として発生や成長、老化、疾患に関与することが報告されており、現在の生物学・医学における重要な研究対象となっています。
皮膚は、外的な環境から体内を保護するバリア機能や物理的なクッションなど重要な役割を担っています。皮膚には、圧迫や引張など外部からの物理的刺激だけでなく、「肌のハリ」として知られているように、内部で細胞同士が皮膚の面に対して平行な方向に引っ張り合う状態が常に存在しています。これは、真皮[2]の線維芽細胞[5]がコラーゲン線維[6]を介して張力のバランスを取るもので、「張力均衡」と呼ばれています。そのため、生体から皮膚を切除すると収縮し(図1)、収縮の方向性はコラーゲン線維やキメ、毛並みなどと一致します。外傷や手術後の縫合など外部からの物理的な刺激による瘢痕(きずあと)形成に関する研究は進められている一方で、生体の張力均衡の分布は極めて複雑なことから研究が難しく、張力均衡の役割についてはよく分かっていません。
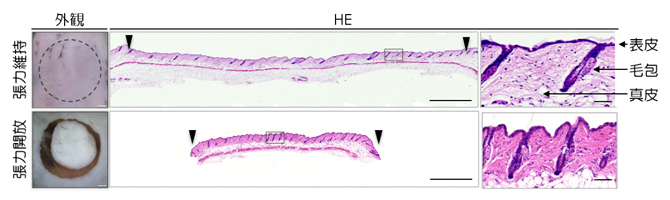
図1 皮膚における張力均衡
上段:切除される前の元の皮膚。中央列は皮膚断面の組織染色像で、右列は四角部分の拡大図。スケールバーは左列から順に1mm、1mm、50μm(μm、1μmは1000分の1mm)。
下段:円形に切り抜かれた皮膚。皮膚片は元の大きさよりも収縮することから、皮膚には常に張力のバランス「張力均衡」が存在していることが分かる(左、中央列)。また、収縮によって天然皮膚の真皮の線維構造や毛包の配向性といった形態特徴が失われている様子が観察できる(右列)。
これまで皮膚の研究モデルとして、コラーゲンゲルと皮膚細胞で皮膚組織を再構築した人工皮膚「Bell型モデル」が開発され、スキンケア製品の安全性評価を中心に利用されています。しかし、疾患・老化研究や創薬研究応用を進める上では、より高度な天然皮膚の組織構造と機能性の再現が課題でした。さらに近年、動物愛護の観点から、EU圏では香粧品の研究開発を対象にした動物実験が禁止され、一部の日本企業も自主的な動物実験廃止に向けた取り組みを進めています。そのため、安全かつ機能的なスキンケア製品の開発に向けて、動物実験代替法としてさまざまな生体外培養した人工皮膚が開発されていますが、さらに天然皮膚の構造と機能を高度に再現した人工皮膚モデルの開発への期待が社会的に高まっています。
そこで共同研究チームは、天然皮膚の張力均衡を生体外で再現した人工皮膚を開発し、皮膚の組織構造と機能性制御に対する張力均衡の役割について検証しました。
研究手法と成果
1)張力均衡を再現した人工皮膚モデルの構築方法の開発
まず共同研究チームは、張力均衡の機能性を解析するために、張力均衡を再現した人工皮膚モデルの構築方法について検討しました。天然皮膚を切除すると収縮することから、張力均衡は皮膚の形態に大きな影響を与えます(図1)。一方、従来の人工皮膚Bell型モデルでは、その構築過程で皮膚を収縮させることで張力が無くなるため、真皮のコラーゲン線維と細胞には配向性が認められません(図2a上段)。そこで、人工皮膚を培養容器で挟んで収縮を固定することで、張力均衡を再現した人工皮膚モデル「Tensional Homeostasis Skin model (THSモデル)」を開発しました。さらに、作製したTHSモデルを培養容器から切り離すことで張力を無くした人工皮膚モデル「Tension Release Skin model(TRSモデル)」を作製しました。THSモデルは培養中収縮することがなく、組織構造は天然皮膚同様に張力と同じ水平方向にコラーゲン線維や細胞が整列しています。一方、この構造はTRSモデルでは失われ、Bell型モデルと同様の張力の無い構造に戻りました(図2a中下段)。
また、THSモデルとTRSモデルの真皮線維芽細胞の立体形状を観察した結果、THSモデルの細胞は水平方向に一様に引き伸ばされている様子が観察されました(図2b)。以上の結果から、張力均衡の再現が皮膚組織の配向性の維持に重要であることが示されました。
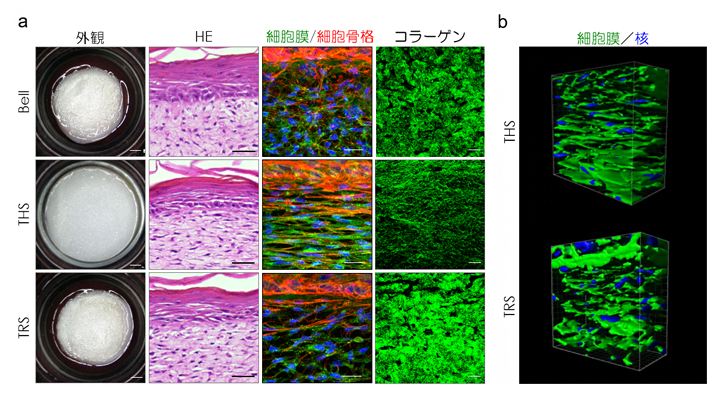
図2 張力均衡による人工皮膚の組織配向性の制御
a)Bell型モデル(上段)、THSモデル(中央)、TRSモデル(下段)の外観と組織構造を示す。THSモデルの外観は、人工皮膚を培養容器で挟んで固定した結果、細胞のけん引による収縮が起きておらず、張力均衡が再現されている(左列)。HE染色像は、全てのモデルにおいて正常な皮膚組織が形成されていることを示している(左から2列目)。一方、THSモデルの細胞膜、細胞骨格、コラーゲン線維は、張力均衡のないBell型、TRSモデルと比較して水平方向に引き伸ばされ、整列した構造となっていることが分かる(右側2列)。スケールバーは左列から順に、1mm、50μm、50μm、20μm。
b)THSモデルとTRSモデルの真皮線維芽細胞の3D構造。THSモデルの細胞は、水平方向に引き伸ばされ整列していることが分かる。
2)張力均衡による皮膚機能と薬剤応答性の向上
張力均衡の皮膚機能への作用を解析するために、人工皮膚を免疫組織学的解析で評価した結果、真皮の1型コラーゲン線維[6]量と表皮角化細胞[7]の増殖細胞比率の増加を確認しました(図3a)。さらに、抗光老化治療薬として知られるall-trans retinoic acid (ATRA)を投与したところ、THSモデルでは、Bell型モデルおよびTRSモデルと比較して、ATRAによる1型コラーゲンおよびヒアルロン酸合成酵素の遺伝子発現が有意に増加していることが確認されました(図3b)。この結果から、張力均衡は人工皮膚の真皮形成と表皮ターンオーバーを促進し、皮膚の薬物応答性を活性化することが明らかとなりました。
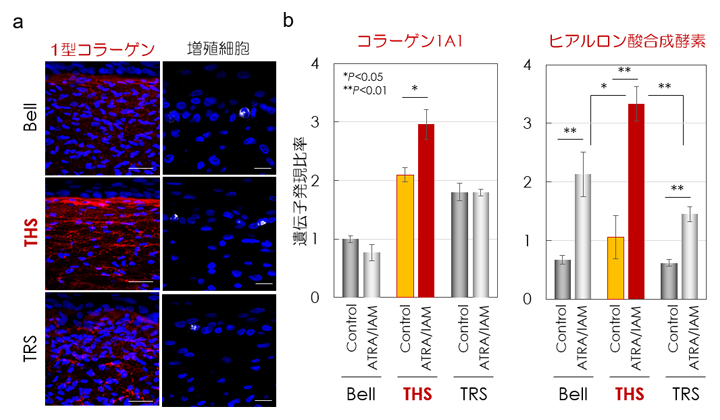
図3 張力均衡による皮膚機能と薬剤応答性制御の解析
a)蛍光免疫染色法によって、1型コラーゲン繊維(赤)と表皮角化細胞のうち増殖中の細胞(白)を観察した。THSモデルでは、1型コラーゲン繊維と表皮増殖細胞数が著しく増加していることが分かる。スケールバーは左列から50μm、20μm。
b)抗光老化治療薬ATRAによるコラーゲンの遺伝子発現促進作用は、THSモデルでのみ観察された。ヒアルロン酸合成酵素の遺伝子発現は全ての人工皮膚で促進されたものの、THSモデルで最も強く誘導された。
3)張力均衡による皮膚機能活性化の分子メカニズムの解析
張力均衡の再現による皮膚機能活性化の分子メカニズムを解明するため、細胞のメカニカルストレス応答状態を解析しました。THSモデルでは、コラーゲン受容体であるITGA2、ITGA2を介して細胞に伝達された張力を検知してコラーゲンやエラスチン[8]の遺伝子発現を誘導する転写因子[9]MRTF-A、MRTF-Aにより誘導される線維芽細胞の分化マーカーであるαSMAの三つのタンパク質量並びに細胞内局在の変化、そしてメカニカルストレスシグナルの活性化を確認しました(図4)。
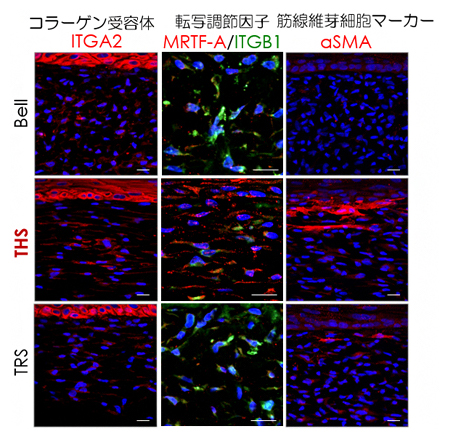
図4 張力均衡によるメカニカルストレスシグナルの活性化評価
THSモデルではメカニカルストレスシグナル分子であるITGA2、MRTF-A、αSMAのタンパク質発現が増加し、特にコラーゲンやエラスチンの遺伝子発現を制御するMRTF-Aが核内に移行し、遺伝子発現を活性化していることが分かる。スケールバーは全て20μm。
これらの結果から、人工皮膚に再現された張力均衡の力は、コラーゲン線維とその受容体ITGA2による細胞接着構造を介して細胞内に伝達され、転写因子MRTF-Aの核内への移動を促すことで、コラーゲンやエラスチンといった細胞外基質の遺伝子発現を誘導し、皮膚機能を活性化していることが示されました(図5)。
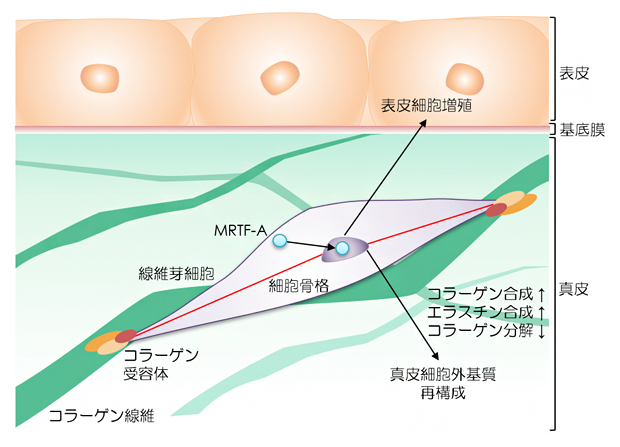
図5 張力均衡による皮膚恒常性維持メカニズムの模式図
皮膚の張力均衡は、コラーゲン線維とその受容体ITGA2を介して接着している線維芽細胞に伝達される。張力刺激を受けた細胞内の転写因子MRTF-Aは活性化し、核内へ移行することで遺伝子発現を開始し、その結果コラーゲン、エラスチンなどの真皮細胞外基質の合成促進、表皮角化細胞の増殖、薬物応答性の向上といった皮膚恒常性維持機能の変化を引き起こすと考えられる。
今後の期待
本研究により、張力均衡の再現によって従来の人工皮膚と比較して組織構造と皮膚機能が改善された人工皮膚モデル(THSモデル)の開発に成功し、張力が皮膚の構造と機能を制御することが明らかとなりました。本成果は、皮膚の張力均衡の役割など皮膚科学の研究に貢献するとともに、張力負荷型人工皮膚であるTHSモデルは、医薬品ならびにヘルスケア製品の有用性、安全性評価系の高度化、動物実験代替法として持続可能性のあるスキンケア製品開発に貢献すると期待できます。
また、本研究は、従来の薬物によるアプローチに加え、張力均衡に着目した新しい治療戦略、「メカニカルスキンケア」の実現につながると考えられ、生活の質(QOL)の改善とともに、健康長寿社会の実現に貢献すると期待できます。
補足説明
1.線維症
皮膚の線維芽細胞が活性化し、必要以上のコラーゲンなどの細胞外基質を産生することにより発症する疾患。正常な皮膚と比較して硬く、盛り上がった形となり、肌の伸縮性や見た目が悪くなる。
2.表皮、真皮
皮膚を構成する組織であり、表皮は皮膚の最表面の層で4層(角層、顆粒層、有棘層、基底層)から構成される。真皮は線維芽細胞と細胞外基質によって構成されており、その密度によって乳頭層と網状層の2層が存在する。
3.ターンオーバー
表皮細胞は、基底層に存在する幹細胞が自己複製することで新しい細胞が生まれ、分化しながら徐々に表面に押し上げられて角層へと移動し、最後は垢となって脱落する。このサイクルをターンオーバーと呼ぶ。ターンオーバーによって、表皮細胞は40~50日周期で入れ替わっている。
4.細胞外基質
細胞周囲の空間を充填する物質であり、物理的な支持体として細胞の足場の役割を果たしている。皮膚における細胞外基質の主な成分はコラーゲンであり、他にもエラスチンやフィブロネクチン、ラミニンなど、さまざまな成分から構成されている。
5.線維芽細胞
真皮に存在する細胞であり、細胞外基質を産生し、皮膚の恒常性を維持する役割を担う。また、周囲の細胞外基質と張力均衡に関与したり、怪我をした場合には、コラーゲンの産生を促進して傷の修復を促進する役割もある。
6.コラーゲン線維、1型コラーゲン線維
コラーゲン線維は皮膚の細胞外基質の90%以上を占める成分であり、細胞や組織の支持体として張力や強度を提供している。さまざまな型が存在することが知られており、1型コラーゲン線維は太く、張力や強度を必要とする組織に多く含まれるのに対し、3型や4型コラーゲン線維は細く、柔軟性を必要とする組織に多く含まれる。
7.表皮角化細胞
表皮細胞の別名であり、角化という特殊な分化をする細胞のことを指す。
8.エラスチン
細胞外基質の一つであり、しなやかで弾性がある線維であることから、肌の弾力性やハリに関与していると考えられている。
9.転写因子
DNAに特異的に結合するタンパク質であり、DNA上のプロモーター領域に結合し、任意の遺伝子の発現を制御する機能を担っている。
共同研究チーム
理化学研究所 生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
上級研究員 武尾 真(たけお まこと)
テクニカルスタッフ 土屋 綾子(つちや あやこ)
ロート製薬株式会社
研究員 木村 駿(きむら しゅん)
テクニカルスタッフ 小野 美姫(おの みき)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「皮膚附属器を有する革新的三次元皮膚評価モデル、バイオスキンの開発(研究代表者:辻孝)」およびロート製薬株式会社、Meiji Seikaファルマ株式会社による研究費の支援により行われました。
原論文情報
Shun Kimura, Ayako Tsuchiya, Miho Ogawa, Miki Ono, Nao Suda, Kaori Sekimoto, Makoto Takeo & Takashi Tsuji, “Tissue-scale tensional homeostasis in skin regulates structure and physiological function”, Communications Biology, 10.1038/s42003-020-01365-7
発表者
理化学研究所
生命機能科学研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
ロート製薬株式会社
研究員 木村 駿(きむら しゅん)
報道担当
理化学研究所 広報室 報道担当
ロート製薬株式会社 広報・CSV推進部