潰瘍性大腸炎や急性心不全、骨粗鬆症、糸球体腎炎などの治療法開発に光
2020-12-02 関西医科大学,京都大学,理化学研究所,日本医療研究開発機構
本件リリースのポイント
- Cryo-EM単粒子解析法によるプロスタグランジン受容体EP4-Gタンパク質複合体の構造解析に世界で初めて成功
- EP4の活性化に重要なアミノ酸残基を同定
- 潰瘍性大腸炎や急性心不全の治療薬開発につながる可能性
概要
学校法人関西医科大学(大阪府枚方市理事長・山下敏夫、学長・友田幸一、以下「関西医大」)医化学講座清水(小林)拓也教授と国立大学法人京都大学(京都市左京区総長・湊長博)医学研究科・医学部(研究科長/学部長・岩井一宏)分子生態統御学講座分子細胞情報学分野岩田想教授、同分野野島慎五大学院博士課程学生、同大学ウイルス・再生医科学研究所(研究所長・小柳義夫)ウイルス感染研究部門微細構造ウイルス学分野野田岳志教授、同分野藤田陽子大学院博士課程学生、国立研究開発法人理化学研究所(埼玉県和光市理事長・松本紘)放射光科学研究センター利用システム開発研究部門山本雅貴部門長、同部門重松秀樹研究員らの研究チームは、プロスタグランジン(以下「PGE2」)が結合したプロスタグランジン受容体(以下「EP4」)と、Gタンパク質の複合体を精製・解析し、世界で初めてその構造と活性化メカニズムを解明しました。また、EP4は同じGsタンパク質共役受容体グループの中の他の受容体では見られなかった特徴的な結合状態を有しており、プロスタグランジン受容体に特有の結合方法であることが予想されます。EP4作動薬は潰瘍性大腸炎や急性心不全などの治療薬として期待されており、今回EP4の活性化メカニズムが解明されたことから、これらの病気を治す新たな治療法開発の可能性が広がりました。なお、本研究は国立研究開発法人日本医療研究開発機構(創薬基盤推進研究事業、革新的先端研究開発支援事業、創薬等ライフサイエンス研究支援基盤事業BINDS、新興・再興感染症に対する革新的医薬品等開発推進研究事業)および日本学術振興会(研究拠点形成事業)の支援を受けて実施されており、高分解能での分子構造解析に必要な最先端クライオ電子顕微鏡での粒子像の撮影に際しては、東京大学医学系研究科生体構造学教室吉川雅英教授らの協力を仰ぎました。成果をまとめた論文は2020年12月1日(火)15時30分付(日本時間2020年12月2日0時30分)で米国科学誌『Structure』(インパクトファクター:4.862)に掲載されました。
論文掲載情報
- 掲載誌
- 『Structure』 D-20-00230R
- 論文タイトル
- Cryo-EM Structure of the Prostaglandin E Receptor EP4 Coupled to G Protein
- 筆者
- Shingo Nojima, Yoko Fujita, Kanako Terakado Kimura, Norimichi Nomura, Ryoji Suno, Kazushi Morimoto, Masaki Yamamoto, Takesi Noda, So Iwata, Hideki Shigematsu, Takuya Kobayashi
本件研究の背景
プロスタグランジンは脂質メディエーター※1の一種であり、炎症を初めとした様々な生理・病態生理に関わることが知られています。また、その受容体であるプロスタグランジン受容体は、プロスタグランジンを受容することで細胞内部のGタンパク質※2を活性化させる、Gタンパク質共役受容体(GPCR)に属する受容体です。
また、プロスタグランジンにはPGD2、PGE2、PGF2α、PGI2があり、それぞれに対応した受容体DP(DP1、DP2)、EP(EP1、EP2、EP3、EP4)、FP、IPが存在しています。一方、Gタンパク質にもGs、Gi、Gqなどの種類があり、受容体によって共役する※3Gタンパク質の種類はそれぞれ異なっていることが分かっています。
さらに、PGE2受容体の一つ、EP4は主にGタンパク質と共役することが知られている他、その作動薬が潰瘍性大腸炎や急性心不全などの治療薬の候補となっており、EP4の活性状態の構造解析はこれらの疾患の治療法の開発に繋がる可能性があると考えられています。しかし、これまで開発されてきた治療薬候補化合物は、副作用などのため実用化には至っていないものが多くあります。
このことから清水(小林)教授らの研究チームは、活性型のEP4の構造を解明することで活性化メカニズムを明らかにし、活性をコントロールできれば、より副作用の少なく効果の高い治療薬開発が進展する可能性があると考え、今回の研究を開始しました。
これまでに、清水(小林)教授らの先行研究では、PGE2が結合したEP3と、拮抗薬が結合したEP4の構造を解明していましたが、Gタンパク質と結合した活性化状態のプロスタグランジン受容体の構造は未解明であり、プロスタグランジン受容体がどのようにGタンパク質と結合し活性化するのかは、まだ解明されていない状況でした。
本件研究の成果
本研究では、PGE2が結合したEP4とGタンパク質(Gs)の複合体を精製し、クライオ電子顕微鏡(Cryo-EM)※4で粒子像を撮影したのち、単粒子解析※5を行うことで分解能3.3Åの電子顕微鏡マップを取得し、3Dモデルを構築することに成功しました。そして、得られた構造と拮抗薬の結合した不活性型のEP4の構造を比べると、これまで解明されてきた活性型のGPCRの構造の特徴と同様に、膜貫通ヘリックス6(TM6)※6が細胞内側で開いていました(図)。
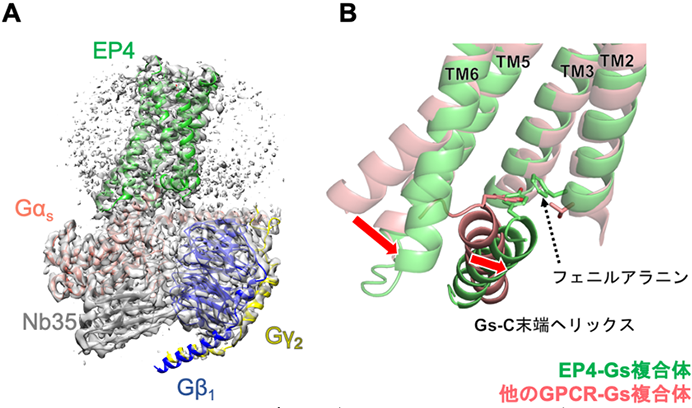
図A:EP4-Gタンパク質複合体の電子顕微鏡マップと3Dモデル。Nb35は構造決定を助けるナノボディ
図B:EP4-Gs複合体と他のGPCR-Gs複合体の結合様式の違い。EP4は他のGPCRと比べてTM6の開きが小さく、GsのC末端ヘリックスがTM2側に寄っている。
しかしながら、その開き具合は他のGs結合GPCRと比べて小さく、GsのC末端ヘリックスおよびループ※7が、膜貫通ヘリックス2(TM2)側に寄ってEP4と結合しているという特徴を発見しました。さらに、結合部位を調べると、プロスタグランジン受容体でよく保存されているTM2のフェニルアラニン※8残基が、EP4によるGsの活性化に重要であることが明らかになりました(図)。この結合様式は、これまで解明されたGPCRとGsタンパク質複合体の構造では認められなかった特徴で、プロスタグランジン受容体に特有なGsタンパク質との結合方法であると予想されます。
将来の可能性
本研究では、Gsタンパク質と結合したプロスタグランジン受容体の構造が明らかになりました。この構造と本研究グループの先行研究で明らかになったEP4の不活性型構造を比較することで、活性化に伴う構造変化を知ることができました。また、Gsタンパク質との結合に重要な残基がプロスタグランジン受容体内で保存されていることも明らかになっています。今後、これらの情報がプロスタグランジン受容体に特有の活性化メカニズム解明の手がかりになる可能性があります。また、さらに研究が進展すれば、潰瘍性大腸炎や急性心不全、糸球体腎炎、腎性尿崩症など様々な難治性疾患に対して副作用の軽減された治療薬開発が進むと考えられます。
用語解説
- ※1 脂質メディエーター
- 生物活性(生理作用)を持つ脂質。特に、細胞外に放出され、他の細胞の細胞膜受容体に結合することで作用する分子を指すことが多い。プロスタグランジンのほかには、ロイコトリエン、血小板活性化因子(PAF)、内因性カンナビノイド、リゾホスファチジン酸、スフィンゴシン-1-リン酸などがある。
- ※2 Gタンパク質
- グアニンヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。グアニンヌクレオチドを結合するαサブユニットのほかにβ、γのサブユニットからなり「三量体Gタンパク質」と呼ばれる。
- ※3 共役する
- 2つのものが1組となって結びつき機能を呈すること。ここでは、受容体にGタンパク質が結合することで下流にシグナルを伝える。
- ※4 クライオ電子顕微鏡(Cryo-EM)
- クライオ電子顕微鏡法とも呼ばれ、透過型電子顕微鏡法の一種で、試料を低温(多くの場合液体窒素の温度)において解析する手法である。構造生物学や細胞生物学の分野において用いられることが多い。
- ※5 単粒子解析
- 電子顕微鏡(電顕)を用いて撮影した生体高分子やその複合体粒子の投影像から、その三次元構造を計算する構造解析法のこと。
- ※6 膜貫通ヘリックス6(TM6)
- ヘリックス:αヘリックスとも呼ぶ。タンパク質の二次構造の共通モチーフの1つで、バネに似た右巻きらせんの形をしている。骨格となるアミノ酸の全てのアミノ基は4残基離れたカルボキシル基と水素結合を形成している。特に細胞膜を貫くように局在しているαヘリックスを膜貫通ヘリックスと呼ぶ。
- ※7 C末端ヘリックスおよびループ
- C末端ヘリックス:カルボキシ基末端に存在するヘリックス。
ループ:αヘリックスやβシートと異なり、特定の主鎖間の水素結合を取らない領域。 - ※8 フェニルアラニン
- アミノ酸残基の一種で、側鎖にベンジル基を持つ。略号はPheまたはF。アラニンの側鎖の水素原子が1つフェニル基で置き換えられた構造を持つことが名称の由来である。
本件事業に関するお問い合わせ先
学校法人関西医科大学
医化学講座 教授
清水(小林) 拓也
国立大学法人京都大学
医学研究科 分子生態統御学講座 分子細胞情報学分野 教授
岩田想
国立大学法人京都大学
ウイルス・再生医科学研究所 ウイルス感染研究部門 微細構造ウイルス学分野 教授
野田岳志
国立研究開発法人理化学研究所
放射光科学研究センター 利用システム開発研究部門 部門長
山本雅貴
本件リリースに関する取材のお問い合わせ先
学校法人関西医科大学 広報戦略室(岡田)
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課