隣の細胞にシグナルを伝えながら上皮は折れ曲がっていく
2018-07-06 理化学研究所
理化学研究所(理研)生命機能科学研究センター形態形成シグナル研究チームの小椋陽介基礎科学特別研究員、林茂生チームリーダーとフィジカルバイオロジー研究チームの柴田達夫チームリーダーらの研究チーム※は、器官形成における上皮[1]の折り曲げ運動を推進させる細胞外シグナル[2]の組織内伝搬の仕組みを、ショウジョウバエで発見しました。
本研究成果は、多細胞組織で細胞の挙動を協調させる原理の一つを解明したものです。また、将来的に再生医療の基盤技術につながる可能性がある知見です。
臓器の多くは、細胞が側面同士で密に接着したシート(上皮)が折れ曲がることによって作られています。今回、研究チームは、細胞同士のコミュニケーションを担うシグナル分子と、上皮の折り曲げ運動の関係を明らかにするため、細胞増殖と分化に深く関わる「細胞外シグナル調節キナーゼ(ERK)[3]」に着目しました。ERKは細胞外シグナルに対して、活性(オン)/不活性(オフ)の2通りの応答を示します。発生中のショウジョウバエ胚で、上皮組織(気管[4])の陥入運動におけるERK活性化の時空間分布を測定したところ、陥入初期には中心部に限定されていたERKのオン状態が、次々に隣接する細胞の“スイッチ”をオンにすることで、同心円状に波のように伝搬することを発見しました。さらに、ERK活性化の波は、細胞内のモーター分子ミオシン[5]の活性を制御して、上皮の陥入運動を調節することが明らかとなりました。
本研究は、米国の科学雑誌『Developmental Cell』(7月16日号)の掲載に先立ち、オンライン版(7月5日付け:日本時間7月6日)に掲載されます。
※研究チーム
理化学研究所 生命機能科学研究センター
形態形成シグナル研究チーム
基礎科学特別研究員 小椋 陽介(おぐら ようすけ)
研究員 ムスタファ・サミ(Mustafa M.Sami)
チームリーダー 林 茂生(はやし しげお)
フィジカルバイオロジー研究チーム
基礎科学特別研究員 フーライ・ウェン(Fu-LaiWen)
チームリーダー 柴田 達夫(しばた たつお)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究B「ERK活性の時空間伝搬による上皮陥入の再構成(研究代表者:小椋陽介)」と新学術領域研究(研究課題提案型)動く細胞と場のクロストークによる秩序の生成「上皮細胞の動態を制御する場としての力の発生とその応答(研究代表者:林茂生)」の支援を受けて行われました。
背景
私たちの体にある臓器の多くは、胃のような袋状の構造や肺や腎臓のような管状の構造を持つことで、独自の機能を果たしています。これらの構造は、細胞が側面同士で密に接着した「上皮」と呼ばれる細胞シートが変形することで作られます。特に、上皮の陥入は器官形成の主要な過程の一つであり、上皮がどのように折り曲げられるかを解明することは、多細胞生物の器官形成を理解する上で重要です。
長年にわたる研究から、非筋肉型ミオシン[6]による細胞の運動制御の仕組みが明らかになってきました注1)。また、上皮陥入時のミオシン活性の制御には、細胞外に分泌されるシグナル分子を介した上皮細胞同士のコミュニケーションが重要な役割を担っていると考えられていますが、その具体的な仕組みは、まだよく分かっていません。
細胞増殖と分化に深く関わる「細胞外シグナル調節キナーゼ(ERK)」は、細胞外シグナル分子であるEGF[7]に応答して活性化します。そのERKの活性(オン)/不活性(オフ)の切り替わりが、器官形成における細胞の振る舞いを制御するというモデルが提唱されています。そこで研究チームは、ERKに着目し、ショウジョウバエの上皮組織である気管の形成をモデルとして(図1)、ERKの活性化と上皮の折れ曲がり、非筋肉ミオシンとの関係について解析を試みました。
注1)2007年11月16日理研CDBニュース「EGFRシグナルの波が上皮の陥入を促す」
研究手法と成果
研究チームはまず、ショウジョウバエの呼吸器官である気管が上皮の折れ曲がりによって形作られる過程で、ERK活性の変化を追跡しました。具体的には、共鳴エネルギー移動[8]の原理を用いた蛍光タンパク質プローブ[9]を活用し、ERKの活性を生きた胚の細胞で継時的に定量しました。その結果、ERK活性は、はじめは気管上皮の中心部でのみ見られ、その後だんだん周辺部でも見られるようになりました(図2上段)。
ERKの活性化のタイミングに、気管上皮の中心部と周辺部で時間差がある理由として、①気管上皮の中心部から分泌されたEGFが濃度勾配を形成し、濃度依存的にERKの活性化する、②中心部の細胞のERK活性化が、隣接する細胞に次々と伝搬するといった二つが考えられます。①の場合、ERKの活性化はEGFの濃度に応じた段階的なものになると考えられます。しかし実際には、中心部と周辺部では、ERKの活性化に時間差があるにもかかわらず、個々の細胞での最終的なERK活性の大きさには大差がなく、オフ・オンかがはっきりしたパターンで起こっていました(図2下段)。したがって、実際に起きている現象は②であり、ERK活性をオフからオンへと素早く“スイッチ”を切り替える仕組みがあると考えられました。
次に、ERK活性がオフからオンに素早く切り替わる仕組みを明らかにするために、EGFを分泌する細胞の分布を詳しく調べました。気管上皮においてEGFは不活性型の前駆体として合成され、ゴルジ体[10]の膜上でロンボイド[11]と呼ばれるプロテアーゼ[11]によって切断されることで、初めて活性化して細胞外へと分泌されます。そのため、ロンボイドを発現する細胞をEGF分泌細胞と見なすことができます。
そこでロンボイド発現細胞の分布を調べたところ、はじめ気管上皮の中心部に限定されていましたが、時間経過とともに周辺部にも現れました(図3上段)。しかし、EGF受容体の変異体では、このようなロンボイドの発現の広がりは見られず、中心部に限定されていました(図3下段左)。これは、ロンボイドの発現にはEGF受容体が必須であることを示します。このことから、ロンボイドによって活性化され、分泌されたEGFが隣接する細胞のEGF受容体に結合し、新たにロンボイドの発現が活性化されることで、EGFの分泌が促進される、正のフィードバック制御[12]の存在が示唆されます。またこのことは、中心部のシグナル分泌細胞が、より外側の細胞でのERK活性を誘導するサイクルを繰り返して、ERK活性が伝搬されているというモデルを支持します(図3下段右)。
次に、ERK活性化のスイッチ特性と活性伝搬により上皮の折れ曲りが引き起こされるというモデルが、力学的に妥当であるかを検討するために、この数理モデル[13]を作成し、コンピュータシミュレーションを行いました。
EGFシグナルのフィードバック制御を考慮したモデルにおいて、隣接する細胞間でのERK活性の差に比例してミオシンが集積するという条件で計算を行うと、ミオシンの集積はERK活性の落差が最も大きいERK活性化領域を取り囲む細胞境界で起こり、ERK活性化の伝搬に伴って同心円状に広がるパターンが現れました(図4上段)。細胞境界の収縮力はミオシン集積が描く円の周長に比例して大きくなるため、ERK活性の広がりとともに上皮が徐々に深く折れ曲ることが分かりました(図4下段)。一方、EGF分泌細胞を中心にEGFの濃度勾配が形成され、濃度依存的にERKを活性化するモデルでは、同じ条件でも上皮の陥入は起こりませんでした。このようにして、ERK活性の伝搬が物理的に上皮の陥入を起こし得る仕組みであることを確かめました。
今後の期待
ショウジョウバエの発生において、形態形成運動は極めて高い再現性で起こります。本研究で明らかになったEGF-ERKシグナル伝達経路に内在する正のフィードバック機構は、リレーによるERK活性の伝搬を可能にし、これにより生じたERK活性化の波が一種のタイマーとして働くことを示しています。この仕組みは、気管上皮の隣接する細胞の挙動を協調させ、折れ曲がり運動の高い正確性を保証すると考えられます。
上記のような、減衰せずに伝搬するERK活性の性質は、神経細胞において減衰することなく軸索を伝導する活動電位[14]の波と共通点がみられます。今回の研究はERK活性化の波にも神経軸索と同様のトリガー波の性質があることを示唆しています。実際に研究チームは、ある条件においてEGF-ERKシグナルの波が通常の範囲を超えて遠方に到達することを確認しました。ERK活性の波がこのような性質を持つことは、ショウジョウバエの気管原基が大きさの変化に柔軟に対応できることを示唆しています。今後、哺乳類の細胞でのERK活性の伝搬が同様のメカニズムによって起こっているか検討していくことで、再生医療の基盤技術にもつながる可能性があります。生体内の細胞が示す細胞外シグナルへの応答特性の研究はまだ始まったばかりです。ショウジョウバエのようなモデル生物を用いた研究から細胞外シグナルへの応答特性への理解を深めることは、今後さらに力を入れて取り組むべき研究課題であると考えられます。
原論文情報
Yosuke Ogura, Fu-Lai Wen, Mustafa M. Sami, Tatsuo Shibata, Shigeo Hayashi, “A Switch-like Activation Relay of EGFR-ERK Signaling Regulates a Wave of Cellular Contractility For Epithelial Invagination”, Manuscript Number: DEVELOPMENTAL-CELL-D-18-00046R3, Developmental Cell, 10.1016/j.devcel.2018.06.004
発表者
理化学研究所
生命機能科学研究センター 形態形成シグナル研究チーム
チームリーダー 林 茂生(はやし しげお)
基礎科学特別研究員 小椋 陽介(おぐら ようすけ)
生命機能科学研究センター フィジカルバイオロジー研究チーム
チームリーダー 柴田 達夫(しばた たつお)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 上皮
- 細胞が隙間なく敷き詰められシート状になったもの。体表や管腔の表面を覆って、さまざまな生理的機能を果たす組織として機能する。
-
- 細胞外シグナル
- 細胞表面に結合、または細胞外空間を拡散して自他の細胞の受容体に結合することで情報を伝達するタンパク質。EGFのほかにもFGF、Wnt、Hedgehog、TGF-βなどの細胞外シグナル分子がある。
-
- 細胞外シグナル調節キナーゼ(ERK)
- MAPキナーゼと呼ばれるリン酸化酵素の一種。EGF受容体などの受容体型チロシンキナーゼの活性化により、細胞膜上でSosが活性化されると、RasのGDPがGTPへと変換されて活性化される。活性型RasはキナーゼであるRafを活性化し、RafがMEKを、MEKがERKをというように順次活性化されるキナーゼの連鎖反応の終点に位置する。ERKは多様な基質をリン酸化し、それらの機能を調節する。ERKは、Extracellular signal-regulated kinaseの略。
-
- 気管
- 空気の通り道となる管状の呼吸器官。節足動物の気管は体を覆う外胚葉性の上皮が陥入して形成され、内胚葉性上皮からなる脊椎動物の気管とは起源が異なる。
-
- ミオシン
- アデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするモーター分子の一つ。筋肉型ミオシンと非筋肉型ミオシンが存在する。
-
- 非筋肉型ミオシン
- 主に細胞の運動に関わる。筋肉型と同様に、モータータンパク質であるミオシンが、アクチン繊維の上を一定の方向に移動することで力を発生する。リン酸化により活性化されたミオシンは繊維状の集合体を作り細胞境界に集積する。
-
- EGF
- 細胞の増殖や分化を制御する分泌タンパク質(上皮成長因子)の一つ。EGFは、Epidermal Growth Factorの略。
-
- 共鳴エネルギー移動
- 励起状態された蛍光分子が空間的に近接した別の蛍光分子へ向けて共鳴によりエネルギーを移動させる現象のこと。FRET(Fluorescence resonance energy transfer)と略称される。電磁波の放出を伴わない直接的なエネルギー移動であるため、FRETの効率は二つの蛍光物質の間の距離を反映している。酵素の基質の立体構造変化を検出することで酵素活性を調べることができる。
-
- 蛍光タンパク質プローブ
- 改変型GFPなどの蛍光タンパク質を、細胞内の特定の場所に局在化させたり、リン酸化などの修飾を受けるタンパク質配列を付加することで、蛍光が変化するように改変された融合タンパク質のこと。
-
- ゴルジ体
- 核膜や小胞体などともに細胞内膜系を構成する細胞小器官の一つ。タンパク質の翻訳後修飾や輸送の選別、脂質や多糖類の合成を行う。
-
- ロンボイド、プロテアーゼ
- ロンボイドは、ショウジョウバエで見つかった膜内プロテアーゼ。プロテアーゼはタンパク質を切断する酵素の総称であり、消化のほか、前駆タンパク質を特定箇所で切断することで成熟タンパク質とするなど、タンパク質の機能制御に関わるものも多い。
-
- フィードバック制御
- 出力が入力に作用することをフィードバックと呼ぶ。今回の実験で示されたEGFとロンボイドのように、自身の活性化が互いに依存する制御を受けている場合を正のフィードバックと呼ぶ。
-
- 数理モデル
- 自然現象を数式で記述したもの。細胞の形や移動、分子の反応速度や拡散速度、遺伝子発現制御の相互作用など、さまざまな生命現象を定量的に解析し、隠れた法則性を見出す際の有用な方法論。
-
- 活動電位
- 神経細胞は膜電位の急激かつ一過的な変化(約0.001秒)をドミノ倒しのように伝播することで信号を伝える。この膜電位変化は活動電位と呼ばれ、減衰することなく軸索を伝わるため、小さなネズミでも大きなキリンでも同じ強度の信号が伝わる。
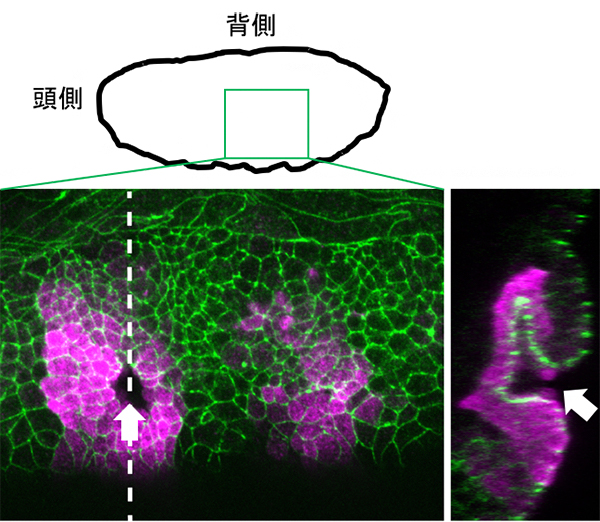
図1 ショウジョウバエ胚における気管形成
発生ステージ11(受精後約5時間20分-7時間20分。胚の外形を上の模式図で示す)のショウジョウバエ胚の胸部体節を、左側面から観察した蛍光顕微鏡像。気管原基を紫色、細胞の輪郭を緑色で示した。左図の左が頭側、上が背側。外胚葉性上皮が気管原基となり、陥入している場所を矢印で示した。右図は、左図の白破線部の断面を示す。
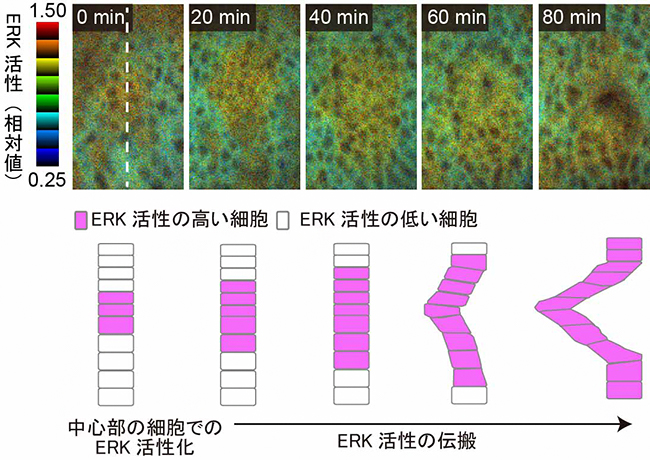
図2 共鳴エネルギー移動によるERK活性時空間パターンの可視化
上段: 細胞外シグナル調節キナーゼ(ERK)の活性を示した顕微鏡像。画像上の数字は、気管上皮の中心部でERKの活性化が起きたときからの経過時間(分)を示しており、ERK活性は、始めは気管上皮の中心部でのみ見られたが、その後はだんだん周辺部でも見られるようになっていることがわかる。
下段: 上段の白破線の断面の模式図。ERK活性の伝搬と胚の内部(左側)に上皮が陥入する様子がわかる。
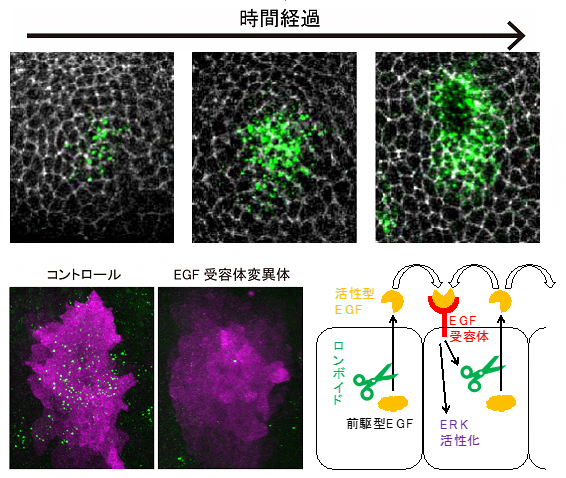
図3 EGFシグナルのフィードバックによるERK活性の伝搬
上段: 組織免疫染色画像で、ロンボイドの発現(緑色)と気管細胞の細胞境界(白色)を示した。 時間経過とともに、ロンボイドの発現が中心から周辺部に広がる。
下段:左: 正常胚(コントロール)とEGF受容体変異体においてロンボイドの発現(緑色)とERKの活性化(紫色)。変異体ではロンボイドの発現が広がらず、ERK活性化の領域も明瞭ではない。
下段右: EGFとロンボイドによるシグナル伝達経路の模式図。ロンボイドはEGFを活性化し、EGFによって活性化するEGF受容体がロンボイドの発現を活性化するという正のフィードバック制御を受けている。
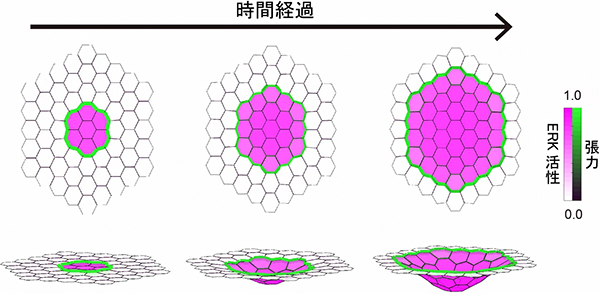
図4 数理モデルによる気管上皮の陥入のシミュレーション
ERK活性化のスイッチ特性と活性伝搬により、上皮の折れ曲りが生じることを数理モデルのコンピュータシミュレーションで示した。細胞ごとのERK活性の強さを紫色の勾配で、細胞境界で発生する張力の大きさを緑色の勾配で示す。上段は上皮の平面に対して真上から見た平面図で、下段は斜めから見た立体図。