2022-01-19 大阪大学,日本医療研究開発機構
研究成果のポイント
- オートファジー※1による骨芽細胞※2活性化のメカニズムを解明
- オートファジー亢進モデルマウスにおいて、骨粗鬆症が抑制される
- 骨粗鬆症の新規治療薬への応用に期待
概要
大阪大学大学院医学系研究科の吉田豪太大学院生(研究当時)、医学系研究科/生命機能研究科の吉森保教授(遺伝学/細胞内膜動態研究室)らの研究グループは、オートファジーによって骨芽細胞が活性化するメカニズムを世界で初めて明らかにしました。
これまでオートファジーは、骨芽細胞を活性化することは知られておりましたが、どのようなメカニズムで活性化するのかについては解明されていませんでした。
今回、吉森教授らの研究グループは、大阪大学大学院医学系研究科遺伝学教室で開発されたオートファジー亢進マウスを用いてオートファジーが骨粗鬆症を抑制することを明らかにしました。これにより、従来にはないメカニズムで骨芽細胞を活性化させる骨粗鬆症治療薬の開発が期待されます。
本研究成果は、米国科学誌「Autophagy」に、2022年1月13日(木)に公開されました。
研究の背景
これまで、骨芽細胞をターゲットとする薬剤は、副甲状腺ホルモン製剤※3のみが知られていました。骨形成促進作用をもつ薬剤選択が限られており、更に副甲状腺ホルモン製剤は使用期間が限定されているという課題がありました。
また、オートファジーによって骨芽細胞の機能が活性化するということはこれまでの研究でわかっていましたが、どのようなメカニズムで活性化するのか不明でした。
本研究の成果
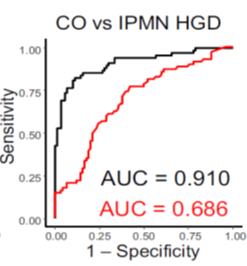
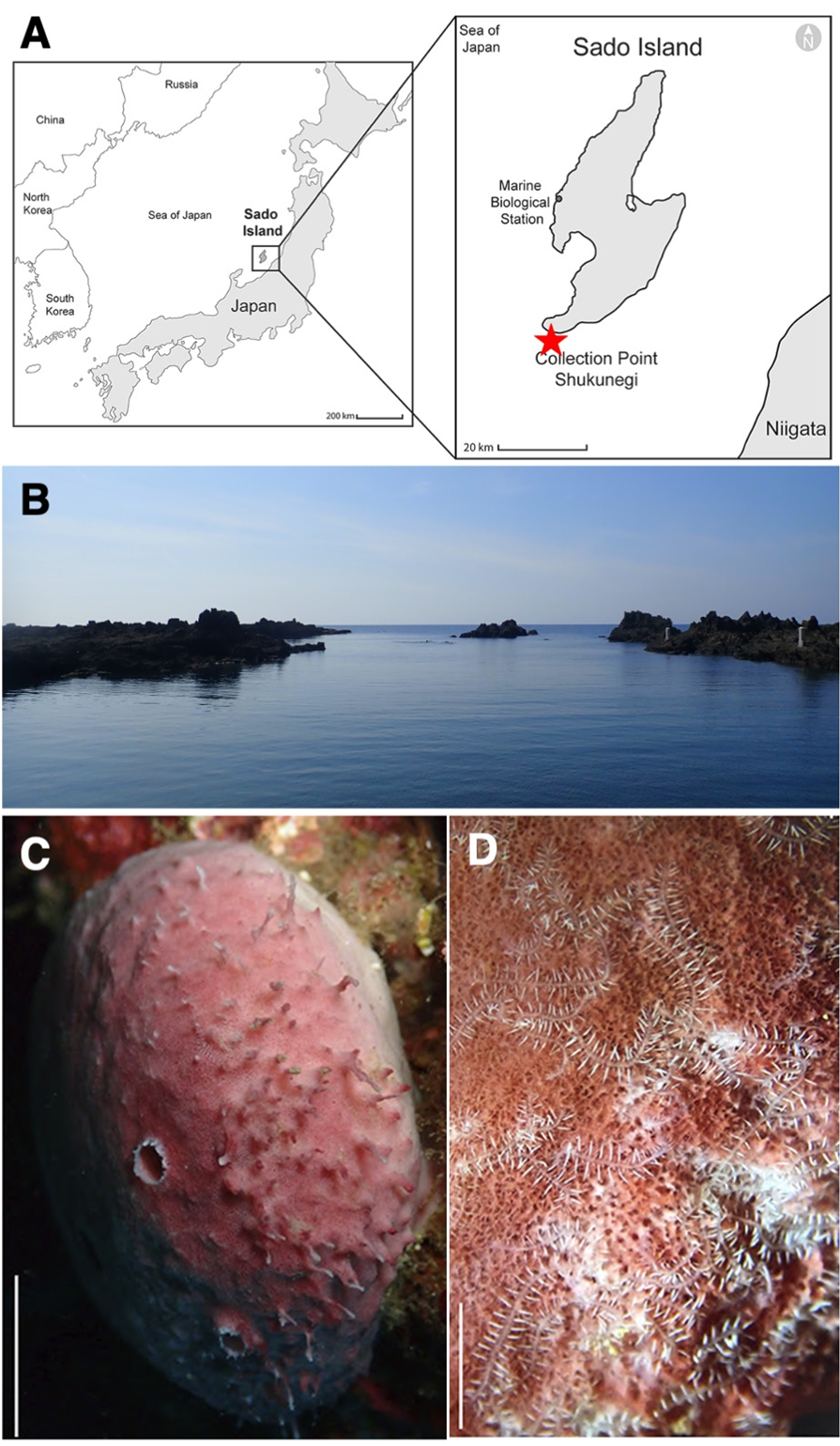
吉森教授らの研究グループでは、オートファジー抑制タンパク質Rubicon(ルビコン)※4を欠損させることによってオートファジー亢進マウスを作成することに成功しており、これらのマウスを使って、まず骨芽細胞特異的なRubicon欠損マウスを作成しました。この骨芽細胞特異的オートファジー亢進マウスの海面骨は増骨性の変化を示し(図1)、さらに骨粗鬆症モデルの骨粗鬆症が改善しました(図2)。これまで、NOTCH経路※5が骨芽細胞分化に抑制性に機能していると報告されてきましたが、このオートファジーが亢進した骨芽細胞ではNOTCHシグナル下流のNICDの分解が促進していることが分かりました。そのため、NICDが減少することでその下流に位置する増骨性の転写因子(Runx2、Osterix)が増加しており(図3)、骨芽細胞の分化が亢進しているということが判明しました。
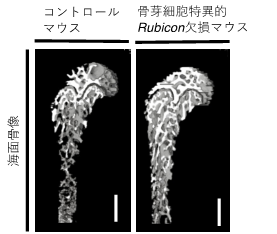
図1海面骨像
オートファジーが亢進している骨芽細胞特異的Rubicon欠損マウスでは海面骨の増骨性変化が認められた。
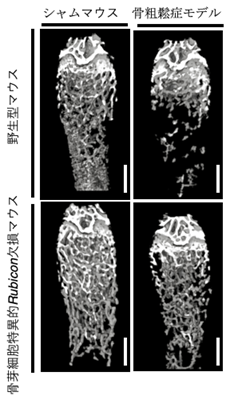
図2 骨芽細胞特異的Rubicon欠損マウスでは骨粗鬆症モデルマウスの海面骨が改善
骨芽細胞特異的Rubicon欠損マウスに骨粗鬆症を誘導しても、野生型シャムマウス程度まで海面骨が改善した。
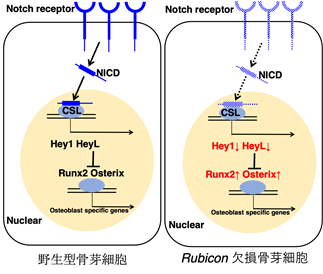
図3 Rubicon欠損骨芽細胞が分化亢進するメカニズムRubicon欠損骨芽細胞ではNICDの分解が亢進し、 NOTCH下流に位置する増骨性の転写因子(Runx2,Osterix)が増加する。これにより骨芽細胞の分化が促進されている。
*Hey1、HeyL;NOTCH下流の転写因子
*Runx2、Osterix;増骨性の転写因子でHey1、HeyLによって抑制性に制御されている
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、新規の骨芽細胞をターゲットとした創薬の可能性が期待されます。例えば、Rubiconの阻害剤の開発が進めば、オートファジーを促進することができるため、その薬剤の骨芽細胞への特異的送達により骨芽細胞のみオートファジーを促進する治療法開発の可能性が考えられています。社会の高齢化に従って骨粗鬆症の患者が増加し、骨折による長期臥床が原因で寝たきりになる患者が増えています。我が国のみならず世界的にも高齢化社会が進行し同様の問題を抱える国が多いという現状があります。その中で、増骨性の新規薬剤が創られれば、広く必要とされる薬剤となる可能性が高いと思われます。
特記事項
本研究成果は、2022年1月13日(木)に米国科学誌「Autophagy」(オンライン)に掲載されました。
- タイトル
- “Degradation of the Notch intracellular domain by elevated autophagy in osteoblasts promotes osteoblast differentiation and alleviates osteoporosis”
- 著者名
- Gota Yoshida1, Tsuyoshi Kawabata1,2,3, Hyota Takamatsu4, Shotaro Saita1,2, Shuhei Nakamura1,2, Keizo Nishikawa5,6, Mari Fujiwara1,2, Yusuke Enokidani1,2, Tadashi Yamamuro1,2, Keisuke Tabata1,2, Maho Hamasaki1,2, Masaru Ishii5, Atsushi Kumanogoh4* and Tamotsu Yoshimori1,2* (* 責任著者)
- 所属
-
- 大阪大学大学院医学系研究科 遺伝学
- 大阪大学大学院生命機能研究科 細胞内膜動態研究室
- 長崎大学原爆後障害医療研究所 幹細胞生物学研究分野
- 大阪大学大学院医学系研究科 呼吸器・免疫内科学
- 大阪大学大学院医学系研究科 免疫細胞生物学
- 同志社大学生命医科学部 医生命システム学科
- DOI
- 10.1080/15548627.2021.2017587
なお、本研究は、日本医療研究開発機構 (AMED)「老化メカニズムの解明・制御プロジェクト」研究の一環として行われました。
用語説明
- ※1 オートファジー
- オートファジーは細胞が自己成分を分解する機能のことですが、近年オートファジー研究が飛躍的に発展し、様々な疾患の発症抑制や発生、分化、老化、免疫などに重要な生理機能を持つことが明らかになっています。
- ※2 骨芽細胞
- 骨を作る細胞のことで、基質タンパク質を生成、分泌して骨の石灰化に働いています。骨芽細胞が成長し、骨化が進むと骨細胞になります。
- ※3 副甲状腺ホルモン製剤
- 骨形成促進薬。「骨折の危険性が高い骨粗鬆症」に対して広く使用されています。骨形成促進薬としては、他に抗スクレロスチン抗体薬(ロモソズマブ)が知られています。
- ※4 Rubicon(ルビコン)
- 当研究室で発見されたオートファジーを抑制するタンパク質です。加齢に伴い、Rubiconが増加することが知られており、いくつかのモデル生物でRubiconを抑制するとオートファジーが活性化し、老化現象の抑制と寿命の延伸が確認されています。
- ※5 NOTCH経路
- NOTCH経路は神経、血管などの分化過程で働く遺伝子調節経路です。NOTCH経路にシグナルが伝達されると、NOTCHの細胞内ドメインである、NICDが核内にリクルートされ、骨芽細胞においてはHey1やHeyLなどの転写因子が増骨性の転写因子であるRunx2やOsterixを抑制することで、分化を抑制性に制御していることが知られています。
本件に関するお問い合わせ先
研究に関すること
吉森 保(よしもり たもつ)
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学 教授
報道に関すること
大阪大学 大学院医学系研究科 広報室
AMED事業に関すること
日本医療研究開発機構 (AMED)
疾患基礎研究事業部 疾患基礎研究課
老化メカニズムの解明・制御プロジェクト