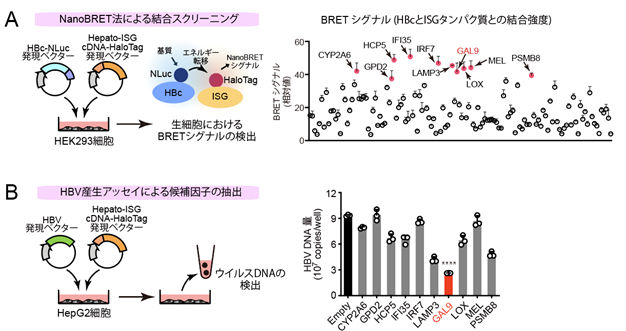
新規がん免疫療法開発の可能性が期待
2022-01-28 国立がん研究センター,名古屋大学,日本医療研究開発機構
発表のポイント
- がん組織に存在する制御性T細胞*1のPD-1タンパク質の発現によって、免疫チェックポイント阻害薬(PD-1*2/PD-L1阻害薬)の治療耐性が生じることが明らかとなりました。がん組織内の制御性T細胞はPD-1タンパク質を高発現することで治療耐性を引き起こし、組織内の乳酸により、このPD-1発現が誘導されることを新たに発見しました。
- これにより、乳酸を多く産生する肝転移病変などにおいて、免疫チェックポイント阻害薬に耐性化している機序に関与している可能性が示されました。臨床の場で抗PD-1抗体治療によって肝臓転移巣がむしろ増悪することがあることが知られていましたが、その原因の一部が明らかになったと考えられます。
- 乳酸代謝経路を阻害する薬剤によって、免疫チェックポイント阻害薬抵抗性の効果が得られない肝転移腫瘍などで治療効果が改善される可能性が考えられ、今後の研究開発につながることが期待されます。
発表概要
国立がん研究センター研究所と名古屋大学などの研究チームは、肝転移病変を始めとした解糖系*3が亢進した腫瘍において免疫チェックポイント阻害薬治療に耐性が導かれる新たな機構を発見しました。本発見は免疫チェックポイント阻害薬の治療効果を改善する新規治療法の開発につながると考えられます。
免疫チェックポイント阻害薬を用いたがん免疫治療法は、日本では2014年に悪性黒色腫で保険適用されて以降、肺がんや胃がんを始めとした様々ながん種の治療に用いられています。しかしながら治療効果が認められる患者さんが20~30%と少なく、治療効果が認められない原因を解明し、新たな治療法を生み出すための研究が必要です。
これまで研究チームはがん組織に存在するPD-1を発現した制御性T細胞がPD-1/PD-L1阻害薬治療耐性と相関があることを見出して報告してきました(Kumagai S, et al. Nat Immunol 2020)。本研究では免疫チェックポイント阻害薬(ニボルマブ、ペンブロリズマブ)による治療もしくは手術治療を受けた悪性黒色腫、肺がん、胃がん患者のがん組織検体を用いて、がん組織に存在する免疫細胞に関する詳細な解析を行いました。その結果、肝転移病変を始めとした解糖系が亢進した腫瘍においては、グルコースが代謝されることによりがん組織内の乳酸濃度が高まり、それに伴い制御性T細胞のPD-1発現が高まり、PD-1/PD-L1阻害薬治療耐性につながっていることを見出しました。また、T細胞の中で制御性T細胞だけが乳酸を代謝して活性化する経路を持っていることを発見し、それにより制御性T細胞が乳酸濃度の高いがん組織で活性化(PD-1発現)していることを明らかにしました。これは、肝臓転移巣が抗PD-1抗体治療でhyper progressionする機序の解明に繋がりました。乳酸の代謝機構の阻害薬を併用することで、制御性T細胞によるがん組織の免疫抑制が解除され、PD-1/PD-L1阻害薬治療への耐性が改善することを示しました。
研究成果は2022年1月27日付(英国時間)米国科学雑誌「Cancer Cell」電子版に掲載されました。
本研究は、国立がん研究センター研究所 腫瘍免疫研究分野、先端医療開発センター免疫TR分野 西川博嘉分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授併任)、同研究所 細胞情報学分野 間野博行 分野長、熊谷尚悟外来研究員(日本学術振興会 PD特別研究員、先端医療開発センター 免疫TR分野 外来研究員併任)らの研究チームで行いました。
背景
PD-1/PD-L1阻害薬によるがん免疫療法は、悪性黒色腫、肺がん、胃がんをはじめとした様々ながん種に奏効することが科学的に証明され、臨床現場にがん治療の新たな柱として用いられています。しかしながら、治療を受けた患者さんの70%以上がPD-1/PD-L1阻害薬治療に反応しないため、治療効果を精度高く予測するバイオマーカーが必要です。がん組織におけるPD-L1の発現が有用な治療効果予測バイオマーカーの候補とされていますが、必ずしも治療効果と相関するわけではなく、より確度の高い新規バイオマーカーの同定が待たれていました。これまで、本研究チームはがん組織に存在する制御性T細胞のPD-1発現が高いことがPD-1/PD-L1阻害薬治療耐性につながることを見出し、治療前のがん組織内のリンパ球のPD-1発現バランス(エフェクターT細胞*4に発現するPD-1陽性率と制御性T細胞に発現するPD-1陽性率の比率)がPD-1/PD-L1阻害薬の有用な効果予測バイオマーカーとなることを報告してきました。
しかしながら、がん組織に存在する制御性T細胞がPD-1を高発現する詳細な機構はこれまでわかっていませんでした。
研究方法・成果
国立がん研究センター東病院において外科的手術により切除された肺がんもしくは胃がん検体から腫瘍浸潤リンパ球を抽出し、フローサイトメトリー*5を用いて解析しました。また、同時に次世代シークエンサーを用いてがん組織での遺伝子発現の網羅的解析を実施しました。腫瘍浸潤制御性T細胞のPD-1発現が高い腫瘍と低い腫瘍とを比較したところ、腫瘍浸潤制御性T細胞のPD-1発現が高い腫瘍で解糖系に関わる遺伝子発現が高いことが明らかになりました。解糖系が高まる病態として肝転移病変が知られていることから、肺がん原発病変と肝転移病変の両方の検体を用いて多重免疫染色を実施しました。肝転移病変では原発病変と比較して制御性T細胞のPD-1発現が高く、網羅的遺伝子発現解析で得られたデータが確認されました(図1)。
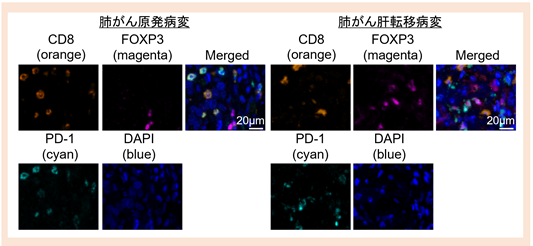
図1 多重免疫染色を用いた原発病変と肝転移病変における免疫応答肺がん原発病変と肝転移病変の検体が取得された患者さんを対象に多重免疫染色を実施しました。肝転移病変では原発病変と比較して腫瘍浸潤制御性T細胞にPD-1が高発現していました。
次に解糖系が高まっている腫瘍においてなぜ腫瘍浸潤制御性T細胞においてPD-1発現が高まるのかを検討するため、腫瘍浸潤リンパ球の網羅的遺伝子発現解析を実施して比較検討しました。腫瘍浸潤PD-1陽性制御性T細胞では他のリンパ球と比較して乳酸トランスポーターであるMCT1(遺伝子名SLC16A1)の発現が高まっていることを見出し、腫瘍の解糖系の最終代謝産物である乳酸を制御性T細胞が取り込むことでPD-1発現を高めている可能性が示唆されました。乳酸が制御性T細胞上のPD-1発現を誘導する機序を検討するため、低糖環境下で乳酸濃度を漸増させ様々なT細胞を刺激しました(図2)。
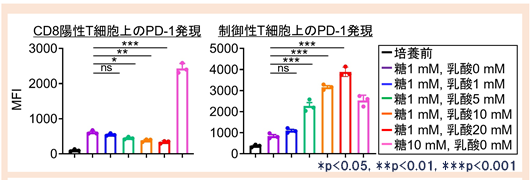
図2 各リンパ球のPD-1発現と乳酸の関係低糖環境下(1mM)で乳酸濃度を漸増させリンパ球を刺激すると、CD8陽性T細胞ではPD-1発現は低下しましたが、制御性T細胞ではPD-1発現が高まりました。
エフェクターT細胞(CD8陽性T細胞)では低糖環境下で乳酸濃度の上昇に伴いPD-1発現は低下したのに対して、制御性T細胞ではPD-1発現が高まりました。つまり、制御性T細胞ではCD8陽性T細胞とは異なり乳酸を介した特異的なPD-1発現機構を有していることを発見しました。
さらに、肝転移病変において解糖系が亢進し乳酸濃度が高まっているかを、マウスモデルを用いて検討しました。野生型マウスに皮下、胸腔内、肝臓内にマウス消化器がん細胞株であるMC38を接種しました。皮下腫瘍、胸腔内腫瘍に比較して、肝臓内腫瘍ではHIF1α発現上昇を介して解糖系関連分子発現が高まり、それに伴いその他の腫瘍と比較して乳酸濃度が上昇していました(図3)。
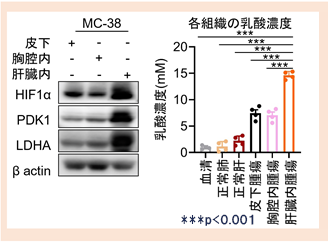
図3 各臓器におげる乳酸含有量野生型マウスの皮下、胸腔内、肝臓内に腫瘍細胞を接種し、解糖系閲連分子発現や乳酪含有量を検討しました。肝臓内腫瘍において最も乳酸含有量が高いことが判明しました。
また、肝臓内腫瘍では腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)のPD-1発現は低下している一方で、制御性T細胞のPD-1発現が高まり、抗PD-1抗体治療に抵抗性を示すとともに、hyper progressionに繋がっていると考えられ、本機序の重要性が示されました(図4)。
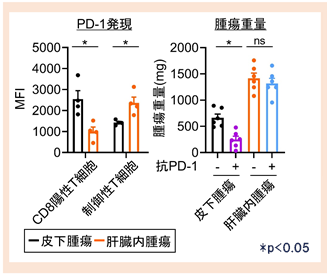
図4 各臓器における抗PD-1抗体治療効果野生型マウスの皮下、肝臓内に腫瘍細胞を接種し、浸潤リンパ球の表現型や抗PD-1抗体治摂効果を検討しました。
肝臓腫瘍では腫瘍浸潤制御性T細胞のPD-1発現が高く、抗PD-1抗体治疫に奏功しないことが明らかになりました。
国立がん研究センター中央病院、東病院にて進行胃がんもしくは肺がんがあり、抗PD-1抗体治療を受けた患者さんのデータを後方視的に解析したところ、肝転移病変があると抗PD-1抗体治療の無増悪生存期間*6が有意に短くなることが示されました(図5)。
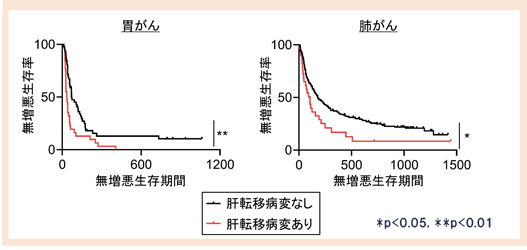
図5 肝転移病変と抗PD-1抗体治療効果の関係
肝転移病変を有する胃がん、肺がん症例では抗P0-1抗体の治疫効果が低下しました。
肝臓にMC38腫瘍を接種したマウスにMCT1阻害薬を投与したところ、腫瘍浸潤エフェクターT細胞(CD8陽性T細胞)のPD-1発現は上昇する一方で、制御性T細胞のPD-1発現は減弱しました(図6)。
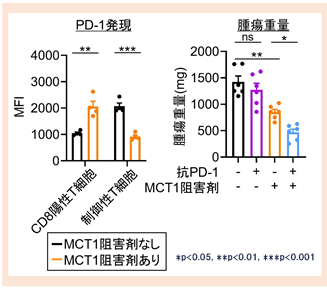
図6 各臓器におけるMCT1阻害治療効果野生型マウスの肝臓内に腫瘍細胞を接種し、MCT1阻害剤を用いて治療しました。浸潤リンパ球の表現型を評価し、抗PD-1抗体との併用効果を検討しました。
MCT1阻害剤を用いることで制御性T細胞のPD-1発現は弱まり、抗PD-1抗体治疫の効果が改善されました。
MCT1阻害薬を抗PD-1抗体と併用することで、肝臓腫瘍において抗PD-1抗体治療に対する抵抗性を改善でき、新たな治療標的として臨床開発につながる可能性が示唆されました。
研究結果のまとめ
本研究により、腫瘍浸潤エフェクターT細胞と制御性T細胞上のPD-1発現バランスは、腫瘍の解糖系の最終代謝産物である乳酸により調節されていることが明らかになりました。さらにマウスモデルにおいて肝転移病変を始めとした解糖系が亢進した腫瘍において、乳酸代謝経路を阻害する薬剤を併用することでPD-1/PD-L1阻害薬治療効果を改善できることを見出しました。
展望
これまで、PD-1/PD-L1阻害薬を始めとした免疫チェックポイント阻害薬治療は様々ながん種において、治療効果が証明されてきました。一方で、免疫チェックポイント阻害薬が奏功しない患者さんも多く、治療効果を高める必要があります。特に、肺がんや胃がんの肝転移病変は免疫チェックポイント阻害薬治療が効きづらいことが知られています。本研究により、肝転移病変を始めとした解糖系が亢進した腫瘍においては、乳酸代謝を介して腫瘍浸潤制御性T細胞のPD-1発現が高まり、PD-1/PD-L1阻害薬が奏効しづらくなっていることが明らかになりました。
今後、肝転移病変を有する患者さんでは、乳酸代謝経路を阻害する薬剤を併用することで、PD-1/PD-L1阻害薬治療の効果を高められる可能性が期待されます。がん患者さんを対象にした臨床開発に向けて検討を重ね、新たながん免疫治療法への展開を目指します。
発表論文
- 雑誌名
- Cancer Cell
- タイトル
- Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments
- 著者
- Shogo Kumagai1,2,3, Shohei Koyama2,4, Kota Itahashi2, Tokiyoshi Tanegashima2, Yi-tzu Lin2,3, Yosuke Togashi2, Takahiro Kamada2, Takuma Irie2, Genki Okumura2, Hidetoshi Kono2, Daisuke Ito2, Rika Fujii2, Sho Watanabe2, Atsuo Sai2,3, Shota Fukuoka2, Eri Sugiyama2, Go Watanabe2, Takuya Owari2, Hitomi Nishinakamura2, Daisuke Sugiyama3, Yuka Maeda2, Akihito Kawazoe5, Hiroki Yukami5, Keigo Chida5, Yuuki Ohara6, Tatsuya Yoshida7, Yuki Shinno7, Yuki Takeyasu7, Masayuki Shirasawa7, Kenta Nakama8, Keiju Aokage9, Jun Suzuki9, Genichiro Ishii6, Takeshi Kuwata6, Naoya Sakamoto6, Masahito Kawazu1, Toshihide Ueno1, Taisuke Mori10, Naoya Yamazaki8, Masahiro Tsuboi9, Yasushi Yatabe10, Takahiro Kinoshita11, Toshihiko Doi5, Kohei Shitara5, Hiroyuki Mano1 and Hiroyoshi Nishikawa2,3
- 所属
- 1Division of Cellular Signaling, National Cancer Center Research Institute, Tokyo 104-0045, Japan, 2Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical Trial Center (EPOC), National Cancer Center, Tokyo 104-0045/Chiba 277-8577, Japan, 3Department of Immunology, Nagoya University Graduate School of Medicine, Nagoya 466–8550, Japan, 4Department of Respiratory Medicine and Clinical Immunology, Osaka University Graduate School of Medicine, Osaka, Japan, 5Department of Gastroenterology and Gastrointestinal Oncology, 6Pathology and Clinical Laboratories, 9Department of Thoracic Surgery and 11Department of Gastric Surgery, National Cancer Center Hospital East, Chiba 277-8577, Japan, 7Department of Thoracic Oncology, 8Department of Dermatologic Oncology, 10Department of Pathology, National Cancer Center Hospital, Tokyo 104-0045, Japan.
- 掲載日
- 2022年1月27日付(日本時間1月28日)
主な研究費
日本医療研究開発機構(AMED)
次世代がん医療創生研究事業
「がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立」
日本医療研究開発機構(AMED)
次世代治療・診断実現のための創薬基盤技術開発事業
「患者層別化マーカー探索技術の開発/がん免疫モニタリングによる患者層別化を行う基盤技術の開発」
国立がん研究センター
国立がん研究センター研究開発費
「先端的がん免疫モニタリング法開発体制に関する研究、がん免疫療法抵抗性を解除する新規治療法の臨床展開に向けた開発研究」
日本学術振興会
科学研究費補助金
「発がんの人種差と免疫応答の関わりの解明」
用語解説
- *1 制御性T細胞
- 体内のCD4陽性細胞の中でFoxP3を強く発現するT細胞集団で、抗腫瘍免疫応答を含めたエフェクターT細胞による免疫応答を抑制する働きがあります。抗腫瘍免疫応答以外にも体内で起こる様々な免疫応答を抑制して免疫系の恒常性を維持しています。
- *2 PD-1
- PD-1は免疫細胞上に発現する免疫チェックポイント分子であり、樹状細胞やがん細胞に発現するPD-L1やPD-L2と結合することで、免疫細胞の働きを抑制します。PD-1/PD-L1阻害薬治療によりPD-1がPD-L1と結合しなくなることで、免疫細胞が本来の働きを取り戻し、がん細胞を攻撃するようになると考えられています。
- *3 解糖系
- 生物の体の中にある糖の代謝経路を指します。糖を分解し、細胞のエネルギー源となるATPを産生する多段階の化学反応です。最終代謝産物として乳酸を細胞外に放出します。一般的にがんでは正常細胞と比較して解糖系が高まると考えられています。
- *4 エフェクターT細胞
- 体内の免疫細胞の内、サイトカイン等を産生して標的細胞の排除に関わる細胞。特に抗腫瘍免疫応答ではCD8陽性のT細胞集団が、標的抗原を発現する細胞を殺傷します。抗腫瘍免疫応答においては、がん細胞に発現するがん抗原を認識してがん細胞を殺傷すると考えられています。
- *5 フローサイトメトリー
- フローサイトメトリーは主に細胞一つ一つのタイプを評価するために用いられるシステムであり免疫学の分野の研究では古くから用いられてきました。細胞に発現する分子に抗体で蛍光物質を標識し、一定波長のレーザー光を細胞に当てます。その際にレーザー光によって生じた蛍光を検出器で検出し、細胞に発現する20種類以上の分子の発現の強さを同時に評価することができます。現在は臨床現場でも使用可能となっています。
- *6 無増悪生存期間
- 無増悪生存期間は、ある薬剤の治療を始めた日から、がんの病勢が悪化するか、患者さんが亡くなった日までの期間と定義されます。特にがんに対する薬剤の効果を評価するための指標で、無増悪生存期間が長いほど薬剤の効果があると考えられます。
お問い合わせ先
研究に関する問い合わせ
国立がん研究センター
研究所 腫瘍免疫研究分野・先端医療開発センター 免疫TR分野
分野長 西川博嘉
広報に関する問い合わせ
国立がん研究センター
企画戦略局 広報企画室
東海国立大学機構名古屋大学 大学院医学系研究科総務課総務係
AMED事業に関する問い合わせ
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業