中分子ペプチド医薬品の基盤技術としての活用に期待
2022-03-15 九州大学,医薬基盤・健康・栄養研究所,日本医療研究開発機構
ポイント
- 有望な創薬モダリティ「中分子ペプチド」は、かさ高い置換基を導入することにより、革新的な医薬品となることが期待されている。しかし、立体障害のため、その合成は困難であった。
- 今回、ペプチド合成に利用されるα-アミノ酸へかさ高い置換基を導入する新技術の開発に成功し、これまで困難であった置換基の多様なデザインが可能となった。
- この技術を利用して、立体構造の安定化などの新しい機能性を付与した、革新的な次世代型医薬品「非天然型中分子ペプチド」創出への活用が期待される。
概要
数個から十数個のアミノ酸からなる「中分子ペプチド」は、従来の低分子医薬品や高分子医薬品に次ぐ、新たな創薬モダリティとして注目されています。生体内や天然に広く存在するα-アミノ酸に加え、かさ高い(立体的に非常に大きい)非天然α-アミノ酸を人工的に導入することが出来れば、天然α-アミノ酸と異なる性質をもつ高機能性ペプチドの創出につながり、革新的な次世代型医薬品として期待されています。しかし、かさ高い非天然α-アミノ酸の合成は極めて難しく、新規合成法の開発が強く望まれていました。
今回、九州大学大学院薬学府の辻汰朗大学院生、同大学大学院薬学研究院の矢崎亮助教、大嶋孝志教授らの研究グループは、同大学大学院薬学研究院の高橋大輔講師、医薬基盤・健康・栄養研究所 AI健康・医薬研究センターの李秀栄サブプロジェクトリーダー、水口賢司センター長らとの共同研究により、容易に入手できる汎用性の高い原料を用いたかさ高い非天然α-アミノ酸の新たな合成法を開発し、非天然α-アミノ酸を導入した安定な中分子ペプチドの創出に成功しました。
本研究グループはこれまで、かさ高い非天然α-アミノ酸の合成で障害となる大きな立体反発を克服する手法として、反応性の高いラジカル*1種を用いた合成法を世界に先駆けて報告しています(「立体的に大きな非天然α-アミノ酸の新たな合成法を開発」(2020年5月1日)*2。しかし、原料となるラジカル種は容易に入手できず、合成可能な非天然α-アミノ酸に制限があり、汎用的なペプチド合成への展開と機能評価を妨げてきました。
今回、本研究グループは、汎用性の高い原料を用いた非天然α-アミノ酸の合成法を新たに開発し、かさ高い非天然α-アミノ酸を導入したペプチドの創出に成功しました。さらに、円偏光二色性スペクトル法*3とインシリコ構造解析*4を用いて、非天然α-アミノ酸がペプチド構造を安定化することも明らかにしました。本研究成果は、汎用的な原料だけで、かさ高い非天然α-アミノ酸による中分子ペプチドの機能設計が可能であることを世界に先駆けて示した例であり、中分子ペプチド医薬品などの高機能ペプチド材料開発の基盤技術としての今後の活用が期待できます。
以上の本研究成果は、2022年3月14日(月)午後4時(ロンドン時間)に科学雑誌「Nature Synthesis」 にて公開されました。
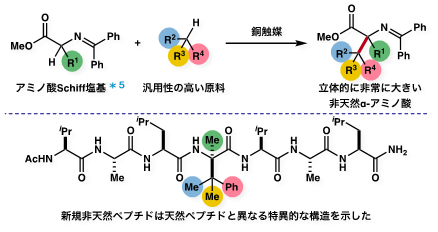
参考図入手容易な原料を用いた立体的に大きな非天然α-アミノ酸合成法の概要。
本手法では様々な種類の非天然α-アミノ酸を合成することが可能。合成した非天然α-アミノ酸を組み込んだペプチドは、従来のペプチドと比較してαヘリックス*6性が顕著に向上し、特異的な構造を示した。
研究の背景と経緯
数個から十数個のアミノ酸からなる「中分子ペプチド」は、従来の低分子医薬品や高分子医薬品に次ぐ、新たな創薬モダリティとして注目されています。生体内や天然に広く存在するα-アミノ酸に加え、かさ高い(立体的に非常に大きい)非天然α-アミノ酸を人工的に導入することが出来れば、天然α-アミノ酸と異なる性質をもつ高機能性ペプチドの創出につながり、革新的な次世代型医薬品として期待されています。そのため、これまでに数多くの非天然α-アミノ酸合成法が報告されています。しかし、これらの反応の多くが大きな立体反発を克服することが困難なイオン型の反応形式であり、かさ高い非天然α-アミノ酸の合成は極めて難しく、新規合成法の開発が強く望まれていました。
研究の内容と成果
今回の研究では、かさ高い非天然α-アミノ酸の合成で障害となる大きな立体反発を克服する手法として、反応性の高いラジカル種を用いた合成法を新たに開発しました。汎用性の高い原料として、クメンなどの炭化水素を用いることで様々な種類のかさ高い非天然α-アミノ酸を合成することが可能となりました(図1)。
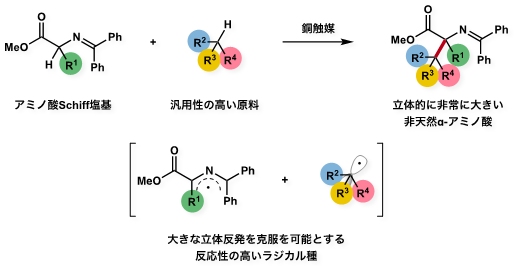
図1 立体の大きな非天然α-アミノ酸の反応スキーム
さらに、汎用性の高いペプチド固相合成を用いることで、かさ高い非天然α-アミノ酸を導入したペプチドの創出に成功しました(図2a)。新たに合成したペプチドについて、円偏光二色性スペクトル法とインシリコ構造解析を行うことで、かさ高い非天然α-アミノ酸が既存のα-アミノ酸と比較して、αヘリックス構造を安定化することを明らかにしました(図2b、c)。また詳細な反応機構解析を行うことで、より効率的な触媒や反応条件を見出すことにも成功しています。
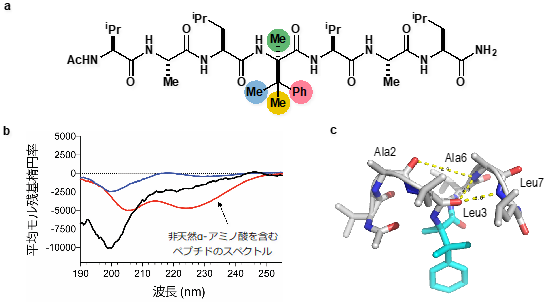
図2 a. 非天然α-アミノ酸を含むペプチド b. 円偏光二色性スペクトル法による測定結果 c. インシリコ構造解析によるペプチドの3次元構造
今後の展開
本研究成果は、汎用的な原料だけで、かさ高い非天然α-アミノ酸による中分子ペプチドの機能設計が可能であることを世界に先駆けて示した例であり、中分子ペプチド医薬品などの高機能ペプチド材料開発の基盤技術としての今後の活用が期待できます。
用語解説
- *1 ラジカル
- 全体の電荷は中性であるが、反応性の高い高エネルギー化学種。そのため様々な反応性を示す一方で、その制御が困難である。
- *2 先行論文
- *3 円偏光二色性スペクトル法
- 右円偏光と左円偏光の吸収の差を利用して、ペプチドやタンパク質の2次構造を特徴づける実験手法。
- *4 インシリコ構造解析
- 計算化学やバイオインフォマティクス の手法を用いた生体高分子の構造解析。インシリコ(in silico)は、生体内(インビボ、in vivo)や試験管内(インビトロ、in vitro)対してコンピュータ内を指す。
- *5 アミノ酸Schiff塩基
- O’Donnell教授らによって40年以上前に開発されたα-アミノ酸を合成するための原料。これまでに多くのアルキル化反応に用いられている。
- *6 αヘリックス
- ペプチドやタンパク質の2次構造の一種で、らせん構造のこと。タンパク質中のらせん構造をはじめとした2次構造は、他のタンパク質などを認識、機能を発現するために重要な役割を担っている。そのため、中分子ペプチド医薬品開発では、より小さなペプチドにおいて安定ならせん構造を形成することが一般的に求められる。
謝辞
本研究は日本医療研究開発機構(AMED)・創薬基盤推進研究事業「非天然α-アミノ酸を用いた中分子ペプチド医薬品創成」の一環で行われ、JSPS科研費(JP17H03972, JP21H02607, JP19K22501)、武田科学振興財団、上原記念生命科学財団、野口研究所、アステラス病態代謝研究会などの研究助成、ならびに日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業(九大 拠点)」の支援を受けて行われました。
論文情報
- 掲載誌
- Nature Synthesis
- タイトル
- α-Amino acid and peptide synthesis using catalytic cross-dehydrogenative coupling
- 著者名
- Taro Tsuji, Kayoko Hashiguchi, Mana Yoshida, Tetsu Ikeda, Yunosuke Koga, Yusaku Honda, Tsukushi Tanaka, Suyong Re, Kenji Mizuguchi, Daisuke Takahashi, Ryo Yazaki, and Takashi Ohshima
- DOI
- 10.1038/s44160-022-00037-0
お問い合せ先
研究に関すること
九州大学 大学院薬学研究院 教授 大嶋 孝志(オオシマ タカシ)
九州大学 大学院薬学研究院 助教 矢崎 亮(ヤザキ リョウ)
医薬基盤・健康・栄養研究所
AI健康・医薬研究センター インシリコデザインプロジェクト
医薬基盤・健康・栄養研究所
AI健康・医薬研究センター インシリコデザインプロジェクト
李 秀栄(リ スヨン)
報道に関すること
九州大学 広報室
医薬基盤・健康・栄養研究所 戦略企画部
AMEDの事業に関すること
日本医療研究開発機構 創薬事業部 医薬品研究開発課
創薬基盤推進研究事業