骨形成低下に伴う骨粗鬆症の新たな治療薬開発に道
2018-07-20 熊本大学,日本医療研究開発機構
熊本大学大学院生命科学研究部の吉澤達也准教授、山縣和也教授らの研究グループは、老化やストレス応答に関わるサーチュイン※1のひとつであるSIRT7が、骨形成に重要な役割を果たすことを発見すると共に、骨形成に必須の遺伝子の働きを活性化する新しいメカニズムを解明することに成功しました。
骨粗鬆症は老化などによる骨量減少のために骨折が起こりやすくなる疾患であり、要支援・要介護となるリスクが高くなるため、その対策は超高齢社会における重要な課題です。骨粗鬆症の治療では、骨吸収を抑える薬剤に比べて骨形成を促進させる薬剤は限られており、骨を再生させる治療薬の開発が望まれています。
今回、吉澤・山縣らの研究グループは、SIRT7酵素が無いマウスでは骨形成が低下し、骨粗鬆症様の病態を示すことを見出しました。また、骨組織におけるSIRT7の遺伝子発現は、加齢により減少することを突き止めました。さらに、骨を造る細胞(骨芽細胞)の形成(分化)に必須な遺伝子の働きを調節する因子SP7/Osterixの活性化には、脱アシル化酵素※2としてのSIRT7が重要であるという新たなメカニズムを発見することができました。
本研究の研究成果から、SIRT7によるSP7/Osterixの調節経路が骨形成低下に伴う骨粗鬆症の新たな治療薬開発のための標的となることが期待されます。
本研究成果は、文部科学省・日本学術振興会の科学研究費補助金、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」個体・臓器老化研究拠点「SIRT7による臓器老化メカニズムの解明とその制御」(JP17gm5010002)の支援を受けて行われ、平成30年7月19日(英国時間)に、英国のNature系科学誌「Nature Communications」オンライン版において掲載されました。
論文の概要
- SIRT7欠損マウスは、骨粗鬆症様の病態を示すことを見出した。
- 老化した骨組織では、SIRT7の発現が減少することを発見した。
- 遺伝子改変マウスや培養細胞を用いて、SIRT7が欠損すると骨芽細胞の分化が損なわれることを明らかにした。
- SIRT7は、SP7/Osterixタンパク質のアシル化修飾を取り除くことで、骨芽細胞の分化に関与する遺伝子群の発現を促進するという新たなメカニズムを発見した。
用語解説
- ※1 サーチュイン:
- 老化、ストレス応答、様々な代謝、がん、細胞の増殖・分化などの制御に重要な役割を果たす酵素。標的タンパク質中のリジン残基に結合したアシル化修飾を取り除く活性がある。哺乳類ではSIRT1からSIRT7の7種類存在する。
- ※2 脱アシル化酵素:
- タンパク質は遺伝子情報に従って合成された後に様々な化学的な修飾を受ける。脱アシル化酵素は、アセチル化やスクシニル化などに代表されるタンパク質のアシル化修飾を取り除く酵素。
発表論文
- タイトル:SIRT7 has a critical role in bone formation by regulating lysine acylation of SP7/Osterix
- 著者:Masatoshi Fukuda*, Tatsuya Yoshizawa*, Md. Fazlul Karim*, Shihab U. Sobuz, Wataru Korogi, Daiki Kobayasi, Hiroki Okanishi, Masayoshi Tasaki, Katsuhiko Ono, Tomohiro Sawa, Yoshifumi Sato, Mami Chirifu, Takeshi Masuda, Teruya Nakamura, Hironori Tanoue, Kazuhisa Nakashima, Yoshihiro Kobashigawa, Hiroshi Morioka, Eva Bober, Sumio Ohtsuki, Yuriko Yamagata, Yukio Ando, Yuichi Oike, Norie Araki, Shu Takeda, Hiroshi Mizuta, and Kazuya Yamagata
*共同第一著者 - 掲載誌:Nature Communications
9, Article number: 2833 (2018) - URL:https://doi.org/10.1038/s41467-018-05187-4
研究の背景
骨粗鬆症は骨量と骨質の低下により骨折が起こりやすくなる疾患であり、我が国における患者数は1,300万人を超え、予備軍を含めると2,000万人と言われています。加齢による骨の老化は骨粗鬆症の最大の要因の一つです。大腿骨と股関節を結ぶ大腿骨頸部や脊椎を構成する椎骨の骨折は、寝たきりの原因となり、要介護、QOL(生活の質)の低下、全身の機能低下、死亡率の増加などを引き起こすため、骨粗鬆症の対策は超高齢社会における重要な課題です。
生体の骨組織は、日々少しずつ壊され(骨吸収)、新たに作られる(骨形成)ことを繰り返しています。このバランスが崩れ、骨吸収が骨形成を上回ると、骨密度が減少します。骨粗鬆症の治療では、骨吸収を抑える薬剤に比べて骨形成を促進させる薬剤は限られており、骨を再生させる治療薬の開発が望まれています。
サーチュインは、標的タンパク質中のリジン残基に結合したアシル化修飾を取り除く酵素で、老化やストレス応答、様々な代謝などの制御に重要な役割を果たしています。哺乳類ではSIRT1からSIRT7の7種類が存在しています。SIRT7は、がんや脂質代謝に関与することが報告されていますが、骨組織における役割や骨老化との関わりは不明でした。
研究の内容
①SIRT7が骨形成に及ぼす影響
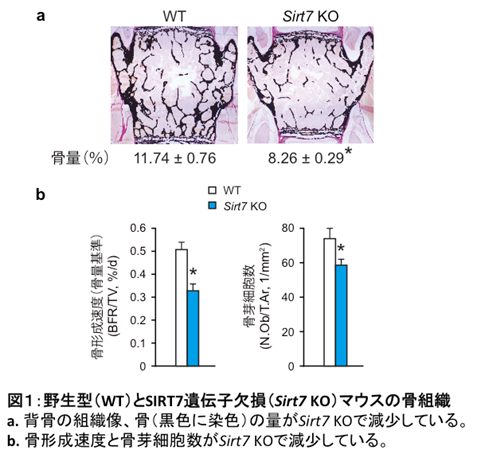
SIRT7遺伝子欠損マウスでは、骨量が減少していることを見出しました。さらに、骨形態計測の結果、骨形成および骨芽細胞数が低下していることが明らかになりました(図1)。骨芽細胞特異的にSIRT7を欠損させたマウスにおいても同様の結果が得られました。骨芽細胞のSIRT7は、骨形成に重要であることが判明しました。
②老齢マウスの骨組織におけるサーチュインの発現
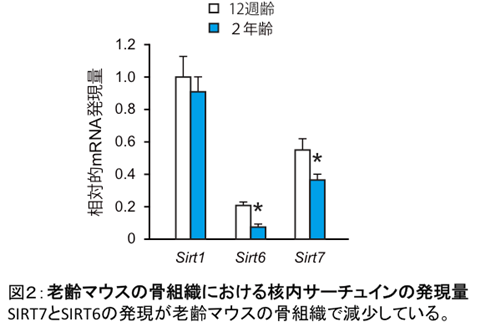
骨形成の低下は老人の骨粗鬆症でよく見られますが、そのメカニズムは十分に明らかとは言えません。そこで、核内に存在するサーチュイン(SIRT1,6,7)の骨組織における発現を若いマウスと老齢マウスで調べたところ、SIRT7は加齢により減少することが判明しました(図2)。加齢によるSIRT7の減少が、骨形成低下に伴う骨粗鬆症の原因の一つである可能性が考えられました。
③SIRT7が骨芽細胞の分化に及ぼす影響
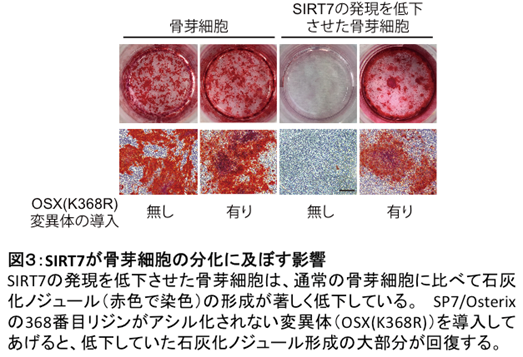
SIRT7の発現を低下させた骨芽細胞を作成し、培養皿中で骨を作らせたところ、通常の骨芽細胞に比べて骨様の塊(石灰化ノジュール)形成が著しく抑制されていました(図3)。さらに、骨芽細胞分化の指標となる遺伝子群の発現も低下していました。SIRT7は、骨芽細胞の分化を制御することが明らかとなりました。
④SIRT7によるSP7/Osterixの転写活性化
SIRT7による骨芽細胞の分化制御メカニズムを解明するため、骨芽細胞の分化に必須の遺伝子発現制御因子の転写活性を調べたところ、SIRT7が欠損した骨芽細胞ではSP7/Osterixの転写活性が著しく低下していました。
さらに、SP7/Osterixの高い転写活性化のためには、SIRT7がSP7/Osterixタンパク質の368番目のリジン残基(アミノ酸の一つ)におけるアシル化修飾を取り除くことが重要であることが明らかとなりました。SIRT7の発現を低下させた骨芽細胞に、SP7/Osterixの368番目リジンがアシル化されない変異体を導入したところ、低下していた石灰化ノジュール形成の大部分が回復することが明らかとなりました(図3)。
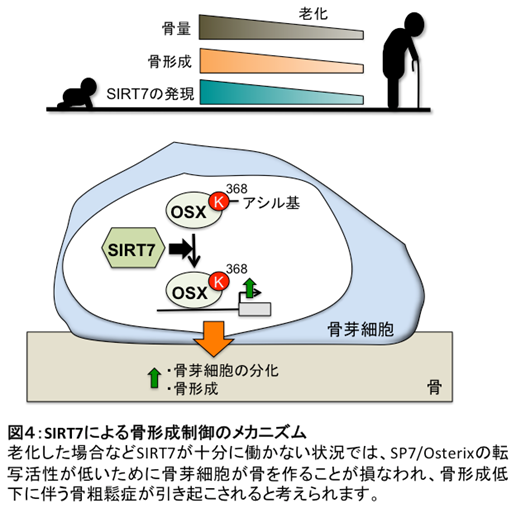
以上の結果から、骨芽細胞の分化に必須の遺伝子発現制御因子SP7/Osterixの転写活性化には、脱アシル化酵素としてのSIRT7が重要であるという新たなメカニズムを発見することができました。老化した場合などSIRT7が十分に働かない状況では、SP7/Osterixの転写活性が低いために骨芽細胞が骨を作ることが損なわれ、骨形成低下に伴う骨粗鬆症が引き起こされると考えられます(図4)。
今後の展開
本研究の研究成果から、SIRT7-SP7/Osterixの調節経路が骨形成低下に伴う骨粗鬆症の新たな治療薬開発のための標的となることが期待されます。
付記
本研究成果は、熊本大学大学院生命科学研究部の荒木令江准教授、澤智裕教授、山縣ゆり子教授、大槻純男教授、尾池雄一教授、森岡弘志教授、安東由喜雄教授、水田博志教授、鶴見大学歯学部の中島和久講師、東京医科歯科大学大学院医歯学総合研究科の竹田秀教授、ドイツマックスプランク研究所のEva Bober教授との共同研究により得られました。
参考図
お問い合わせ先
研究に関すること
熊本大学大学院生命科学研究部
病態生化学分野
担当:吉澤達也(准教授)
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課