2022-09-21 理化学研究所,東京都医学総合研究所,筑波大学
理化学研究所(理研)バイオリソース研究センターiPS細胞高次特性解析開発チームの林洋平チームリーダー(筑波大学医学医療系教授(連携大学院))、宋丹研修生(筑波大学大学院人間総合科学研究科博士課程)(研究当時)、東京都医学総合研究所再生医療プロジェクトの宮岡佑一郎プロジェクトリーダー(東京医科歯科大学大学院連携准教授、お茶の水女子大学大学院客員准教授)、高橋剛研究員、筑波大学医学医療系の小田竜也教授、鄭允文准教授(研究当時)らの共同研究グループは、肝臓難病であるウィルソン病[1]の患者から樹立したiPS細胞[2]を肝臓の細胞に分化させ、その病態を培養皿中で再現することに成功しました。
ウィルソン病はATP7B遺伝子の変異によって起こり、体内に不要な銅が蓄積するために、肝臓や脳などを中心に全身性の障害が生じる疾患です。本研究成果は、ウィルソン病や肝機能障害の新たな治療法開発につながると期待できます。
今回、共同研究グループは、患者から樹立したiPS細胞を肝細胞に分化させることで、ウィルソン病の病態を培養皿中で再現しました。さらに、ゲノム編集[3]を用いて、ATP7B遺伝子の変異を正常な配列へと修正したり、逆にATP7B遺伝子を変異させたりすることで、ATP7B遺伝子の詳細な機能解析を可能にしました。これらのiPS細胞に由来する肝細胞において、レチノイド[4]という物質がウィルソン病の症状を抑制することも見いだしました。
本研究は、科学雑誌『Human Molecular Genetics』オンライン版(9月21日付︓日本時間9月21日)に掲載されました。
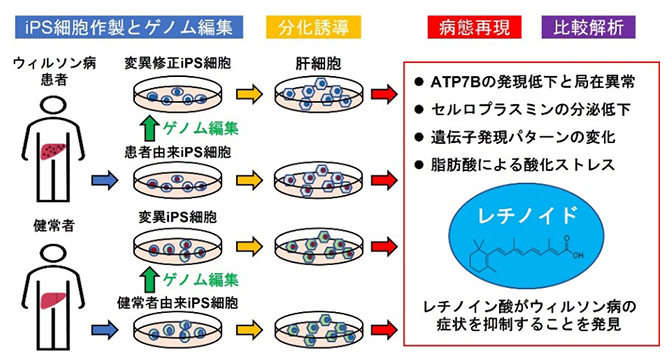
本研究の概要
背景
ウィルソン病は、細胞から銅を排出する機能を持つATP7B遺伝子の変異によって起こり、体内に不要な銅が蓄積するために、肝臓や脳などを中心に全身性の障害が生じる難病です。従来の食事制限や銅排出を促す薬による治療は副作用を生じる場合があり、新たな治療法の開発が望まれています。ウィルソン病の病理を研究するために、従来は不死化細胞株[5]や疾患モデルマウスが用いられてきましたが、ヒトと実験動物の種間差や、人による変異の種類の違い、個人の遺伝的背景の大きな隔たりという問題がありました。
共同研究グループは、複数のウィルソン病患者由来iPS細胞、そしてゲノム編集を用いて、原因遺伝子であるATP7Bの変異を模倣したiPS細胞を作り、それらのiPS細胞から肝細胞を分化させて比較解析することで、ウィルソン病の病態モデルを培養細胞で再現し、さらに疾患を抑制または治療できる薬剤を探すことができるのではないかと考えました。
研究手法と成果
本研究では、まずATP7B遺伝子に複合変異を持つ4名の患者からそれぞれiPS細胞を作製しました(図1)。これらのウィルソン病患者由来iPS細胞は、自己複製能、多能性、ゲノム完全性、およびATP7B遺伝子の複合ヘテロ接合型変異[6]を維持していました。次に、これらのiPS細胞の変異ATP7B遺伝子から作られるタンパク質の発現と細胞内での局在を調べたところ、変異の種類に応じて、発現量または細胞内での局在、またはその両方が異常になっていました。
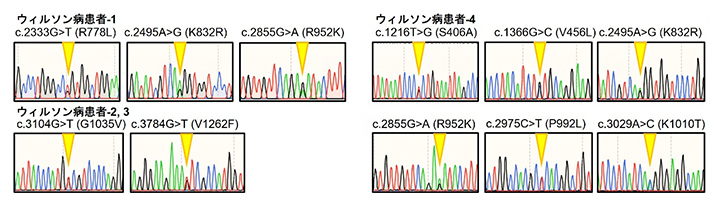
図1 4名のウィルソン病患者から検出されたATP7B遺伝子変異
4名のウィルソン病患者のATP7B遺伝子において、2~6種類の複合ヘテロ接合型変異が検出された。グラフの縦軸はDNAのシークエンス波形、横軸はDNAの配列順序を示す。黄色の矢印はそれぞれヘテロ接合の配列であることを示す。
肝細胞で合成されるセルロプラスミン(Cp)[7]というタンパク質は、トランスゴルジ体(ゴルジ体トランス面)[8]でATP7Bタンパク質によって取り込まれた銅に結合した後、血液に分泌される銅含有フェロキシダーゼです。血中のCpの低濃度は、一般にウィルソン病の診断基準として用いられます。今回、ウィルソン病患者由来iPS細胞から分化させた肝細胞においても、Cpの発現と分泌の低下を再現することに成功しました(図2)。
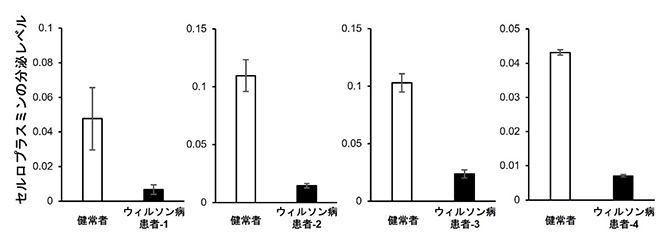
図2 ウィルソン病患者由来iPS細胞から分化した肝細胞のセルロプラスミン分泌量の測定
健常者ならびに4名のウィルソン病患者から作製された各iPS細胞を肝細胞へと分化させ、培地中に分泌されたセルロプラスミン(Cp)量を比較した。全てのiPS細胞で、Cpの分泌量が低下した。
さらに、ゲノム編集により、健常者由来iPS細胞株から2種類のATP7B遺伝子変異を持つiPS細胞株をそれぞれ作製しました。また、既知のウィルソン病患者由来iPS細胞株(ATP7B R778Lホモ接合体)の変異を修正したiPS細胞株を作製しました(図3)。
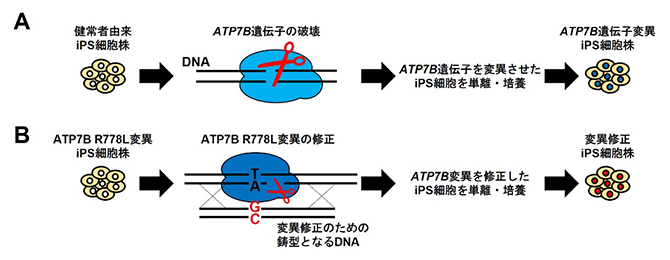
図3 ゲノム編集によるATP7B遺伝子の破壊もしくは変異の導入および変異の修正
(A)健常者に由来するiPS細胞株のATP7B遺伝子をゲノム編集によって破壊する、もしくは変異を導入することで、2種類のATP7B遺伝子の機能欠失iPS細胞株を作製した。
(B)ウィルソン病患者に由来するiPS細胞株(ATP7B R778Lホモ接合体)のATP7B遺伝子を、正常な配列へと修正したiPS細胞株を作製した。
これらのウィルソン病患者由来iPS細胞株とATP7B遺伝子機能欠失iPS細胞株を用いて、疾患表現型と遺伝子型の相関を探り、新しい治療薬候補を探索しました。トランスクリプトーム解析[9]により、ウィルソン病肝細胞において、レチノイドシグナル伝達経路と脂質代謝の異常に関連した遺伝子が同定されました。そこで、iPS細胞由来肝細胞のCp分泌を上昇させる薬剤を探索したところ、オールトランスレチノイン酸(ATRA)[4]および臨床的に安全性が示されているレチノイドが有望な候補として同定されました(図4)。また、ATRAはオレイン酸処理したウィルソン病肝細胞の脂質蓄積により誘導される活性酸素[10]種の産生も緩和しました(図5)。
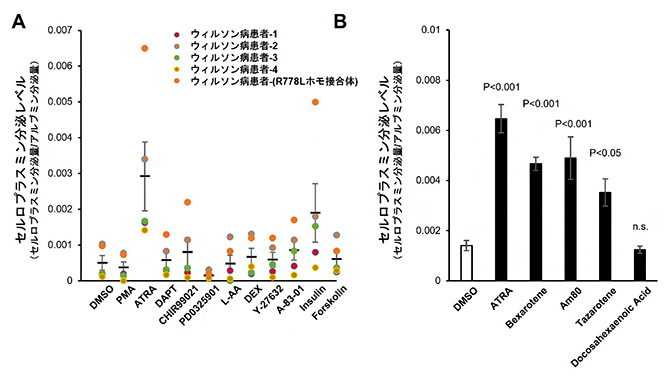
図4 Cp分泌量を上昇させる薬剤候補のスクリーニングおよびレチノイド添加実験
(A)ウィルソン病患者由来のiPS細胞を肝細胞に分化させ、候補となった薬剤を添加してセルロプラスミン(Cp)の分泌量の変化を測定した。オールトランスレチノイン酸(ATRA)はCp分泌量を上昇させた。
(B)ATRAはレチノイドの一種であることから、ATRAおよび市販の4種のレチノイドをウィルソン病患者iPS由来肝細胞に添加し、Cp分泌量の変化を測定した。Docosahexaenoic Acidを除く3種のレチノイドがCp分泌量を上昇させた。
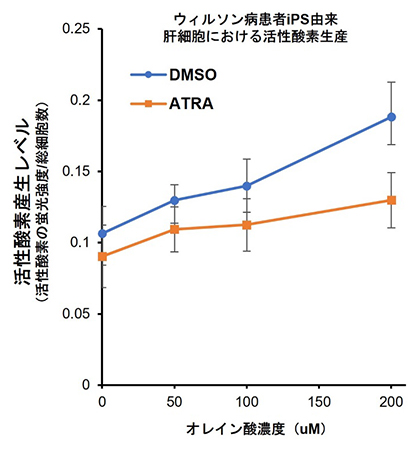
図5 ATRAによる活性酸素産生の抑制
健常者とウィルソン病患者iPS由来の肝細胞にオレイン酸を添加することで脂肪蓄積を誘導し、さらにATRAを添加することで活性酸素産生の抑制効果を検証した。
今後の期待
本研究では、ヒトiPS細胞由来の肝細胞を用い、Cp分泌に基づく薬剤スクリーニングおよび高オレイン酸濃度に対する活性酸素検出のアッセイを開発しました。このアプローチは、ウィルソン病肝細胞の初期の特徴を忠実に再現していると考えられるため、ウィルソン病や他の肝疾患における治療技術の開発と分子病態の検討のための有用な研究基盤になると期待できます。さらに、検出方法が明確で応用が容易であるため、将来的には、これらのアッセイを活用して、理想的な治療薬を同定するためのハイスループットスクリーニングシステムを実現することが望まれます。
また、ウィルソン病肝細胞において、レチノイドがCp分泌を回復し、酸化ストレス[10]を緩和することを初めて証明しました。Cpの分泌減少と肝脂肪症はウィルソン病の初期症状であるため、今回の結果は、レチノイドがこれらの症状の進行を予防するまたは遅らせる可能性を示しています。
一方、ATP7B遺伝子の異常がCp分泌や脂質代謝の異常につながる分子機構はまだ不明です。今後の研究では、銅と脂質代謝の関係を調査する必要があります。本研究成果が、ウィルソン病や関連肝疾患の新たな治療法開発につながることを期待し、今後それを手がける製薬企業などとの連携を望んでいます。
補足説明
1.ウィルソン病
飲食で摂取した銅が、肝臓から胆汁中・腸管中に正常に排泄されず多量に蓄積することで、肝臓や神経などに重篤な障害を引き起こす遺伝病(指定難病171)。細胞から銅を排出する機能を持つタンパク質であるATP7Bをコードする遺伝子の変異によって起こることが知られている。ウィルソン病の発症率は3~4万人に1人、日本全国で1,500人の患者がいるといわれている。
2.iPS細胞
ヒトを含む哺乳類の体細胞にごく少数の因子を導入し、培養すると、その細胞はさまざまな組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力を持つ多能性幹細胞に変化する。この細胞をiPS細胞(induced pluripotent stem cells:人工多能性幹細胞)と呼ぶ。
3.ゲノム編集
生物が持つゲノムDNAの特定の塩基配列を狙って変化させる技術。従来、外来の遺伝子を細胞に導入して新しい形質を付け加える遺伝子組換え技術があったが、ゲノム編集技術は細胞が元々持っている性質を細胞内部で変化させることが特徴である。ゲノム編集に使用される、現在主流となっているツールとしてCRISPR-Cas9(clustered regularly interspaced short palindromic repeats-CRISPR associated protein 9:クリスパー・キャスナイン)が挙げられる。
4.レチノイド、オールトランスレチノイン酸(ATRA)
レチノイドはレチノール(ビタミンA)の類縁化合物の総称で、細胞の増殖、分化や恒常性維持に関わる重要な化合物である。その一種であるオールトランスレチノイン酸(ATRA)は、体内でビタミンAから合成される主要なレチノイン酸で、トレチノインとも呼ばれる。生体内ではその合成と代謝が厳密に調節されており、さまざまな組織の形成に重要である。化学的に合成された医薬品として、急性前骨髄性白血病や尋常性痤瘡(ニキビ)の治療に用いられている。ただし、副作用として、外用薬としては高い皮膚刺激性、内服薬としては高い催奇性や「レチノイン酸症候群」などが起こる場合がある。
5.不死化細胞株
ヒトを含む動物細胞にウイルスやウイルス遺伝子を導入することで、無限に増殖できるようになった培養細胞。ヒトのがん細胞も同様に無限に増殖することから、不死化細胞として扱われる。基礎生命科学、医学、創薬をはじめさまざまな領域で研究材料として多大な貢献を果たしてきた一方で、染色体異常や遺伝子変異を持つなど、正常なヒト細胞の状態を必ずしも反映しない場合がある。
6.複合ヘテロ接合型変異
ある対立遺伝子(アレル)において、2種類の変異が存在する場合を複合ヘテロ接合型変異という。例えば、ある患者が変異型アレル1と変異型アレル2の2種のアレルを持つ場合、複合ヘテロ接合型変異となる。一方で、変異型アレル1のみ(あるいは2のみ)しか持たない場合はホモ接合型変異、野生型と変異型アレルを持つ場合はヘテロ接合型変異と呼ばれる。
7.セルロプラスミン(Cp)
肝臓で産生されるタンパク質で、肝内で銅と結合した後、血液に分泌されて銅の搬送タンパク質として働く。血中の銅の大半はセルロプラスミンと結合して存在している。また、セルロプラスミンは鉄を酸化する活性を持ち、鉄の酸化還元を調節することで鉄の搬送やヘモグロビン合成に関与する。
8.トランスゴルジ体(ゴルジ体トランス面)
ゴルジ体は細胞内小器官の一つで、扁平な袋状の構造をしている。小胞体で作られたタンパク質を修飾し、輸送する役割を持っている。小胞体で作られたタンパク質を受け取る面をシス面、反対側のタンパク質を分泌する面をトランス面と呼ぶ。
9.トランスクリプトーム解析
細胞で転写(発現)されたすべてのメッセンジャーRNA「トランスクリプトーム」を網羅的に解析する方法。この解析により、解析対象がどのような細胞種であるのか、遺伝子発現にどのような特徴があるのかなどを捉えられる。
10.活性酸素、酸化ストレス
活性酸素は、酸素を消費する過程で発生する副産物である。生体内で活性酸素が多く産生されると、他のさまざまな分子を酸化して、その機能を損なう。そのため、細胞が傷つく「酸化ストレス」を受けることになる。
共同研究グループ
理化学研究所 バイオリソース研究センター
iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(ハヤシ・ヨウヘイ)
(筑波大学 医学医療系 教授[連携大学院]、筑波大学グローバル教育院 ライフイノベーション学位プログラム 准教授[協働大学院])
研修生(研究当時) 宋 丹(Dang Song)
(筑波大学大学院 人間総合科学研究科 博士課程(研究当時))
開発研究員 髙﨑 真美(タカサキ・マミ)
テクニカルスタッフ(研究当時) 安 瑜利(アン・ユリ)
テクニカルスタッフ 辺見 康子(ヘンミ・ヤスコ)
研修生(研究当時) 髙見 美帆(タカミ・ミホ)
(現筑波大学大学院 人間総合科学研究科 修士課程)
研修生(研究当時) 李 景玥(Jingyue Li)
(現筑波大学大学院 人間総合科学研究科 修士課程)
細胞材料開発室
室長 中村 幸夫(ナカムラ・ユキオ)
上級技師 野口 道也(ノグチ・ミチヤ)
専任技師 藤岡 剛(フジオカ・ツヨシ)
テクニカルスタッフ(研究当時) 三原田 なつみ(ミハラダ・ナツミ)
東京都医学総合研究所 再生医療プロジェクト
プロジェクトリーダー 宮岡 佑一郎(ミヤオカ・ユウイチロウ)
研究員 高橋 剛(タカハシ・ゴウ)
筑波大学 医学医療系 消化器外科研究室
教授 小田 竜也(オダ・タツヤ)
准教授(研究当時) 鄭 允文(Yun-WenZheng)
国立病院機構新潟病院
病院長 中島 孝(ナカジマ・タカシ)
京都大学iPS細胞研究所
准教授 齋藤 潤(サイトウ・メグム)
研究支援
本研究は、日本医療研究開発機構(AMED)「疾患特異的iPS細胞樹立促進のための基盤形成」、AMED Interstellar Initiative(研究代表者:宮岡佑一郎、林洋平)、日本学術新興会(JSPS)科学研究費補助金若手研究(A)「染色体異常を伴った疾患特異的iPS細胞を修復する「染色体編集法」の開発(研究代表者:林洋平)」、同基盤研究(B)「医療応用のための非ランダムなゲノム編集技術の開発(研究代表者:宮岡佑一郎)」、同若手研究「遺伝子治療を可能とするCRISPR/Cpf1による正確な欠失変異導入法の確立(研究代表者:高橋剛)」、同挑戦的研究(萌芽)「医療応用を目指すゲノム編集結果の1細胞解析(研究代表者:宮岡佑一郎)」、公益財団法人武田科学振興財団、公益財団法人上原記念生命科学財団、公益財団法人中外創薬科学財団、公益財団法人住友財団、公益財団法人金原一郎財団、公益財団法人内藤記念科学振興財団、公益財団法人小野医学研究財団による支援を受けて行われました。また、宋丹は本研究の実施期間に文部科学省の国費外国人留学生の奨学金を得ていました。
原論文情報
Dan Song, Gou Takahashi, Yun-Wen Zheng, Mami Matsuo-Takasaki, Jingyue Li, Miho Takami, Yuri An, Yasuko Hemmi, Natsumi Miharada, Tsuyoshi Fujioka, Michiya Noguchi, Takashi Nakajima, Megumu K. Saito, Yukio Nakamura, Tatsuya Oda, Yuichiro Miyaoka, and Yohei Hayashi, “Retinoids rescue ceruloplasmin secretion and alleviate oxidative stress in Wilson’s disease-specific hepatocytes”, Human Molecular Genetics, 10.1093/hmg/ddac080
発表者
理化学研究所
バイオリソース研究センター iPS細胞高次特性解析開発チーム
チームリーダー 林 洋平(ハヤシ・ヨウヘイ)
研修生(研究当時) 宋 丹(Dan Song)
(現筑波大学大学院 人間総合科学研究科 博士課程)(研究当時)
東京都医学総合研究所 再生医療プロジェクト
プロジェクトリーダー 宮岡 佑一郎(ミヤオカ・ユウイチロウ)
研究員 高橋 剛(タカハシ・ゴウ)
報道担当
理化学研究所 広報室 報道担当
東京都医学総合研究所 事務局研究推進課
筑波大学 広報局