脳の進化や腫瘍形成の謎を解明する足掛かり
2021-06-04 国立精神・神経医療研究センター
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所、病態生化学研究部の星野幹雄部長・宮下聡研究員の研究グループは、未分化状態で細胞分裂を繰り返す神経前駆細胞・幹細胞が、いかにして細胞分裂を停止し神経細胞へと最終分化するのかについての、新しいメカニズムを発見しました。
脳は、その発達段階において、神経前駆細胞(あるいは神経幹細胞)が増殖を繰り返し、神経細胞を生み出すことによって、作り出されます。神経前駆細胞が「未分化(未成熟)」かつ「増殖性」の細胞であるのに対して、神経細胞は「分化し」かつ「増殖性を失った」細胞です。しかしながら、脳の発達過程において、これらの「未分化性」と「増殖性」を同時並行的に協調制御するメカニズムについては、あまり解明されていませんでした。
星野・宮下らの研究グループは、発達段階で爆発的に増殖する神経前駆細胞である小脳の顆粒細胞前駆細胞に着目し、この神経前駆細胞が、脳発達の過程でいかにして「未分化性」と「増殖性」を協調的に失い、神経細胞である顆粒細胞へと分化するのかについて研究しました。まずはビッグデータ解析とマウス脳を使った実験により、顆粒細胞前駆細胞が、段階的に「未分化性」と「増殖性」を失い、最終的に顆粒細胞へと神経分化することを見出しました。さらにこの段階的変化において、細胞増殖を活性化させることが知られていたCCND1(サイクリンD1)が、リン酸化を介してATOH1タンパク質を安定化させ、その結果として前駆細胞の未分化性を維持させることが明らかになりました。また、脳の発生とともに増加するWNTタンパク質とそれによって発現誘導されるPROX1分子によって、徐々にCCND1分子の量が減少し、それによって神経細胞発生が加速されるということも明らかにされました。以上の発見は、単一分子CCND1によって増殖性と未分化性の両者が協調的に制御されること、そして小脳発達過程におけるCCND1の量の制御によって神経細胞分化のスピードが協調的に制御されることを意味しています。
今回の成果は、これまで謎だった神経前駆細胞の「未分化性」と「増殖性」を同時かつ協調的に制御する分子メカニズムを発見したという点で、神経科学に大きな貢献を果たしたと言えます。さらに、この研究は神経細胞の数や増殖性の制御の理解につながるものであり、進化過程での脳拡大メカニズムや、脳腫瘍の形成機構の解明にも繋がることが期待されます。
本研究成果は日本時間 2021 年 5月31日に、欧州の学術雑誌「The EMBO Journal 」に掲載されました。
研究の背景
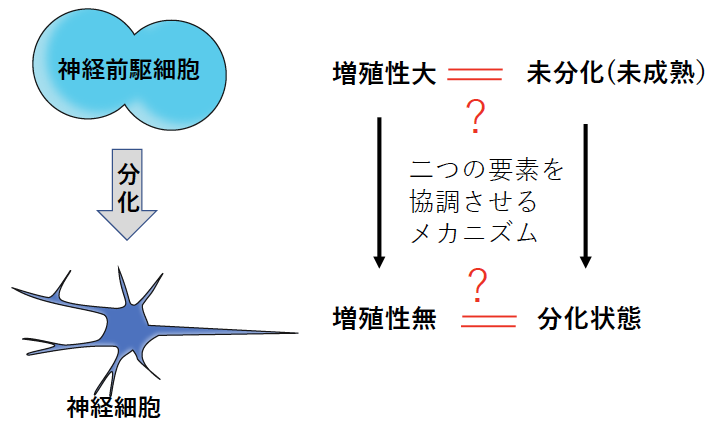
脳は、その発達段階において、神経前駆細胞(あるいは神経幹細胞)が増殖を繰り返し、神経細胞を生み出すことによって、作り出されます。神経前駆細胞が「未分化(未成熟)」かつ「増殖性」の細胞であるのに対して、神経細胞は「分化し」かつ「増殖性を失った」細胞です。しかしながら、脳の発達過程においてこれらの「未分化性」と「増殖性」を同時並行的に一致させて制御するメカニズムはよくわかっていませんでした(図1)。
【図1】神経細胞発生における未解決問題:細胞増殖性と未分化性の協調制御機構
星野・宮下らの研究グループは、この未解決の問題にアプローチするために、小脳をモデル系として用いて研究しました。小脳の顆粒細胞(1)は、中枢神経系に存在する全神経細胞のうち、50%以上を占めるほど多数存在する興奮性の神経細胞です。この神経細胞は、増殖性かつ未分化状態の顆粒細胞前駆細胞という神経前駆細胞から生み出されます。この前駆細胞は、増殖性が極端に上昇するとガン化する一方で、増殖が不十分だと小脳機能不全の原因となります。つまり小脳が正常に機能するためには、顆粒細胞前駆細胞の「未分化性」と「増殖性」が正しく制御され、顆粒細胞が適切な数だけ生み出されることが必要です。
星野・宮下らの研究グループは、これまで小脳の顆粒細胞前駆細胞の増殖と分化についての研究を重ね、細胞分裂面の角度と神経細胞発生との関連や、がん関連分子MEIS1やタンパク質分解系分子群が小脳顆粒細胞発生に果たす役割などについて明らかにしてきました。こうした過去の成果を土台とすることによって、小脳をモデル系として、神経前駆細胞から神経細胞へと分化する際の、増殖性と未分化性の協調制御機構を研究することとしました。
研究の概要
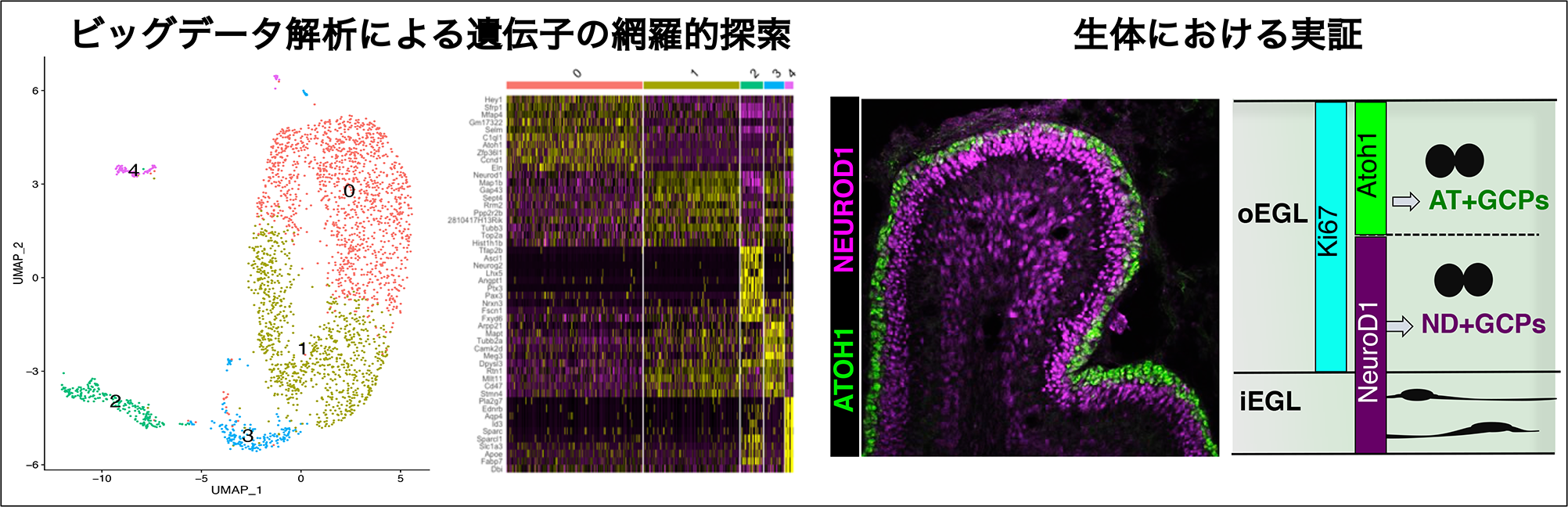
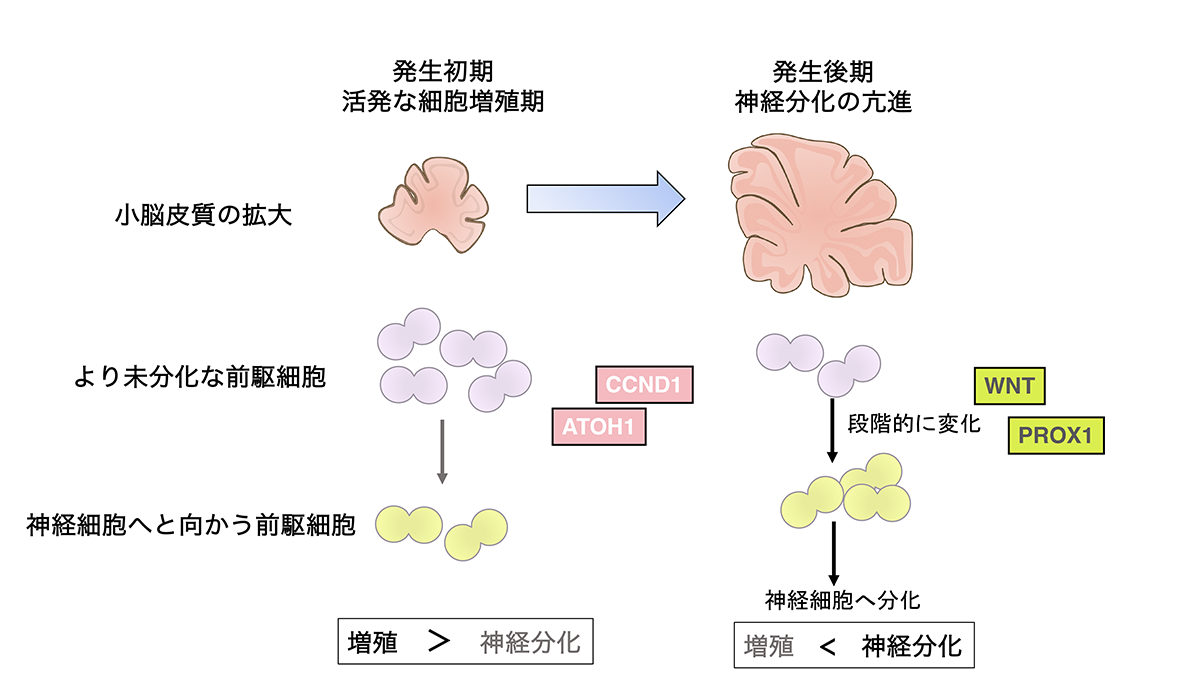
マウスの小脳において顆粒細胞(という名の神経細胞)は、生後2-3週間の間に顆粒細胞前駆細胞から生み出されます。研究グループは、シングルセルRNAseq(2)データを活用したビッグデータ解析を行いました。そして、そこから得られた結果を、マウスにおいて検証することによって、顆粒細胞前駆細胞が、最初は「活発に増殖を行うより未分化な前駆細胞(AT+GCPs)」として存在するが、徐々に「分化した神経細胞へと向かう途中段階の前駆細胞(ND+GCPs)」へと状態が変化させ、その後に神経細胞へと分化するということがわかりました(図2)。このように、段階的に「未分化性」と「増殖性」を変化させることによって、過不足なく、適切な数の顆粒細胞が生み出されると考えられます。
【図2】顆粒細胞前駆細胞の段階的発生(シングルセルRNA解析と生体内解析による)
次に研究グループは、顆粒細胞前駆細胞について、これまでに未分化性の維持に関わることが知られていた転写因子ATOH1(3)と、細胞増殖を促進することが知られていた細胞周期関連分子CyclinD1(CCND1)(4)について着目しました。そこで、発達途上のマウス小脳の顆粒細胞前駆細胞に対して遺伝子導入し、これらの分子の働きを強めたり弱めたりする実験を行ったところ、ATOH1やCCND1が「活発に増殖を行うより未分化な前駆細胞(AT+GCPs)」としての性質の維持に必要とされることが明らかになりました。
さらに、培養細胞を用いた実験により、CCND1がCDK4というリン酸化酵素と共役することによってATOH1タンパクをリン酸化することで(309番目のセリン残基)、ATOH1タンパクを安定化させることも見出しました。もともとCCND1は「増殖性」の促進に働くことが知られていましたが、この研究結果は、このタンパク質がATOH1タンパク質の安定化を介して「未分化性」の維持にも働くということを示しています。つまり、CCND1という一つのタンパク質の量をコントロールするだけで、神経前駆細胞の中で「未分化性」と「増殖性」を協調して制御できる、ということが明らかになりました(図3、左)。
小脳の発達過程では、初期には多くの顆粒細胞前駆細胞が「未分化性」と「増殖性」を保ちつつも少数の顆粒細胞を生み出すのですが、小脳の発生が進むと、顆粒細胞前駆細胞は徐々にその増殖性と未分化性を失い、神経細胞へと分化する確率が増えることが知られています。研究グループは、発生が進むにつれてCCND1のタンパク質量が徐々に減少することを見出しました。また遺伝子導入実験から、発達過程におけるCCND1の量の減少が顆粒細胞前駆細胞から神経細胞への分化の促進の原因となることが示唆されました。
【図3】未分化性と増殖性を協調制御する分子ネットワーク
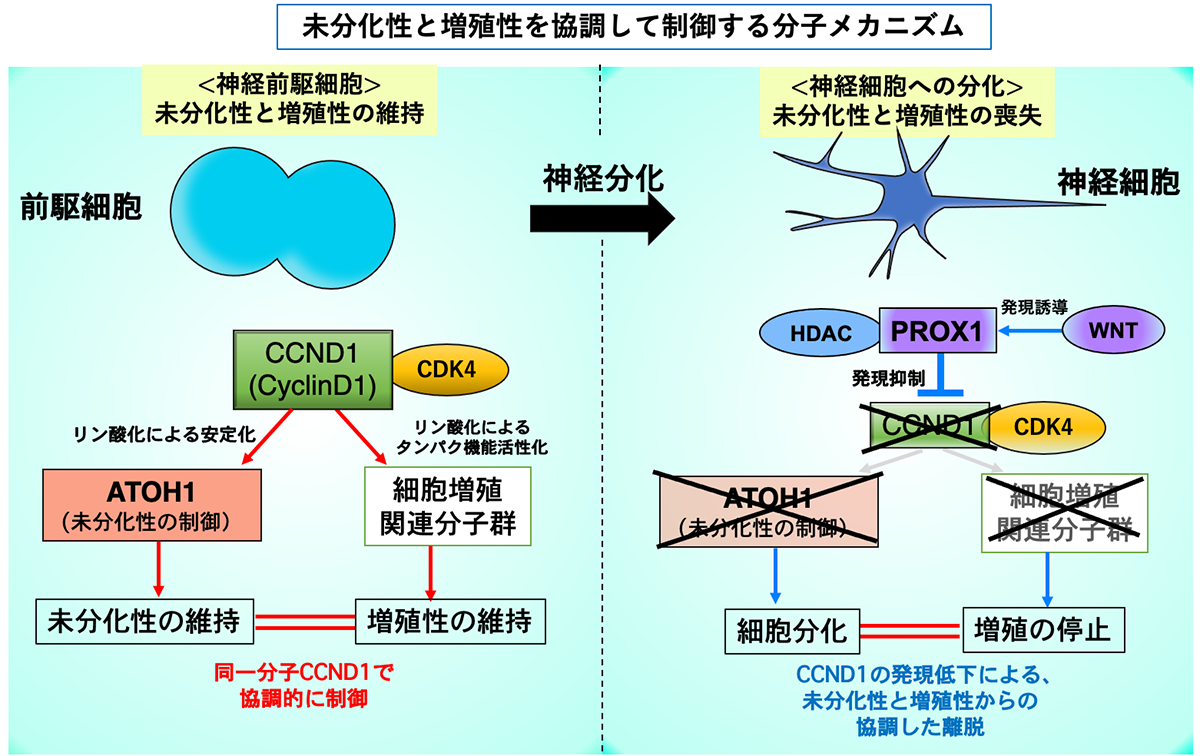
それでは、このCCND1タンパク質の量はどのように制御されているのでしょうか。研究グループは、様々な発生現象に関わるWNTシグナルが小脳発生の初期では小脳全体で低いものの、発生の後期になるに従って小脳全体で上昇していくことを見出しました。また、小脳顆粒細胞前駆細胞では、WNTシグナルの上昇によって転写因子PROX1の発現も上昇すること、さらに、上昇したPROX1がCCND1の発現抑制に働くことを見出しました(図3、右)。
すなわち、小脳顆粒細胞前駆細胞においては、CCND1という単一分子が「未分化性」と「増殖性」をコントロールすることによって、この両者を協調して同じ方向へ向かわせることに寄与していることになります。一部の例外を除いて、一般的に神経前駆細胞から神経細胞へと分化する時にはこの二つの性質が協調して動くことが知られているため、もしかすると同様なメカニズムが他の脳領域の発達にも関係しているのかもしれません。また、細胞外からのシグナルであるWNTシグナルがより上位でCCND1の量のコントロールをしていることも明らかにされました。このことは、今回見出した分子ネットワークが、ひとつひとつの細胞の中での「未分化性」と「増殖性」を制御しているだけではなく、細胞全体のシステムとして細胞増殖に比重をおくか、それとも神経分化にするかというバランスの決定にも寄与していると考えられます(図3,4)。
【図4】小脳の発達と顆粒細胞の分化
今後の展望
以上のように、本研究では、顆粒細胞の(1)新しい発生メカニズムと(2)その分子基盤に関して新しい知見を多く見出すことができました。これらの成果は、顆粒細胞の発生機構だけではなく、進化的な小脳皮質の拡大機構や顆粒細胞のガン化のメカニズムに関しても多くの示唆に富んでいます。
また、今回注目している分子や発生メカニズムは小脳にとどまりません。大脳皮質をはじめとする各脳領域で、これらの分子や発生メカニズムは共通しているため、小脳の研究が、脳全体の共通原理の創出につながっていくことが、今後大いに期待されます。
用語の説明
(1)顆粒細胞
小脳皮質に存在する主たる興奮性の神経細胞であり、中枢神経系の全神経細胞数の大部分を占めるほど多数存在する細胞である。マウスにおいては、そのほとんどが出生後に生み出されることが知られている。興味深いことに、進化の過程で、その数が爆発的に増大したことが知られている。また、顆粒細胞の過剰な増殖が小児脳腫瘍である小脳髄芽腫の原因となることが報告されている。発生・進化・腫瘍化の多くの研究への優れたモデル系として今後さらなる解析がなされることが期待される。
(2)シングルセルRNAseq
組織内に存在する個々の細胞における全遺伝子発現情報を網羅的に調べる手法およびそれにより得られたデータ。
(3) 転写因子ATOH1
bHLH型の転写因子であり、小脳の興奮性の神経細胞の発生における最重要遺伝子のひとつである。小脳以外にも脊髄や耳の発生に関わっていることが知られている。ATOH1タンパクはリン酸化によって安定性が制御されている場合が多い。
(4)細胞周期関連遺伝子CyclinD1(Ccnd1)
細胞周期を制御するサイクリンファミリーのひとつであり、リン酸化酵素のCDK4またはCDK6と共に働き、細胞周期のG1期からS期への進行を正に制御することが知られている。
原著論文情報
・著者:Satoshi Miyashita , Tomoo Owa , Yusuke Seto , Mariko Yamashita , Shogo Aida , Masaki Sone , Kentaro Ichijo , Kozo Kaibuchi , Tomoki Nishioka , Yoshiya Kawaguchi , Shinichiro Taya , Mikio Hoshino.
・論文名:Cyclin D1 controls development of cerebellar granule cell progenitors through phosphorylation and stabilization of ATOH1
・掲載誌:The EMBO Journal, e105712, 2021
・doi: 10.15252/embj.2020105712
・https://doi.org/10.15252/embj.2020105712
研究経費
本研究結果は、以下の日本学術振興会・科学研究費補助金、日本医療研究開発機構 「脳科学研究戦略推進フロクラム」および国立精神・神経医療研究センター精神・神経疾患研究開発費の支援を受けて行われました。
お問い合わせ先
【研究に関するお問い合わせ】
国立精神・神経医療研究センター 神経研究所 病態生化学研究部
星野幹雄(ほしの みきお)
【報道に関するお問い合わせ】
国立精神・神経医療研究センター 総務課広報係