2023-07-10 東京工業大学
要点
- 卵巣がん細胞外小胞(EV)の詳細なタンパク質情報、さらにはその多様性を解明
- 卵巣がんEVが特異的に搭載するバイオマーカータンパク質を発見
- EVを簡便に回収するナノ流体デバイス、ポリケトン鎖修飾ナノワイヤの開発に成功
- 卵巣がん診療を改善する新しいバイオマーカーとして期待
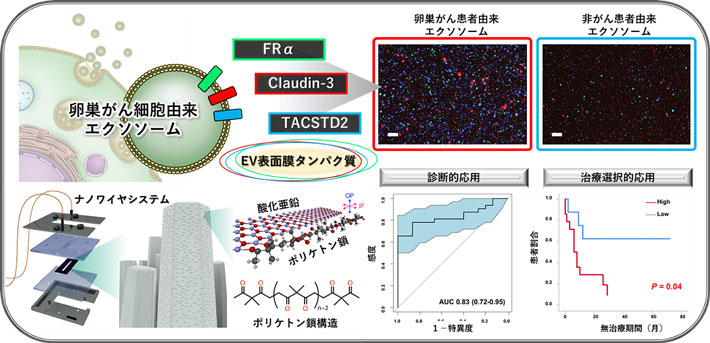
卵巣がんエクソソームに特異的に存在する3つのタンパク質を同定。ポリケトン鎖を修飾したナノワイヤにて回収したエクソソームに対し同分子を解析することで、がんの診断や、その後の治療経過を予測できること(右下図)が明らかになり、治療選択に貢献するバイオマーカーとして期待される。
概要
名古屋大学 医学部附属病院 産科婦人科(同大学高等研究院兼務)の横井暁病院講師、名古屋大学 大学院医学系研究科 産婦人科学の鵜飼真由医師(現トヨタ記念病院産婦人科医長)、梶山広明教授、東京工業大学 生命理工学院 生命理工学系の安井隆雄教授、北海道大学 大学院工学研究院(同大学創成研究機構化学反応創成研究拠点 WPI-ICReDD)の猪熊泰英教授、国立がん研究センター 研究所 病態情報学ユニットの山本雄介ユニット長、慶應義塾大学 薬学部 薬物治療学講座の松崎潤太郎准教授、東京医科大学 医学総合研究所の落谷孝広特任教授らの研究グループは、卵巣がんエクソソーム[用語1]における特異的な膜タンパク質[用語2]を網羅的プロテオミクス[用語3]により新しく同定し、かつ、エクソソーム分離方法としてポリケトン鎖[用語4]修飾ナノワイヤを開発しました。これらの結果は、卵巣がんの診断や治療経過予測に関する新しいバイオマーカー[用語5]として期待されます。
エクソソームを含む細胞外小胞(EV)[用語6]は、ヒトのあらゆる体液中に存在し、細胞間コミュニケーションに不可欠なツールとして注目されています。また、疾患に応じて搭載する分子に変化が生じるため、有望な疾患バイオマーカーとして期待されています。EVにおいて、表面に存在する膜タンパク質は、特定のEVを検出するのに、またそれ自体がバイオマーカーとして利用できるため極めて重要ですが、卵巣がんにおける特異的なEV膜タンパク質は分かっておらず、大きな課題となっていました。卵巣がんは予後の悪い女性生殖器悪性腫瘍であり、世界の女性のがん死亡原因の主要な1つとなっています。卵巣がんは早期発見が極めて困難ながんの1つであり、高精度高感度なバイオマーカーの開発が急務となっていました。本研究では、卵巣がんにおけるEVを対象に、詳細なタンパク質量解析を行うことで、卵巣がんEV関連膜タンパク質である、FRα、Claudin-3、TACSTD2を同定しました。また、EVを捕捉する手段の1つであるナノワイヤ[用語7]を応用し、ナノワイヤをポリケトン鎖修飾することでEV結合性を高め、より純度の高いEVを捕捉することを可能にしました。これらの知見を組み合わせた方法を用いることで、卵巣がん患者におけるEVを利用した新しい検出方法を開発しました。これらの研究結果は、卵巣がんに対する新しいバイオマーカーとして期待されます。
本研究は主に、国立研究開発法人科学技術振興機構(JST)の創発的研究支援事業:研究課題名『がん細胞外小胞の臨床応用へ向けた基盤技術開発研究』 (JPMJFR204J)、『「中分子ひも」を鍵とする巨大機能性分子の創成』(JPMJFR211H)、戦略的創造研究推進事業さきがけ『細胞外小胞の網羅的捕捉と機械的解析によるmiRNA分泌経路の解明』(JPMJPR19H9)、および国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業:研究課題名『卵巣がんゲノム搭載細胞外小胞による新規リキッドバイオプシー戦略』の支援を受け行ったもので、本研究成果は、学術雑誌「Science Advances」の電子版(2023年7月7日付)に掲載されました。
背景
卵巣がんは本邦では年間約1万3,000人が罹患し、その約半数が命を落とす大変予後の悪いがんです。早期スクリーニングが困難なため、ほとんどの症例が進行期で診断され、5年生存率は45%以下と言われています。そのため、早期発見がとても重要になりますが、現状、有効なスクリーニング方法は十分ではありませんでした。卵巣がんは様々な種類がありますが、本研究ではもっとも頻度の高い高悪性度漿(しょう)液性(えきせい)がん(HGSC)を対象としました。これまでHGSCに特異的で感度の高いバイオマーカーや、さらに、細胞外小胞(EV)に関連した膜タンパク質についてはほとんど分かっていませんでした。
エクソソームをはじめとするEVは、古くからヒトの体液中に存在することが知られており、近年、細胞間コミュニケーションに不可欠なツールとして医学生物学分野においてその価値がますます高まっていました。EVに含まれる様々な生理活性物質の中でも、膜タンパク質は、応用性に富んだ重要なターゲット分子です。また近年、体液中のEVの不均一性の理解も重要視されており、詳細かつ精巧なEVプロテオミクスの評価は、この分野の大きな課題でした。また、臨床バイオマーカーとして実用化されるためには、EV上の疾患関連分子の同定、EVの不均一性の理解の2点に加えて、EV捕捉法の簡便化の実現という点も重要な課題として挙げられます。その点において、EV回収方法の技術革新へ向けたテクノロジーの応用が強く期待されていました。
研究成果
本研究グループでは卵巣がん細胞や非がん細胞、卵巣がん患者さんの血液や腹水から、200 nm以下の小さなEV(small EV)であるエクソソームと、それ以上の大きなEV(medium/large EV: m/lEV)を同時に抽出し、液体クロマトグラフ質量分析計(LC-MS/MS)を用いて、網羅的にタンパク質を解析しました。その結果、エクソソームとm/lEVで明らかに異なる分子を搭載していることが明らかになりました。さらに、検証の結果、エクソソームはm/lEVよりもバイオマーカーの標的として適していることがわかりました。その結果、エクソソームにおいて、HGSCに強く関連する膜タンパク質である、FRα、Claudin-3、TACSTD2が同定されました。エクソソームの捕捉について、ポリケトン鎖修飾ナノワイヤ(polyketone nanowire: pNW)を開発し、pNWが、血清や腹水からエクソソームを簡単な手順で分離できることを明らかにしました。本研究グループのpNWを用いた卵巣がん患者エクソソーム解析の結果では、同定した3つのタンパク質がそれぞれ、HGSCを対象としたバイオマーカーとして有用であることが示されました。
今後の展開
本研究では、前述のバイオマーカーとしてのEV実用化に対する課題である(1)EV上の疾患関連分子の同定、(2)EVの不均一性の理解に加えて、(3)EV捕捉法の簡便化のそれぞれにつき一定の回答を提示することができました。本研究成果は、エクソソームをはじめとするEVの更なる理解、卵巣がん疾患成立メカニズムの解明、卵巣がんEVの実臨床応用など、分野横断的に広く貢献し得る成果といえます。今後さらなる検討・検証を通した、卵巣がんエクソソームによるバイオマーカーの実現が期待されます。
用語説明
[用語1] エクソソーム : 細胞が分泌する直径 100 nm前後の小さな胞体。細胞の情報を搭載して、細胞外へ放出され、生命に重要な機能を有する。
[用語2] 膜タンパク質 : 細胞または細胞小器官などの生体膜に付着しているタンパク質分子。細胞外小胞の膜に付着している。
[用語3] 網羅的プロテオミクス : タンパク質の種類について、一括して広く解析する方法。
[用語4] ポリケトン鎖 : 炭化水素鎖の上にカルボニル基(C=O)を複数持つ化合物。天然の分子や人工プラスチックなどに類似の構造が多く見られる。
[用語5] バイオマーカー : タンパク質や遺伝子などの分子で、病気の存在や、治療法選択などの指標となるもの。
[用語6] 細胞外小胞(Extracellular vesicles、EV) : 細胞が分泌する直径 40~1,000 nm の小胞体。エクソソームはEVの1つで、主に直径200 nm以下の小さなEVを指す。
[用語7] ナノワイヤ : 数10~100 nmの大きさから構成される一次元の棒状ナノ構造体。
論文情報
掲載誌 :Science Advances
論文タイトル :Identifying high-grade serous ovarian carcinoma-specific extracellular vesicles by polyketone-coated nanowires
著者 :Akira Yokoi*†, Mayu Ukai*, Takao Yasui†, Yasuhide Inokuma, Kim Hyeon-Deuk, Juntaro Matsuzaki, Kosuke Yoshida, Masami Kitagawa, Kunanon Chattrairat, Mikiko Iida, Taisuke Shimada, Yumehiro Manabe, I-Ya Chang, Eri Asano-Inami, Yoshihiro Koya, Akihiro Nawa, Kae Nakamura, Tohru Kiyono, Tomoyasu Kato, Akihiko Hirakawa, Yusuke Yoshioka, Takahiro Ochiya, Takeshi Hasegawa, Yoshinobu Baba, Yusuke Yamamoto, Hiroaki Kajiyama (* Co-first author, † Co- correspondence)
DOI :10.1126/sciadv.ade6958