2018/10/01 神戸大学,理化学研究所,室蘭工業大学,日本医療研究開発機構,科学技術振興機構(JST)
神戸大学 大学院医学研究科の仁田 亮 教授、今崎 剛 特命助教らの研究グループは、理化学研究所 生命機能科学研究センターの白水 美香子 チームリーダー、同放射光科学研究センターの重松 秀樹 研究員、室蘭工業大学の徳楽 清孝 准教授らとの共同研究により、体中のあらゆる細胞の形を制御する微小管結合タンパク質の1つ「MAP4注1)」の詳細な構造を明らかにすることに成功しました。
MAP4はタウファミリータンパク質の1つで、細胞骨格を構成する微小管や分子モーターであるキネシン注2)と複合体を形成します。タウファミリータンパク質を含む複合体の形成が破綻すると、心不全や認知症などさまざまな病態が引き起こされます。しかし分子構造が柔軟に動くために、高分解能で立体構造を解明した報告はこれまでありませんでした。今回研究グループはクライオ電子顕微鏡注3)を用いて、MAP4が微小管やキネシンと形成する複合体の立体構造を解明しました。
本研究成果により、MAP4による微小管の安定化の仕組みや、微小管を介した細胞内物質輸送への作用を分子構造から理解することができました。またこれらの知見が、心不全や認知症など細胞の変形を伴う疾患の病態解明や、新たな治療薬の開発につながる可能性を提示しました。
この研究成果は、2018年10月1日(米国東部時間)に、国際学術雑誌「The Journal of Cell Biology」にオンライン掲載される予定です。
本研究は、日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST) 「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「心筋メカノバイオロジー機構の解明による心不全治療法の開発」(研究開発代表者:小室 一成)、科学技術振興機構(JST) 戦略的創造研究推進事業 (さきがけ) 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」における研究課題「転写メディエーター複合体CDKモジュールの構造機能解析」(研究者:今崎 剛)、文部科学省科研費、武田科学振興財団、持田記念医学薬学振興財団、上原生命科学財団などの支援を受けて行ったものです。
体中のあらゆる細胞は、それぞれの場所で臓器・組織に特有の形へと変化します。例えば、神経細胞は一本または複数の長い突起を作り、神経細胞間の突起と突起で連絡網を作ることで、脳と身体各所を密に連結しています。また、心筋細胞では円柱状の細胞が整列して、筋肉の収縮を効率よく伝える形状になっています。このような細胞特有の形を作るときに、細胞の中でその骨組みとなるタンパク質重合体を細胞骨格といい、その中で一番太いものが微小管と呼ばれています。細胞内で微小管がどのように張り巡らされるかによって細胞の形が変わりますが、それは微小管に結合する複数のタンパク質により制御されています。
それらの中でも古典的微小管結合タンパク質群に分類されるタンパク質として、タウファミリーに属するMAP4やタウが知られています。タウは神経細胞に局在している一方、MAP4は神経細胞以外、例えば心筋や骨格筋など全身の細胞に広く存在しています。MAP4の発現量が過度に増加することは心不全の発症に、またタウが過度にリン酸化を受けることはアルツハイマー型認知症の発症に関連することが報告され、その分子機構の解明が急務でした。タンパク質の立体構造は、その機能を理解する上で重要な情報となります。しかし、タウファミリーに属するタンパク質はフレキシブルな分子構造を持つため、高分解能で立体構造を解明した報告はこれまでありませんでした。
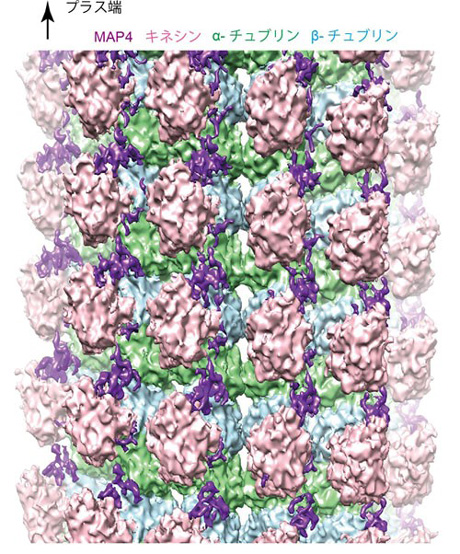
微小管結合タンパク質であるMAP4は、骨格筋細胞や心筋細胞内で微小管の構造を安定化し、心筋細胞の形を決める因子の1つとして機能しています。一方肥大した心筋細胞では、その量が過度に増加し、微小管をレールとして細胞内のさまざまな物質を運んでいる分子モーターであるキネシンの運動を阻害します。それによって心筋細胞の局所で必要な物質の輸送ができなくなり、心筋細胞の形態異常を増悪させます。今回研究グループは、試験管内で微小管、MAP4、キネシンの三者複合体を再構成し、クライオ電子顕微鏡を用いて、その三者複合体の精細な立体構造を7オングストローム分解能で解明しました(図1)。
構造解析の結果、MAP4(紫色)は微小管(αチュブリン、βチュブリン)の長軸に沿って結合して微小管を安定化していました(図1)。MAP4と微小管との結合部位は、両者が強く結合するアンカー部位と弱く結合する弱結合部位の2種類が存在しています(図2左)。一方、分子モーターであるキネシンは、その弱結合部位にあるMAP4と微小管の結合に対して競合阻害の関係にあります(図2中央)。そのため、キネシンが十分量存在すると、キネシンが弱結合部位のMAP4を追い出し、微小管と結合していました(図2中央)。その結果、MAP4と微小管はアンカー部位で結合しつつ、同時にキネシンが弱結合部位で微小管と結合していることが分かりました(図2右)。
さらに詳細に観察すると、MAP4は、微小管とアンカー部位で直接結合するだけでなく、微小管の上方で、キネシンとキネシンの間で折れ重なりコンパクトな構造となることにより、この部分がキネシンと相互作用をしてキネシンをつなぎ留め、キネシンの微小管上の動きを阻害していることが明らかになりました。
以上により、今回のクライオ電子顕微鏡による解析で、MAP4がどのように微小管の構造を安定化し、またどのようにキネシンの物質輸送を阻害するかの構造基盤を解明することができました。
今回の研究成果は、生体内でのMAP4が過度に増加することより発症する心不全・心肥大などの新たな治療戦略を立案する上で重要な示唆を与えるものです。また、MAP4と非常によく似たアミノ酸配列を持つタウも同様の立体構造をとる可能性が高く、認知症などを含めた神経変性疾患の病態解明にもつながる成果です。さらに分解能を向上させて精細な分子構造を観察し、またMAP4および微小管の細胞内の微細形態を解明することによって、心不全や認知症をはじめとする細胞の変形を伴う疾患の細胞レベルの病態解明や創薬への応用につながることが期待されます。
![]()
図1
微小管―MAP4―キネシン複合体のクライオ電子顕微鏡構造。
![]()
図2
微小管―MAP4―キネシン複合体の詳細構造(上段)およびモデル(下段)。詳細は本文参照。
- 注1)MAP4(Microtubule Associated Protein 4)
- タウファミリータンパク質に属し、タウやMAP2とともに古典的微小管結合タンパク質に分類されるタンパク質群。神経細胞以外の全身の細胞に広く発現しており、微小管の安定化に寄与する。
- 注2)キネシン
- 細胞内でタンパク質や核酸・膜小胞などさまざまな物質を能動的に輸送する分子モーター。アデノシン三リン酸(ATP)をエネルギー源として利用し、微小管の上を一方向性に走行する。MAP4やタウは、キネシンの微小管上の運動を阻害することが知られている。
- 注3)クライオ電子顕微鏡
- 核酸やタンパク質などの生体試料を観察するために開発された電子顕微鏡で、2017年のノーベル化学賞はクライオ電子顕微鏡の技術開発を行なった3研究者に贈られた。生体試料を含んだ溶液を薄く展開し、液体エタン(-183℃~-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電子顕微鏡により観察する。試料を固定・染色する方法に比べ、より生理的な条件で観察できること、低温にすることで電子線による試料損傷が軽減されるといった利点がある。
タイトル:“Structural insight into microtubule stabilization and kinesin inhibition by Tau-family MAPs”
著者名:Hideki Shigematsu, Tsuyoshi Imasaki, Chihiro Doki, Takuya Sumi, Mari Aoki, Tomomi Uchikubo-Kamo, Ayako Sakamoto, Kiyotaka Tokuraku, Mikako Shirouzu, Ryo Nitta
DOI:10.1083/jcb.201711182
仁田 亮(ニッタ リョウ)
神戸大学 大学院医学研究科 生体構造解剖学分野 教授
白水 美香子(シロウズ ミカコ)
理化学研究所 生命機能科学研究センター タンパク質機能・構造研究チーム チームリーダー
徳楽 清孝(トクラク キヨタカ)
室蘭工業大学 くらし環境系領域 准教授
日本医療研究開発機構(AMED) 基盤研究事業部 研究企画課
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
神戸大学 総務部 広報課
理化学研究所 広報室 報道担当
室蘭工業大学 総務広報課 広報地域連携係
科学技術振興機構 広報課