2018/10/23 徳島大学,日本医療研究開発機構
徳島大学先端酵素学研究所の丸橋拓海特任助教、岡崎拓教授らの研究グループは、免疫チェックポイント分子であるLAG-3(Lymphocyte Activation Gene-3)による免疫抑制機構を解明しました。PD-1とCTLA-4に続く第3の免疫チェックポイント分子として注目されているLAG-3が、抑制する標的を選別するメカニズムを明らかにしました。今後、自己免疫疾患の新規治療法や新規がん免疫療法の開発につながることが期待されます。本成果は、10月22日付けで英国科学雑誌【Nature Immunology】オンライン版に掲載されます。
概要
徳島大学先端酵素学研究所の丸橋拓海特任助教、岡崎拓教授らの研究グループは、免疫チェックポイント分子[1]であるLAG-3(Lymphocyte Activation Gene-3)による免疫抑制機構を明らかにしました。
先日、本庶佑博士とJames P. Allison博士が免疫チェックポイント分子PD-1およびCTLA-4を介した免疫抑制の阻害によるがん治療法の発見によりノーベル賞を受賞されましたが、LAG-3はPD-1とCTLA-4に次ぐ第3の免疫チェックポイント分子として注目されており、すでに様々な疾患の治療標的として世界中で研究開発が進められています。しかし、LAG-3による免疫抑制のメカニズムはほとんど知られていませんでした。今回、岡崎教授らのグループは、LAG-3に結合することで免疫抑制作用を誘導するリガンド[2]として、ペプチド−MHC class II[3]複合体(pMHCII)を同定し、さらにこの結合がpMHCIIの構造に依存することを見出しました。この特徴的なリガンド認識によって、LAG-3が自己免疫疾患発症に関わるヘルパーT細胞[4]を特異的に抑制していることを明らかにしました。
本研究は、自己免疫疾患発症機構の理解と治療法の開発に貢献するとともに、LAG-3を標的とした効果的ながん免疫療法の開発につながることが期待されます。
本研究成果は、10月22日付けで英国科学雑誌「Nature Immunology」オンライン版に公開されます。
研究の背景
免疫システムの司令塔であるT細胞の活性化は、T細胞受容体を介した抗原刺激に加え、正または負のシグナルを伝達する免疫補助受容体によって厳密に制御されています。このバランスが破綻すると、病原体を排除できなくなる免疫不全や、T細胞が誤って正常な自己組織を攻撃する自己免疫疾患などの重篤な疾患につながります。一方で、一部のがん細胞が抑制性免疫補助受容体(=免疫チェックポイント分子)を利用することでT細胞の活性化を抑制し、免疫系による攻撃を回避していることが知られています。実際に、臨床研究の場においてPD-1とCTLA-4に対する免疫チェックポイント阻害剤が複数のがん種に対して劇的な治療効果を示したことから近年大きな注目を集めています。そのため、他の免疫補助受容体も免疫療法の治療標的として世界中で研究開発が進められておりますが、LAG-3は、PD-1とCTLA-4に次ぐ第3の免疫チェックポイント分子として特に期待されています。
LAG-3は、ヘルパーT細胞の補助受容体であるCD4類縁分子として1990年に同定されました。これまでに岡崎教授らを含むいくつかのグループによって、LAG-3は、活性化T細胞表面に発現すること、リンパ球の活性化を抑制することにより自己免疫疾患の発症を防いでいること、がん免疫を抑制することなどが報告されていました。しかし、LAG-3が実際にどのような免疫応答をどのように抑制するかについては、依然、不明な点が多いのが現状でした。また、LAG-3はCD4よりも高い親和性でMHC classⅡ(MHCII)と結合し、CD4とMHCIIの結合を競合的に阻害することによってT細胞の活性化を抑制すると考えられていましたが、直接的な証明はありませんでした。そこで、本研究ではLAG-3のリガンドの探索と免疫抑制機構の解明を試みました。
研究の成果
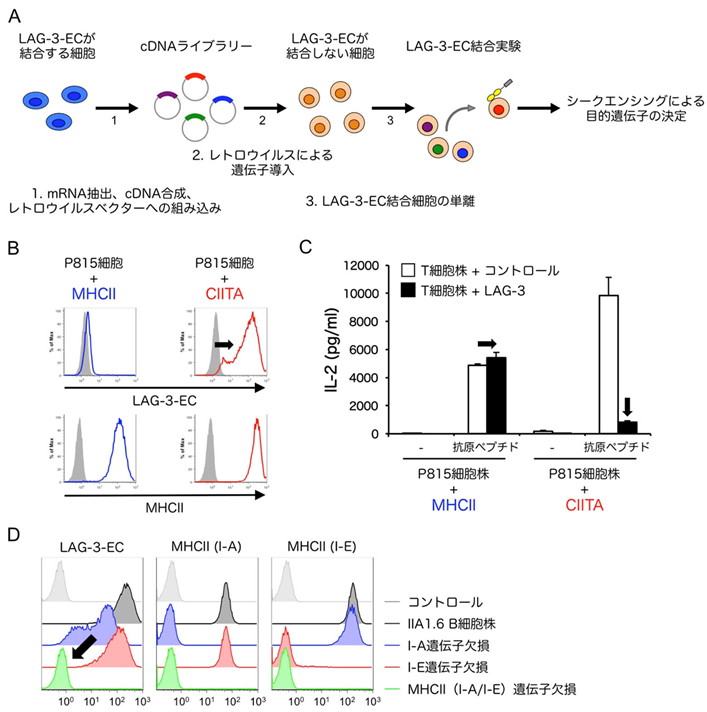
本研究ではまず、LAG-3の細胞外領域を多量体化させた可溶性タンパク質(LAG-3-EC)との結合を指標にした機能発現クローニング法[5]を用いて、LAG-3リガンドの探索を行いました(図1A)。その結果、LAG-3のリガンド発現に重要な遺伝子として、MHC class II trans activator(CIITA)というMHCII遺伝子の発現を司る主要制御因子を同定しました。LAG-3-ECはCIITA遺伝子を導入することで内在性のMHCIIを発現した細胞には結合し、MHCII遺伝子を導入した細胞には結合しませんでした(図1B)。さらに、LAG-3-ECが結合する細胞に抗原提示させることで誘導されるヘルパーT細胞株の活性化はLAG-3によって抑制されますが、LAG-3-ECが結合しない細胞を用いた場合にはその抑制が認められませんでした(図1C)。MHCII遺伝子を欠損させることでLAG-3-ECの結合が無くなったことから、LAG-3がMHCIIに結合することは確認できましたが(図1D)、MHCIIがリガンドとなるためにはCIITAの発現が必要であることが明らかとなりました。
CIITAはMHCII以外にも、CD74やH2-DMといったMHCIIの構造的安定性の管理に関わるいくつかのタンパク質の発現も制御しています。このCD74とH2-DMの遺伝子を欠失させた細胞へのLAG-3-ECの結合が著しく低下したことから、LAG-3は安定な構造を持つMHCIIに選択的に結合することが示唆されました(図2A)。MHCIIの構造は提示する抗原ペプチドとの親和性に大きく影響されることが知られており、実際にMHCIIと複合体を形成させた抗原ペプチドのアミノ酸配列によってLAG-3-ECの結合強度およびLAG-3による抑制強度が変化することが確認できました(図2B)。
I型糖尿病のモデルであるNODマウスにおいて病態発症の原因となる自己抗原のひとつとしてインスリンB鎖の9−23番目のアミノ酸で構成されるペプチドが同定されています。その中でも、13−21番目までの9アミノ酸を介してMHCIIと複合体を形成した場合(pInsB13−21/MHCII)は安定な構造、12−20番目までのアミノ酸を介した場合(pInsB12−20/MHCII)は不安定な構造のpMHCIIとなることが報告されています。上述の実験によって示唆された通り、LAG-3はpInsB13−21/MHCIIを強制発現させた細胞には結合し、pInsB12−20/MHCIIを強制発現させた細胞には結合しませんでした(図3A)。この結果から予想される通り、LAG-3阻害抗体を投与したNODマウスにおいて、pInsB13−21/MHCIIに対するヘルパーT細胞応答が亢進し、一方でpInsB12−20/MHCIIに対する応答は変化しませんでした(図3B)。一般的に、T細胞を産生する器官である胸腺において自己抗原がCIITA依存的に安定な構造を持つpMHCIIとして提示されており、これを認識してしまう自己反応性T細胞は負の選択と呼ばれる仕組みで除去されると考えられています。すなわち、安定な構造を持つpInsB13−21/MHCII反応性のT細胞は本来体内に存在しないはずであり、実際にLAG-3阻害抗体非投与条件では、それらT細胞応答はpInsB12−20/MHCIIに対する応答に比べて弱いことが確認されました(図3)。本研究によって、負の選択は不完全であり、一定数の自己を攻撃しうるT細胞が負の選択を逃れて胸腺外に漏れ出てきており、これらをLAG-3が抑制することによって自己免疫疾患の発症を防いでいることが明らかとなりました。
最後に、LAG-3がどのような作用機序でヘルパーT細胞応答を抑制するのかを検討しました。CD4のMHCIIへの結合をLAG-3がほとんど阻害しなかったことから、LAG-3はCD4との競合阻害とは異なるメカニズムでヘルパーT細胞を抑制することがわかりました(図4A)。LAG-3はT細胞の表面に存在しますが、細胞の外側でリガンドに結合する部分と細胞の内側で働く部分(細胞内領域)に分かれています。LAG-3の細胞内領域を欠失させた変異体が抑制能を失ったことから、LAG-3は細胞内領域を介して能動的に抑制性のシグナル伝達を行うことで抑制能を発揮していることが明らかとなりました(図4B)。
研究成果の意義・今後の展望
本研究によって、LAG-3による免疫抑制機構が明らかとなりました。これは他の免疫チェックポイント分子とは異なり、LAG-3は提示される抗原ペプチドによって多様な構造を持つpMHCIIを構造依存的に認識することでそのpMHCII反応性のヘルパーT細胞を選択的に認識する、つまり多様性の無い単一の分子が免疫系の多様性を制御しうるという点で非常に特徴的である言えます。
本研究は、I型糖尿病を含む自己免疫疾患発症機構の理解と治療法の開発に貢献できると期待されます。さらに、LAG-3を標的とすることによって、既存の免疫チェックポイント阻害剤とは異なる視点の新規がん免疫療法の開発が可能になると考えられます。
論文情報
- 掲載誌:Nature Immunology
- 論文題目:LAG-3 inhibits the activation of CD4+ T cells that recognize stable pMHCII through its conformation-dependent recognition of pMHCII
- 論文著者:Takumi Maruhashi, Il-mi Okazaki, Daisuke Sugiura, Suzuka Takahashi, Takeo K. Maeda, Kenji Shimizu, Taku Okazaki
用語解説
- [1]免疫チェックポイント分子
- 過剰な免疫応答から生体を守るために免疫系にブレーキをかける抑制性の分子のこと。近年、がんが免疫チェックポイント分子を利用することで免疫系からの攻撃を回避していることが明らかになった(2018年ノーベル医学・生理学賞)。代表的なものにPD-1やCTLA-4がある。
- [2]リガンド
- 特定の受容体の特定の結合部位に特異的に結合する物質のこと。一般的に、リガンドが受容体に結合すると細胞へとシグナルが伝達され、遺伝子発現などの応答が起こる。
- [3]MHC class II(MHCII)
- 主要適合組織遺伝子複合体、MHC(major histocompatibility complex)は細胞膜貫通型の糖タンパク質であり、抗原ペプチドを細胞表面に提示する分子である。中でもMHCIIは抗原提示細胞に発現しており、細胞内に取り込まれた後に分解された外来抗原由来のペプチドを、CD4を発現するヘルパーT細胞へと提示し、活性化させる。
- [4]ヘルパーT細胞
- 細胞表面にCD4を発現するT細胞であり、MHCIIとペプチドの複合体を認識することで活性化する。一方で、CD8を発現するT細胞は細胞障害性T細胞と呼ばれ、MHCI−ペプチド複合体を認識することで活性化する。ヘルパーT細胞は活性化に伴ってサイトカインと呼ばれる情報伝達物質を分泌し、B細胞による抗体産生や細胞障害性T細胞の活性化を補助する役割を持つ。
- [5]機能発現クローニング法
- 細胞に導入した遺伝子(多くの場合はcDNA)が発現することで示す機能を指標として、目的の遺伝子を同定する方法。
図
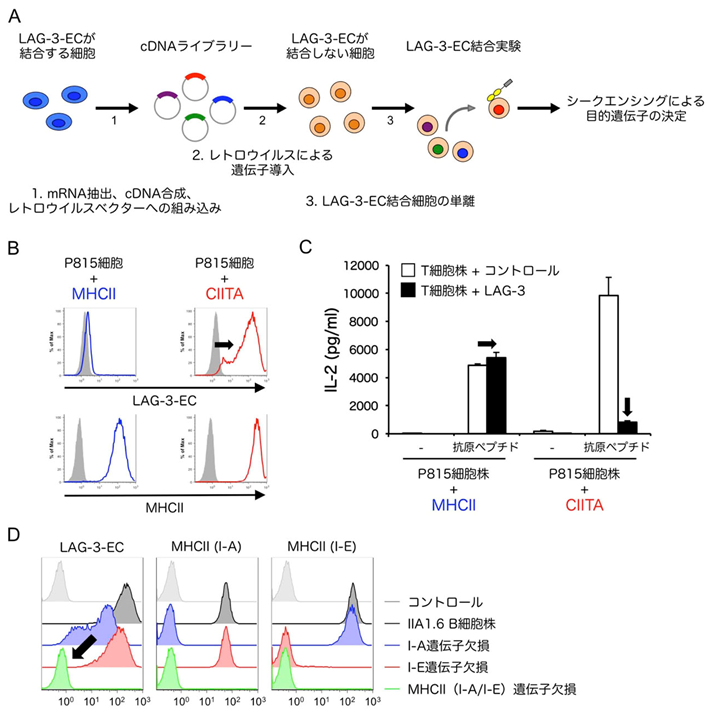
図1:LAG-3はCIITA発現細胞上のMHCIIに選択的に結合する
(A)機能発現スクリーニング法の模式図。
(B)MHCIIまたはCIITA遺伝子を導入した肥満細胞腫株P815細胞におけるMHCII発現とLAG-3-EC結合解析。CIITA遺伝子の導入によって内在性MHCIIの発現が誘導された。どちらの細胞もMHCIIを発現しているにも関わらず、LAG-3の細胞外領域を多量体化した可溶性タンパク質(LAG-3-EC)はCIITAを導入した細胞にのみ結合した(黒矢印)。
(C)LAG-3によるT細胞活性化抑制の評価。(B)で作製した細胞株を抗原提示細胞として用いることでLAG-3を発現させたT細胞株を刺激した。LAG-3-ECが結合するCIITA導入細胞株を用いて刺激した場合にのみ、LAG-3によるIL-2産生の抑制が認められた(黒矢印)。
(D)MHCII欠損細胞株におけるMHCII発現とLAG-3-EC結合解析。MHCII(I-AおよびI-E)の遺伝子を欠失させたIIA1.6 B細胞株にLAG-3-ECは結合しなかった(黒矢印)。
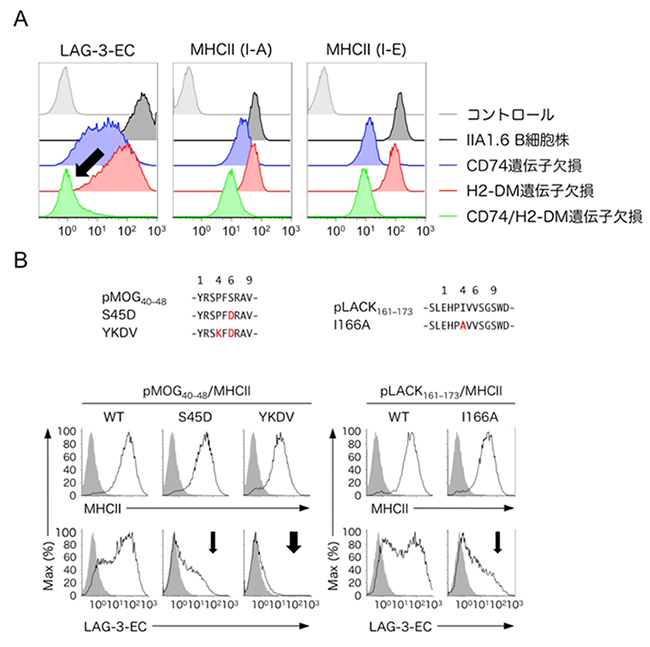
図2:LAG-3はpMHCIIと構造依存的に結合する
(A)CD74およびH2-DM遺伝子欠損細胞株におけるMHCII発現とLAG-3-EC結合解析。CIITAによって発現誘導され、pMHCIIの構造的安定性の管理において重要な分子であるCD74およびH2-DMの遺伝子を欠失させたIIA1.6 B細胞株はLAG-3-ECとの結合が著しく低下した(黒矢印)。
(B)様々なペプチドとMHCIIの複合体を発現させた細胞株におけるMHCII発現とLAG-3-EC結合解析。MHCII との親和性が高いペプチドをMHCIIに提示させると、安定なpMHCII複合体が形成され、LAG-3-ECが強く結合した。一方、MHCIIに提示されるペプチドに、MHCIIとの親和性が低下するようなアミノ酸変異を導入することで、LAG-3-ECの結合強度が大きく低下した(黒矢印)。
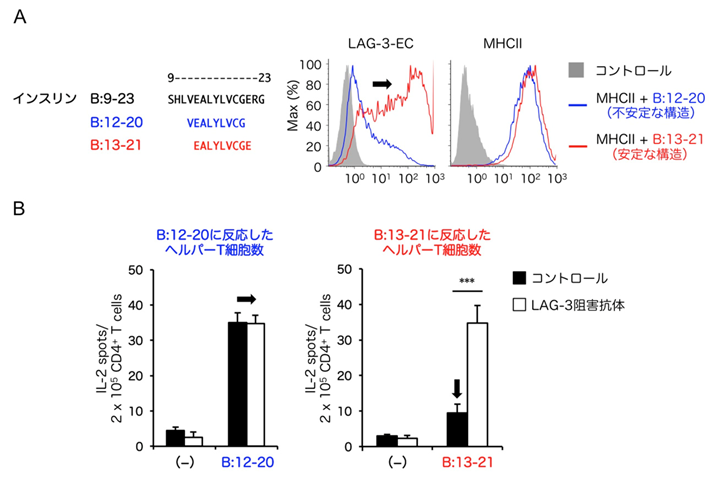
図3:LAG-3は安定な構造を持つ自己抗原ペプチド−MHCII複合体を特異的に認識することで自己反応性ヘルパーT細胞を抑制する
(A)自己抗原ペプチド−MHCII複合体を発現させた細胞株におけるMHCII発現とLAG-3-EC結合解析。インスリンB鎖の9−23番目のアミノ酸で構成されるペプチドはI型糖尿病のモデルであるNODマウスにおける自己抗原のひとつである。LAG-3は、インスリンB鎖の13−21番目までの9アミノ酸を介して安定な複合体を形成したpMHCII(MHCII + B:13–21)に強く結合したが、12−20番目までのアミノ酸を介して不安定な複合体を形成したpMHCII(MHCII + B:12–20)にはほとんど結合しなかった(黒矢印)。
(B)NODマウスの生体内における自己抗原ペプチド反応性ヘルパーT細胞応答およびLAG-3による抑制の評価。NODマウスの生体内において、B:12–20ペプチド反応性ヘルパーT細胞が、B:13–21ペプチド反応性ヘルパーT細胞に比べて、多数検出された。LAG-3阻害抗体投与によって、B:13–21ペプチドに対するヘルパーT細胞応答が亢進した(黒矢印、右)。一方で、B:12–20ペプチドに対する応答に変化は認められなかった(黒矢印、左)。
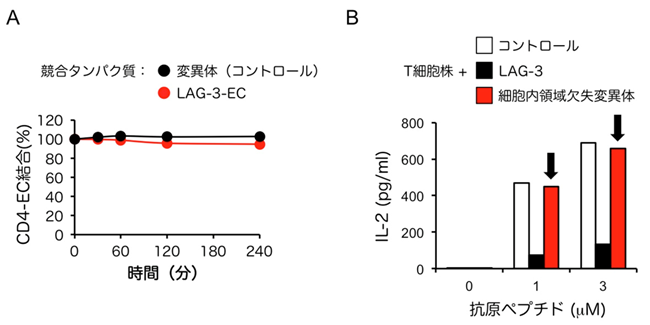
図4:LAG-3は細胞内領域を介してヘルパーT細胞を抑制する
(A)LAG-3-ECによるCD4-ECとMHCII間の結合の競合阻害解析。B細胞株にCD4-ECを十分量結合させた後、LAG-3-ECおよびコントロールとしてMHCII結合能欠失変異体を加え、B細胞株との結合を維持したCD4-ECを経時的に定量した。LAG-3-ECはCD4のMHCIIへの結合を競合阻害しなかった。
(B)細胞内領域を欠失したLAG-3変異体によるT細胞活性化抑制の評価。細胞内領域を欠失させると、LAG-3は抑制能を失った(黒矢印)。
特記事項
本研究は、革新的バイオ医薬品創出基盤技術開発事業「多機能複合分子標的物質の作製による細胞運命操作技術の開発」(文部科学省(2014年度)、日本医療研究開発機構(AMED)(2015年度以降))、戦略的創造研究推進事業CREST(科学技術振興機構)、新学術領域研究「シンギュラリティ生物学」等の支援を受けて行われました。
お問い合わせ先
研究に関するお問い合わせ先
徳島大学 先端酵素学研究所 免疫制御学分野
担当者 岡崎 拓
AMED事業に関するお問い合わせ先
革新的バイオ医薬品創出基盤技術開発事業
日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課