2018/11/3 東京大学,聖マリアンナ医科大学,日本医療研究開発機構
発表者
中西 真(東京大学医科学研究所 癌細胞増殖部門癌防御シグナル分野 教授)
城村 由和(東京大学医科学研究所 癌細胞増殖部門癌防御シグナル分野 助教)
太田 智彦(聖マリアンナ医科大学 大学院医学研究科応用分子腫瘍学 教授)
城村 由和(東京大学医科学研究所 癌細胞増殖部門癌防御シグナル分野 助教)
太田 智彦(聖マリアンナ医科大学 大学院医学研究科応用分子腫瘍学 教授)
発表のポイント
- 比較的予後の良いLuminal A型乳がん患者さんのうち予後の悪い20%程度の症例において、Fbxo22タンパク質の発現が低いことが明らかとなった。これにより予後不良なLuminal A型乳がんを診断できると考えられる。
- これまでLuminal A型乳がんの中で、20%程度の予後不良群を鑑別する有効な方法がなかったが、乳がん細胞検体におけるFbxo22タンパク質の発現を解析することで鑑別可能となった。
- これまでLuminal A型乳がん患者さんのうち、予後不良群を鑑別することが困難であったため、不必要な化学療法が行われたり、あるいは必要な療法が行われなかった患者さんが多数存在した。本研究成果により、Luminal A型乳がんの治療最適化が可能になると考えられる。
発表概要
一般的に、女性ホルモン受容体(エストロゲン受容体)を持ち、かつ増殖因子受容体を持たない乳がんは、乳がん細胞の増殖が女性ホルモンであるエストロゲンに応答していることから、タモキシフェンをはじめとした抗エストロゲン剤(SERM)[1]投与が有効であり、比較的治療効果が高く予後の良い乳がんです。しかし、約20%程度のエストロゲン受容体陽性乳がんは抗エストロゲン剤の効果が低く予後の悪い高リスクな症例で、それを鑑別する方法や、なぜ抗エストロゲン剤が作用しないのかについては全くわかっていませんでした。研究チームはFbxo22[2]という分子が、エストロゲン受容体陽性乳がんに対して抗エストロゲン剤の効果を左右し、予後の決定に重要な役割を果たしていることを明らかにしました。
実際に、乳がん患者さんの生検検体や病理検体を解析したところ、Fbxo22タンパク質の発現が低い乳がんは、抗エストロゲン療法に抵抗性で再発率が高い高リスクな乳がんであることがわかりました。今後、Fbxo22をマーカーとして治療選択を行うための診断法が確立され、このメカニズムを標的とした新たな治療法が開発されることが期待されます。
この研究成果は2018年11月12日、国際学術雑誌「Journal of Clinical Investigation」のオンライン版で公開されます。
実際に、乳がん患者さんの生検検体や病理検体を解析したところ、Fbxo22タンパク質の発現が低い乳がんは、抗エストロゲン療法に抵抗性で再発率が高い高リスクな乳がんであることがわかりました。今後、Fbxo22をマーカーとして治療選択を行うための診断法が確立され、このメカニズムを標的とした新たな治療法が開発されることが期待されます。
この研究成果は2018年11月12日、国際学術雑誌「Journal of Clinical Investigation」のオンライン版で公開されます。
研究の背景
エストロゲン受容体陽性で、その増殖にエストロゲンを必要とするLuminal A[3]と呼ばれるタイプの乳がんは、乳がん全体の約7割を占め、抗エストロゲン療法が効果的で比較的予後良好です。しかし、抗エストロゲン剤の効果が低く手術をしても将来的に再発する高リスク群が、約2割の症例に認められます。これらの高リスク群の症例を再発前に見つけるために決め手となるマーカーは存在せず、高リスクの患者さんが手術の前後に必要な化学治療を受けられないだけではなく、多くの低リスクの患者さんが不必要な化学療法を受けているのが現状です。これらの問題を改善し、乳がん患者さんの最適化医療を目指して、Oncotype DXなどの遺伝子発現解析のアルゴリズムを利用した高リスク群予測マーカーが開発されていますが、その有用性は未だ確立していません。またこれらの検査は高額で、結果を得るまでの所要時間が長く、広く一般的に臨床応用するには多くの問題を抱えています。そのような背景から、安価かつ信頼性の高い診断法の開発が急務となっています。
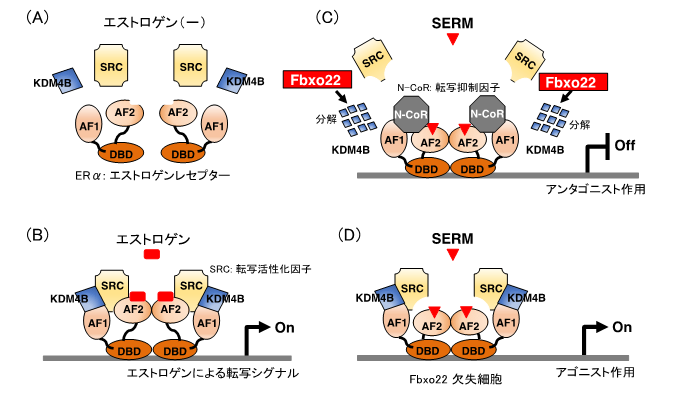
乳がんの抗エストロゲン療法の効果は、エストロゲン受容体と、その活性を調節する複数の因子によって制御されています(図1A)。エストロゲンと結合したエストロゲン受容体は、SRC[4]などの活性化因子と複合体を形成してDNAと結合し、結合周囲の構造を変化させることで、乳がん細胞の増殖に必要となる様々な遺伝子の発現を促進させます(図1B)。一方、抗エストロゲン剤であるタモキシフェンと結合したエストロゲン受容体は、N-CoR[5]などの抑制化因子と結合し、遺伝子の発現を抑制します。しかし、抗エストロゲン剤がどのようなメカニズムでエストロゲン受容体と活性化因子や抑制化因子との結合を制御しているのかについてほとんどわかっていませんでした。
乳がんの抗エストロゲン療法の効果は、エストロゲン受容体と、その活性を調節する複数の因子によって制御されています(図1A)。エストロゲンと結合したエストロゲン受容体は、SRC[4]などの活性化因子と複合体を形成してDNAと結合し、結合周囲の構造を変化させることで、乳がん細胞の増殖に必要となる様々な遺伝子の発現を促進させます(図1B)。一方、抗エストロゲン剤であるタモキシフェンと結合したエストロゲン受容体は、N-CoR[5]などの抑制化因子と結合し、遺伝子の発現を抑制します。しかし、抗エストロゲン剤がどのようなメカニズムでエストロゲン受容体と活性化因子や抑制化因子との結合を制御しているのかについてほとんどわかっていませんでした。
研究の成果と意義・今後の展開
乳がんの治療に用いられるタモキシフェンなどの抗エストロゲン剤が機能し、治療効果を発揮するためには、エストロゲン受容体に結合した活性化因子が解離し、抑制化因子に変換される必要があります。研究チームは、この解離と変換に、エストロゲン受容体に結合したKDM4B[6]と呼ばれるタンパク質がFbxo22によりユビキチン化され、分解されることが必要であることを発見しました(図1C)。エストロゲン受容体には、DNAに結合する領域(DBD)と活性化因子(SRC)や抑制化因子(N-CoR)に結合するAF-1およびAF-2と呼ばれる領域があります。エストロゲンは、AF-2領域と活性化因子との結合を促進します(図1B)。この状態で抗エストロゲン剤(SERM)を加えると、AF-2領域から活性化因子が解離し、さらにAF-1領域と結合していたKDM4BがFbxo22により分解されて活性化因子が完全にエストロゲン受容体から外れ、代わりに抑制化因子が結合します。これによりエストロゲン受容体の活性は完全に消失します(図1C)。しかしFbxo22がないと、抗エストロゲン剤を加えてもAF-1領域を介してエストロゲン受容体と活性化因子が結合したままとなり、エストロゲン受容体の活性は保たれます(図1D)。このため、Fbxo22が欠失した細胞では抗エストロゲン剤を投与してもエストロゲン受容体活性が高いままとなり、がん細胞の増殖が促進することがわかりました(図1D)。
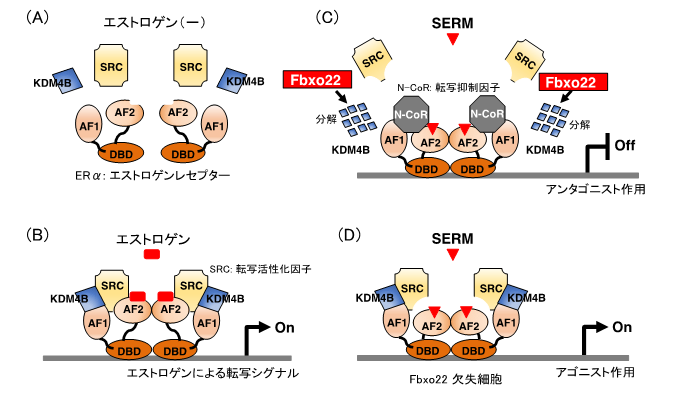
図1.Fbxo22欠失細胞ではSERMはアゴニストとして作用する
マウスにFbxo22欠損乳がん細胞を移植すると、抗エストロゲン剤に反応せず増殖し続けることがわかりました。重要なことに、乳がん患者さんの生検検体や病理検体を用いた解析から、エストロゲン受容体陽性/増殖因子受容体陰性のLuminal A乳がんにおいて、細胞内のFbxo22タンパク質の低下が、乳がんの再発や予後と強く相関することがわかりました(図2)。これまで、Luminal A乳がん患者さんの高リスク群を選別するマーカーとしてKi-67が用いられていましたが、乳がん細胞内のFbxo22タンパク質の解析は、Luminal A乳がん患者さんの高リスク群を選び出すためのマーカーとして、Ki-67を含めた既知のマーカーよりもすぐれていることが示されました。さらにこれらの結果は、異なる施設での臨床研究でも確認されました。
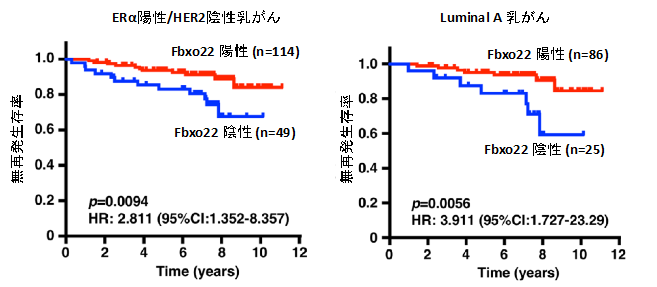
図2.ERα+/HER2- 乳がんにおいてFbxo22陰性群は予後不良である
今後の展開として、本研究で開発したFbxo22に対するモノクロナール抗体を用いた乳がん生検検体の免疫染色法による診断法を確立することにより、Luminal A乳がんの高リスク群患者さんをより適格に鑑別することで、手術前後の抗がん剤療法や抗エストロゲン療法を適切に行うための臨床応用に繋げることが第一の目標です。さらに、今回明らかになったメカニズムを標的にした治療薬の開発も行なっていきます。

図1.Fbxo22欠失細胞ではSERMはアゴニストとして作用する
マウスにFbxo22欠損乳がん細胞を移植すると、抗エストロゲン剤に反応せず増殖し続けることがわかりました。重要なことに、乳がん患者さんの生検検体や病理検体を用いた解析から、エストロゲン受容体陽性/増殖因子受容体陰性のLuminal A乳がんにおいて、細胞内のFbxo22タンパク質の低下が、乳がんの再発や予後と強く相関することがわかりました(図2)。これまで、Luminal A乳がん患者さんの高リスク群を選別するマーカーとしてKi-67が用いられていましたが、乳がん細胞内のFbxo22タンパク質の解析は、Luminal A乳がん患者さんの高リスク群を選び出すためのマーカーとして、Ki-67を含めた既知のマーカーよりもすぐれていることが示されました。さらにこれらの結果は、異なる施設での臨床研究でも確認されました。

図2.ERα+/HER2- 乳がんにおいてFbxo22陰性群は予後不良である
今後の展開として、本研究で開発したFbxo22に対するモノクロナール抗体を用いた乳がん生検検体の免疫染色法による診断法を確立することにより、Luminal A乳がんの高リスク群患者さんをより適格に鑑別することで、手術前後の抗がん剤療法や抗エストロゲン療法を適切に行うための臨床応用に繋げることが第一の目標です。さらに、今回明らかになったメカニズムを標的にした治療薬の開発も行なっていきます。
本研究への支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業「高リスクER陽性乳がんの内分泌療法耐性機序解明に基づく診断法と薬物療法の開発」、「細胞老化制御因子を標的としたがん治療法・予防法の開発」、文部科学省等の支援によって行われました。
論文
- 雑誌名:
- Journal of Clinical Investigation
- タイトル:
- Fbxo22-mediated KDM4B degradation determines selective estrogen receptor modulator activity in breast cancer
- 著者(*責任研究者):
- Yoshikazu Johmura, Ichiro Maeda, Narumi Suzuki, Wenwen Wu, Atsushi Goda, Mariko Morita, Kiyoshi Yamaguchi, Mizuki Yamamoto, Satoi Nagasawa, Yasuyuki Kojima, Koichiro Tsugawa, Natsuko Inoue, Yasuo Miyoshi, Tomo Osako, Futoshi Akiyama, Reo Maruyama, Jun-ichiro Inoue, Yoichi Furukawa, Tomohiko Ohta*, Makoto Nakanishi*
用語解説
- [1]SERM (selective estrogen receptor modifier)
- タモキシフェンに代表されるホルモン療法製剤の総称で、エストロゲン受容体のAF-2領域に選択的に作用する。
- [2]Fbxo22
- F-boxタンパク質の1つ。SKP1, CUL1, F-box, ROC1からなるSCFユビキチンリガーゼ複合体のサブユニットの1つで、標的のタンパク質を認識し、ユビキチンという物質を結合させる。ユビキチンが結合したタンパク質は分解される。本研究で明らかとなったKDM4Bの他にp53を標的とする。
- [3]Luminal A乳がん・エストロゲン受容体陽性/増殖因子受容体(HER2)陰性乳がん
- 乳がんはエストロゲン受容体、プロゲステロン受容体、増殖因子受容体HER2、および細胞増殖のマーカーであるKi-67によって大きく4つに分類される。このうちエストロゲン受容体陽性/増殖因子受容体陰性/Ki-67低値のものがLuminal A乳がんである。
- [4]SRC
- Steroid receptor coactivator;代表的なエストロゲン受容体活性化因子である。
- [5]N-CoR
- Nuclear receptor corepressor;代表的なエストロゲン受容体抑制化因子である。
- [6]KDM4B
- Lysine (K)-specific demethylase 4B;リジン残基の脱メチル化酵素でエストロゲン受容体結合因子。
お問い合わせ先
報道関係からのお問い合わせ先
国立大学法人 東京大学
医科学研究所 癌細胞増殖部門癌防御シグナル分野
教授 中西 真(なかにし まこと)
学校法人 聖マリアンナ医科大学
大学院医学研究科応用分子腫瘍学
教授 太田 智彦(おおた ともひこ)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
次世代がん医療創生研究事業担当