2018-11-15 名古屋市立大学,岐阜大学,日本医療研究開発機構
名古屋市立大学大学院薬学研究科の星野真一教授、細田直講師、野木森拓人(大学院生)は、兵庫県立大学、岐阜大学との共同研究の成果として、mRNA医薬に用いる人工mRNAの細胞内における分解機構の全容を世界に先駆けて解明することに成功しました。この分解を抑えることで、これまで困難とされてきた不安定なmRNA医薬を安定化することを可能にし、夢の新薬『mRNA医薬』の臨床応用実現に向けて可能性を開きました。本研究成果は、英国科学誌『Nucleic Acids Research(ヌクレイック・アシッズ・リサーチ)』電子版に2018年11月5日(英国時間)、(日本時間11月6日)に掲載されました。
本研究成果のポイント
- 遺伝子治療にはDNAの使用が試みられてきたが、DNAは発がんのリスクや、ウイルスベクターを使うことによる感染の危険性があり実現には至っていない。
- mRNA医薬は、DNAと異なりウイルスベクターを使う必要がなく、発がん等の危険性もない安全な遺伝子治療薬として期待が高まっている。
- 一方で、mRNAは細胞内において不安定であることが、mRNA医薬実現に向けて大きな障壁となっていた。
- 本研究では、生体にとっては異物であるmRNA医薬の分解機構の全容を世界に先駆けて解明し、この分解を抑えることで、mRNA医薬を安定化することを可能にした。
- ①遺伝子治療の他、②ウイルス疾患の治療、③がん免疫療法、④iPS細胞の作成、⑤疾患原因因子の補充療法など、広範な疾患に適用される夢の新薬として注目されている『mRNA医薬』の臨床応用実現に道を開いた。
背景
これまで遺伝子治療にはDNAが用いられてきましたが、DNAは生体内DNAへの取り込みによる発がんの危険性や、導入に用いるウイルスベクターによる感染の危険性があり、実用化には至っていません。そこで、DNAに代わって登場してきたのがmRNA(注1)です。mRNAは、遺伝子DNAから作られる生体分子であり、遺伝子DNAの情報を保持していますが、DNAのもつ発がん等の危険性がありません。このmRNAを人工的に合成し、これを『mRNA医薬』(注2)として治療に応用しようという動きが世界的に高まってきています。ところが、「mRNAは生体内において不安定である」ことが、このmRNA医薬の実現に向けて最大の障壁となっていました。これまでの研究では、生体内mRNAの分解機構に基づいて、これを回避するような構造をmRNA上に付与するといった試みが数多く報告されてきましたが、いずれも良好な結果は得られていませんでした。その最大の理由は、外から投与する『mRNA医薬』も、生体内mRNAと同じ分解機構で分解されるという誤った認識に基づいて研究が行われてきた点にあります。
研究成果の内容
研究チームはこれまで、生体内mRNAの分解機構の研究において実績を上げ、2007年に「生体内mRNAの分解機構」を解明しました(図1)。
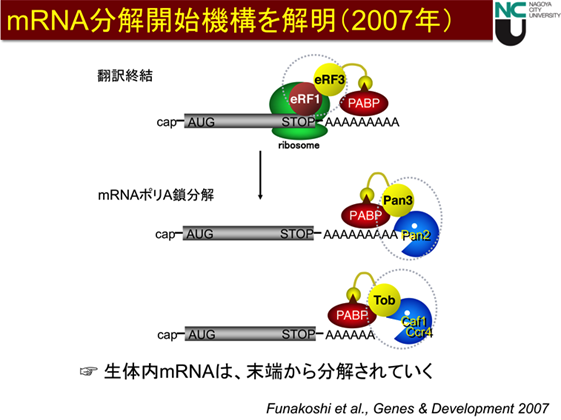
図1 生体内mRNAの分解機構
生体内のmRNAはタンパク質合成装置であるリボソームによって翻訳された後、翻訳因子eRF1-eRF3がmRNAから解離します。それを引き金として、分解酵素Pan2-Pan3とCaf1-Ccr4がmRNA上にリクルートされ、これらの因子によってmRNAが末端からゆっくりと分解されていきます。
この分解機構に基づき、『mRNA医薬』として用いる人工mRNAの分解を調べたところ、生体内mRNAと同じ構造をもつにもかかわらず、人工mRNAは生体内mRNAとは全く異なる分解機構で分解されるという予想外の知見を得ました。生体内mRNAは、線状のRNA分子の末端から分解されていくのに対して、人工mRNAは分子中央で切断され急速に分解されていることをつきとめました。研究チームはこの新たな分解機構の全容を解明し(図2)、mRNAが翻訳(注3)をうけた後分解されていくというメカニズムの共通性がある一方で、生体内mRNAとは異なる特異的な分解因子Dom34, OAS3, RNase Lが分解に関わっていることを証明しました。図2に示すように、まず、人工mRNAが生体内に取り込まれるとオリゴアデニル酸合成酵素OAS3が活性化し、ATPを基質にしてこれを重合した2-5Aという化合物を合成します。この2-5AがRNA分解酵素RNase Lを不活性な単量体から活性型の二量体へと変換します。その一方で、人工mRNAは細胞内においてタンパク質合成装置であるリボソームによって翻訳をうけますが、生体外から入り込んだ人工mRNA上でリボソームが停止し、この停止したリボソームを識別してDom34とよばれる翻訳因子が会合して、ここに活性型RNase Lを呼び込むことで、人工mRNAが急速に分解されます。このような分解機構に基づいて、分解に関わるこれらの因子を阻害剤やノックダウンという手法を用いて阻害することで人工mRNA(mRNA医薬)を細胞内において安定化することにはじめて成功しました。
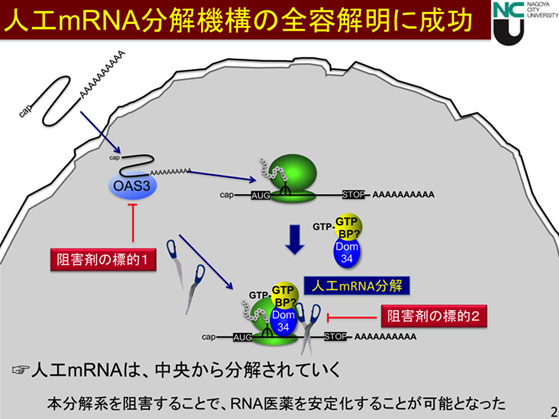
図2 人工mRNA(mRNA医薬)の分解機構
『mRNA医薬』として用いられる人工mRNAは、生体内に取り込まれると生体内mRNAと同様にリボソームによって翻訳をうけますが、翻訳因子Dom34が人工mRNAを外来RNAとして識別します。そして、RNA分解酵素であるRNase Lを呼び込むことで、人工mRNAは分子中央で切断され、急速に分解されていきます。
今後の展開
本研究は、日本医療研究開発機構のB型肝炎創薬実用化等研究事業[個別化医療に対応したゲノム編集技術による肝臓内HBVゲノムの完全不活化を目指した革新的治療法の包括的開発(溝上雅史代表)]において実施したものであり、B型肝炎の治癒を最終的な目標としています。本研究では、B型肝炎の患者の肝臓内に潜伏するB型肝炎ウイルスDNAをゲノム編集(注4)という手法により破壊することで根治することを目指しており、その際投与するゲノム編集遺伝子mRNA医薬の安定化に本技術を応用します。
今回の研究成果により、mRNA医薬の分解に関わる因子を特定し、これを阻害することでmRNA医薬を安定化することが可能となりました。現在、東京大学、名古屋大学、製薬企業との共同研究により、これら因子を標的としてより効率よく分解を抑える阻害薬の開発を進めています。本研究で開発したmRNA安定化技術は、B型肝炎以外のウイルス疾患治療にも広く応用が可能です(図3)。また、山中4因子のmRNAを使って細胞を初期化するiPS細胞の作製や、がん抗原をコードするmRNAを樹状細胞に導入して生体内でワクチンをつくらせるがん免疫療法、疾患原因因子をコードするmRNAを投与しておこなう補充療法など、今後広範な臨床応用に適用されることが期待されます。
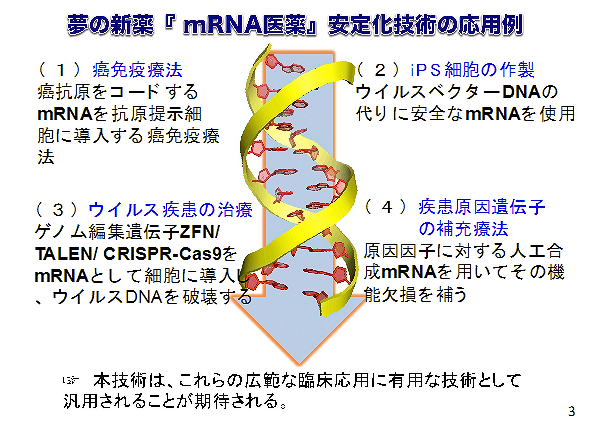
図3 今後の展開
用語解説
- *1 mRNA:
- DNAとよく似た核酸とよばれる生体成分で、生体内において遺伝子DNAがもつ情報が写し取られて作られる。このmRNAをもとにタンパク質が作られることで遺伝子の機能が発揮される。
- *2 mRNA医薬:
- 生体成分であるmRNAを人工的に合成し、これを生体内に投与することで生体にとって好ましいタンパク質を作り出す次世代の薬。
- *3 翻訳:
- mRNAの遺伝情報をもとにタンパク質が作られる反応。
- *4 ゲノム編集:
- DNAを部位特異的に切断する酵素であるヌクレアーゼを用いて、遺伝子を自在に改変する技術。
原著論文
- 掲載誌:
- 英国科学誌『Nucleic Acids Research(ヌクレイック・アシッズ・リサーチ)』
- 論文タイトル:
- Dom34 mediates targeting of exogenous RNA in the antiviral OAS/RNase L pathway(Dom34は抗ウイルスシステムOAS/RNase L経路において外来性RNAを標的化する)
- 著者:
- Takuto Nogimori1, Kyutatsu Nishiura1, Sho Kawashima1, Takahiro Nagai1 Yuka Oishi1, Nao Hosoda1, Hiroaki Imataka2, Yoshiaki Kitamura3, Yukio Kitade3 and Shin-ichi Hoshino1
- 共同研究/協力施設:
- 名古屋市立大学1, 兵庫県立大学2, 岐阜大学3
謝辞
本研究はJSPS科学研究費補助金挑戦的研究(萌芽)(JP17K19357)の助成をうけ、日本医療研究開発機構(AMED)肝炎等克服実用化研究事業「B型肝炎創薬実用化等研究事業:個別化医療に対応したゲノム編集技術による肝臓内HBVゲノムの完全不活化を目指した革新的治療法の包括的開発」(溝上雅史代表)、武田科学振興財団、名古屋市立大学特別研究奨励費の支援により行われました。
お問い合わせ先
研究全般に関するお問い合わせ先
名古屋市立大学大学院薬学研究科
教授 星野 真一
岐阜大学
名誉教授 北出 幸夫
工学部化学・生命工学科
助教 喜多村 徳昭
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 感染症研究課
(肝炎等克服実用化研究事業 担当)