2019-03-12 国立大学法人名古屋大学,国立研究開発法人日本医療研究開発機構
名古屋大学細胞生理学研究センター(CeSPI)/大学院創薬科学研究科の中村 駿研究員、入江 克雅助教、藤吉 好則客員教授らの研究グループは、大阪大学大学院生命機能研究科・医学系研究科の月田 早智子教授らとの共同研究により、皮膚や血液脳関門を形成するなどの生体内でのバリア機能を担うタンパク質として知られているクローディンの一種であるクローディン3の立体構造を原子レベルで明らかにすることに成功しました。これにより、左手のような形をしたクローディンが親指の付け根に存在する一か所のアミノ酸の種類に応じて、バリアの形成に重要である細胞外部分が大きく傾くことを明らかにしました。哺乳動物のクローディンは27種類あり、それぞれが特定の器官において多彩な機能を持つバリアを形成します。親指の付け根のこの位置のアミノ酸の種類は3種類だけであり、このうちのどのアミノ酸かによってバリアの形態が変わることを明らかにしました。
今回明らかになった構造は、クローディンの種類によって異なるバリア機能についての構造生理学的な知見を与えるとともに、特定組織のバリアを経由する新しい薬物送達手法の開発など、幅広い分野に対しての応用が期待されます。
この研究成果は、平成31年2月18日付のNature Communications誌オンライン版に掲載されました。
本研究は、日本学術振興会(JSPS)科学研究費助成事業・基盤研究(S)(課題番号15H05775)、日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォーム(BINDS)ならびに次世代治療・診断実現のための創薬基盤技術開発事業「革新的中分子創薬技術の開発/中分子シミュレーション技術の開発」の支援のもとで行われたものです。
ポイント
- 細胞同士を密着させてバリアを形成するタンパク質の一種であるクローディン3の構造解明に成功した。
- クローディンの細胞膜を貫通する領域に存在するたった一つのアミノ酸の違いが、全体構造を変化させ、多様なバリアの形成に寄与することを明らかにした。
- 特定器官のバリアを経由する新しい薬物送達法の開発などへの応用が期待される。
背景
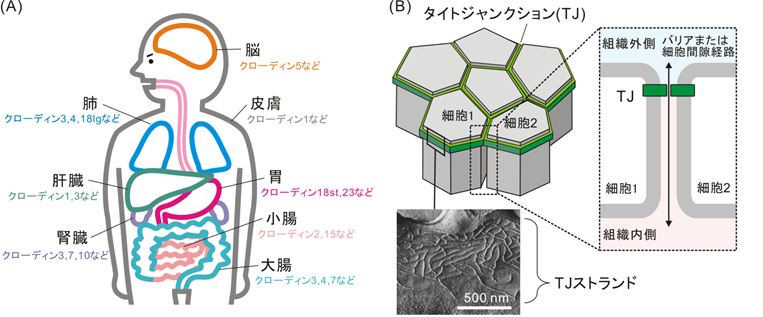
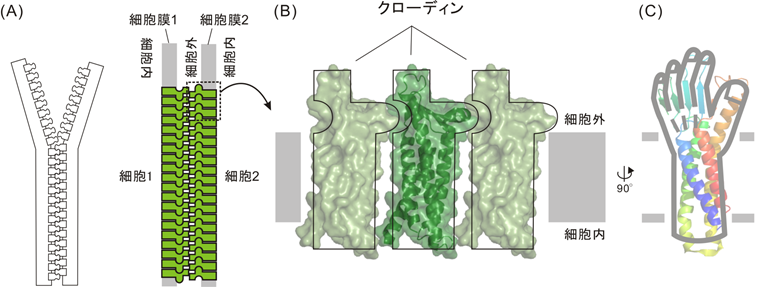
私たちの体には脳や小腸など様々な器官が存在し、バリア機能をもつ細胞の層がそれぞれの器官の表面を覆うことによって、最適な内部環境が維持されています(図1A)。細胞層のバリアは、細胞の周りをベルト状に取り囲むタイトジャンクション1)と呼ばれる接着装置を介して細胞同士が結合することによって作られています。タイトジャンクションはその名のとおり、隣り合う細胞同士をしっかりと結合することによってすき間を埋め、物質の透過を制限します(図1B)。その主要な構成要素はクローディン2)と呼ばれるタンパク質であり、クローディン同士がジッパーのように結合することによってタイトジャンクションを形成しています(図2A)。すなわち、細胞膜上でクローディンが鎖状に連なってジッパーの片側を作るとともに、隣接する細胞膜上に作られたもう一方の鎖と結合することによって、隣り合う細胞膜を密着させています。このとき、細胞膜上での重合は、クローディンの細胞外の領域に存在する凸状の出っ張りが、隣のクローディンの凹状のへこみに嵌まって結合すると考えられています(図2B)。このようにしてクローディンが重合した鎖は、網目状の構造体として細胞膜上に観察されており、タイトジャンクションストランド(TJストランド)と呼ばれています(図1B)。また、クローディンの全体像は、人の左手によく似た形をしており、細胞膜を貫通する部分が肘から手首まで、細胞外の部分が手首から指に相当しています(図2C)。哺乳動物では異なる性質のバリア機能をもつ27種類のクローディンが特定の器官に発現しており(図1A)、直鎖状のTJストランドや曲がりくねったTJストランドなど様々な形態のタイトジャンクションが形成され、器官に最適なバリア機能に関わっています。しかし、TJストランドの様々な形態がどのような要因によって決まるかは、これまでわかっていませんでした。
研究成果
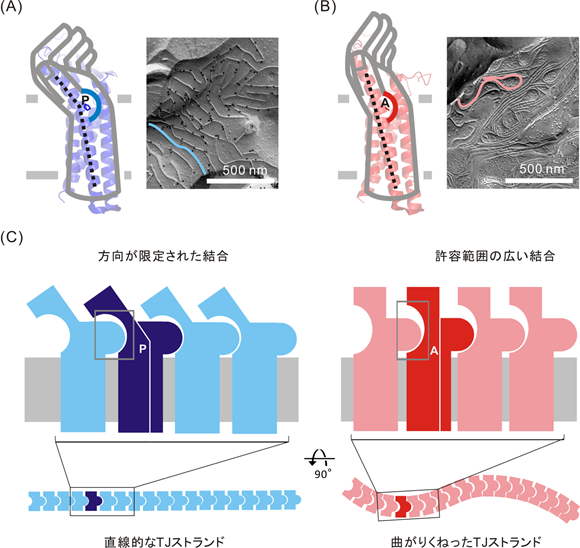
今回私たちの研究グループは、クローディンの一種であるクローディン3の原子レベルでの構造をX線結晶構造解析3)という手法を用いて明らかにすることに成功しました。クローディン3の構造は、これまでに構造がわかっていた他の種類のクローディンと比べて、親指の付け根に相当する位置を起点として、手首より上の部分に相当する細胞外領域が大きく屈曲している特徴がありました(図3A)。クローディンの細胞外領域はクローディン同士の結合に重要であるため、私たちはこの屈曲した構造に着目しました。屈曲の起点は親指の付け根に相当する位置であり、プロリン4)という種類のアミノ酸残基が存在していました。他の種類のクローディンではアラニンという種類のアミノ酸残基が存在しており、プロリンが屈曲を引き起こしていると考えられました。そこで、このプロリンをアラニンに置換したクローディン3を作製して、その構造についても明らかにしました。その結果、アラニンに変えたクローディン3では屈曲は見られず、直線型の構造をしていました(図3B)。よって、親指の付け根の位置の1つのアミノ酸残基の種類の違いによって、クローディンの全体構造が屈曲型または直線型となり、手首の傾きが変わるように細胞外領域の傾きが大きく変化することが明らかになりました。次に、凍結割断電子顕微鏡法5)を用いてTJストランドの形態を観察した結果、屈曲型のクローディン3は直鎖状で粗いTJストランドを形成し、直線型のクローディン3は曲がりくねって密度の高いTJストランドを形成することがわかりました(図3AB)。これらの結果を基にして、図3Cに示すように、TJストランドの形態を決定する機構についてのモデルを提唱しました。屈曲型のクローディンでは、折れ曲がりとともに結合に関わる凹状のへこみが傾き、隣のクローディンと結合する方向が限定されるため、直鎖状で粗いTJストランドが形成されると考えられます。一方、直線型のクローディンでは、凹状のへこみは傾いておらず、結合の許容範囲が広くなるため、曲がりくねった密なTJストランドが形成されると考えられます。さらに、細胞同士の接着力を測る実験を行った結果、屈曲型クローディン3よりも直線型クローディン3の方が強い接着力となり、タイトジャンクションの接着力に影響があることが示されました。以上の実験結果により、親指の付け根に位置する一つのアミノ酸残基の違いは、クローディンの全体構造を変化させ、クローディンの種類によって異なるバリアの形成に重要であると考えられます。
今後の展開
今回、クローディン3の構造によって示された屈曲構造は、クローディンの種類によって異なる多様なバリアの形成に寄与することが明らかとなり、私たちの体が正常に働くための根幹となるバリア機能についての理解を深め、今後、新たな研究を促すことが期待されます。さらに、医療分野においても、クローディンの原子レベルでの構造解明や多様なバリア機能を理解することは、様々な分野に貢献すると期待されています。特に、創薬分野においては、薬物の標的への移行を妨げているタイトジャンクションの透過性を制御することの実現は、新しい薬物送達手法として期待されています。特に、血液脳関門6)のタイトジャンクションの制御によって脳への移行が困難であった薬の利用や、皮膚のタイトジャンクションの制御によって全身効果のある貼り薬の利用などが可能となり、新薬の開発を促進することが期待されます。また、癌化した細胞ではその癌の種類によって特定の種類のクローディンが過剰に発現するため、そのようなクローディンを検出することによって、癌を見つけ出す検査に利用することも期待されています。
用語解説
- 1)タイトジャンクション:
- 隣り合う細胞同士を密着させる接着装置。細胞と細胞のすき間における物質の透過を制限することによって、バリアやチャネルとして働く。
- 2)クローディン:
- 細胞と細胞を密着させることによって細胞同士のすき間を埋めるタンパク質。癌化した細胞ではクローディンの発現に異常が生じることが知られている。
- 3)X線結晶構造解析:
- X線を結晶に照射し散乱されたX線の強度を観測することで、結晶中の物質の三次元構造を知る手法。本研究ではX線光源として、兵庫県西播磨の大型放射光施設(SPring-8)と長久手市にあるあいちシンクロトロンを利用した。
- 4)プロリン:
- タンパク質を構成する遺伝子にコードされた20種類のアミノ酸のうち唯一の環状アミノ酸。略号はProまたはP。タンパク質のへリックス(らせん)構造を曲げる効果があることが知られている。
- 5)凍結割断電子顕微鏡法:
- 高真空中で凍結割断し、割断面上に作製したレプリカ膜を観察することで、通常の切片法では観察出来ない立体構造の解析が可能となる。自然のままの試料形態が観察できることから、含水試料・軟試料の観察に幅広く用いられている観察手法である。
- 6)血液脳関門:
- 血液と脳との間の物質の交換を制限する機構。血液の浸潤や脳髄液の漏出の防止など重要な役割を担うが、脳神経系疾患の治療では薬物の脳への送達を妨げる。
特記事項
本研究は、日本学術振興会(JSPS)科学研究費助成事業・基盤研究(S)(課題番号15H05775)、日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォーム(BINDS)ならびに次世代治療・診断実現のための創薬基盤技術開発事業「革新的中分子創薬技術の開発/中分子シミュレーション技術の開発」の支援のもとで行われました。
また、本研究は名古屋大学と大阪大学の共同によって行われました。
論文情報
- 掲載誌:
- Nature Communications
- 論文タイトル:
- “Morphologic determinant of tight junctions revealed by claudin-3 structures”
- 著者:
- Shun Nakamura, Katsumasa Irie, Hiroo Tanaka, Kouki Nishikawa, Hiroshi Suzuki, Yasunori Saitoh, Atsushi Tamura, Sachiko Tsukita, and Yoshinori Fujiyoshi
- DOI:
- 10.1038/s41467-019-08760-7
お問い合わせ先
研究内容
名古屋大学 細胞生理学研究センター
助教 入江 克雅
AMED事業
AMED 創薬戦略部 医薬品研究課
関連リンク
- 創薬等ライフサイエンス研究支援基盤事業
- 次世代治療・診断実現のための創薬基盤技術開発事業
- 細胞と細胞を張り合わせるジッパーの形の違いを生み出す仕組みの解明 | 名古屋大学プレスリリース