構造変化を0.05ナノメートルの精度で捉える
2019-04-26 科学技術振興機構,首都大学東京,京都大学
ポイント
- 核磁気共鳴分光測定法(NMR法)で原核細胞内のたんぱく質の立体構造を高分解能で直接解析する技術はあるが、より複雑な細胞構造を持つ真核細胞内では困難だった。
- 最新のNMR法と情報科学的解析技術を駆使して、生きた状態の真核細胞内でたんぱく質の立体構造を高分解能(たんぱく質主鎖原子の位置で0.05ナノメートルの精度)で観測することに初めて成功した。
- 疾患関連たんぱく質の構造変化を細胞内で直接捉えるなど、医薬開発などへの応用が期待される。
戦略的創造研究推進事業において、首都大学東京の池谷 鉄兵 助教と伊藤 隆 教授らは、生きた真核細胞注1)の中でたんぱく質の立体構造を詳細に解析する技術の開発に成功しました。
細胞内はさまざまな分子が複雑に混み合った環境であり、その中で働くたんぱく質の立体構造変化や生物活性に大きな影響を与えることが知られていました。本研究グループはこれまで、原核細胞である大腸菌の細胞内に存在するたんぱく質の立体構造の解析を世界に先駆けて行ってきましたが、医療や創薬への波及的効果が高い真核細胞は、より複雑な細胞構造を持つため、解析レベルは十分ではありませんでした。
本研究グループは、最新の核磁気共鳴分光測定法(NMR法)注2)と情報科学的解析技術を駆使し、測定機器に細胞の生命維持装置を付加する工夫を重ねた結果、生きた真核細胞として昆虫培養細胞Sf9注3)をモデル細胞に用い、その細胞内に存在するたんぱく質の立体構造を原子レベルの分解能で観測することに成功しました。このうち3種のたんぱく質については、真核細胞では初となる高分解能(0.05ナノメートルの精度)で立体構造を決定することができました。この結果、従来の試験管内の解析結果とは異なり、細胞内の環境ではたんぱく質の立体構造が変化している現象を捉えることに成功しました。
本成果で確立した技術を発展させることで、真核細胞を用いた疾患発症メカニズムの分子レベルでの理解や、疾患関連たんぱく質の構造変化を細胞内で直接捉えることによる薬剤スクリーニングなどの応用研究で大きな進展をもたらすことが期待されます。
本研究は、京都大学の白川 昌宏 教授、独フランクフルト大学のピーター・ガンテルト 教授と共同で行いました。
本研究成果は、ドイツ科学誌「Angewandte Chemie International Edition」で掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」(研究総括:田中 啓二 東京都医学総合研究所 理事長)
研究課題名:「NMRと計算科学の融合によるin situ構造生物学の確立と真核細胞内蛋白質の動態研究への応用」
研究代表者:伊藤 隆(首都大学東京 大学院理学研究科 教授)
研究期間:平成25年4月~平成31年3月
<研究の背景と経緯>
細胞内は非常に多くの種類と量のたんぱく質、核酸、脂質などの生体分子が混み合った状態にあり、試験管内の環境つまり生化学実験などで生体分子が単離精製された状態とは著しく異なっています(図1)。
核磁気共鳴分光測定法(NMR法)を用いて生きた細胞の中の生体高分子を観測する「ⅰn-cell NMR法」と呼ばれる技術は、細胞内のたんぱく質を原子レベルの分解能で観察する手法です。ⅰn-cell NMR法では、解析対象のたんぱく質を安定同位体で標識しながら細胞内で合成させる、もしくは安定同位体で標識したたんぱく質を外部から細胞内に注入し、それらを異種核多次元NMR注4)で標識選択的に測定します。
本研究グループは、これまでⅰn-cell NMR法の要素技術を開発し、原核細胞である大腸菌を用いて、世界に先駆けてその細胞内に存在するたんぱく質の立体構造について解析を行ってきました(Nature 2009、Sci Rep.2016など)。
しかしながら、ヒトを始めとする真核生物の細胞の中でたんぱく質の立体構造を解析するには、いくつもの問題がありました。例えば、真核細胞でⅰn-cell NMR法を行うと、大腸菌で行った場合と比べて、解析対象のたんぱく質の濃度が低くなります。これは測定感度が低下することを意味しています。また、生きている細胞が測定中に死なないようにしたり、限られた測定時間の中で十分な情報を集めたりする手法が重要となります。さらに、測定情報から効率的にたんぱく質の立体構造を導き出す新しい方法論の開発も必要でした。
<研究の内容>
真核細胞内でたんぱく質のⅰn-cell NMR法を実現するために、本研究グループは主に3つの技術開発、改良を行いました(図2)。
(1)ⅰn-cell NMR法の装置内で細胞の生存率を上げるための生命維持装置を付加
この装置は新鮮な培養溶液を常に供給するバイオリアクターシステムであり、6時間程度であった測定時間を24時間以上に伸ばすことに成功しました。
(2)測定データから多次元NMRスペクトルを再構成するためのデータ収集法と、より定量性の高い計算法を開発
データを一様に取得せず、間引いて観測することで測定の高速化と感度向上を図りました。さらに間引かれた欠損データは、本研究グループが開発した定量的な信号再構成技術(最大エントロピー法)により再構成することで補いました。その結果、従来法に比べて、測定されたシグナル強度の再現性が飛躍的に向上し、従来法では観測できなかった低感度の信号も含む良質なNMRスペクトルを得ることができました。
(3)限られた距離情報から効率良く正しい立体構造を算出するため、ベイズ推定を用いた新しい立体構造計算法を開発
実験データの解釈に、統計学で広く用いられるベイズ推定を採用することで、ノイズなどによる計測値の曖昧性を加味した統計的なデータ解析が可能になりました。その結果、従来法が0.1ナノメートルの分解能であったのに比べて、本技術では著しく分解能が向上し、0.05ナノメートルの分解能を達成することができました。
これらを組み合わせた新しい技術で、生きた真核細胞として昆虫培養細胞(Sf9)をモデル細胞に用い、5種類のたんぱく質の立体構造を細胞内で直接解析しました。昆虫培養細胞(Sf9)は、真核生物由来のたんぱく質翻訳後修飾がなされるため、天然の生物学的活性と構造を保持したたんぱく質を調製する細胞として広く用いられています。今回解析したたんぱく質のうち、分子量1万未満の3種(図3:GB1、ユビキチン、TTHA1718注5))について、従来の試験管内での解析精度に迫る正確で高分解能な立体構造を得ることに世界で初めて成功しました。
細胞内で得られた立体構造と従来の試験管内の立体構造を比較したところ、たんぱく質の一部分の空間位置が変わっている現象を見いだしました(図4)。この構造変化は、細胞内では他の分子と相互作用した結果を反映していると考えられます。一方、たんぱく質のうち分子量1~2万の2種(HRas、カルモジュリン注6))についても、立体構造変化を観察するための原子間の距離情報の取得が可能であることを示すことができました。
<今後の展開>
本研究で確立した技術は、今後さまざまなたんぱく質に適用されることが期待されます。本研究では立体構造が比較的しっかりとした「固い」単一構造のたんぱく質を解析しましたが、そのようなたんぱく質でも細胞内の環境では明らかな立体構造の変化が起こっていました。
一方、細胞の中で働くたんぱく質には、立体構造が非常に柔らかい部分を持つたんぱく質や試験管内の実験では特定の立体構造を示さない天然変性たんぱく質(神経変性疾患に関わるたんぱく質など)、複数の構造単位が数珠つなぎになっているたんぱく質などが知られています。細胞内でさまざまな分子が複雑に混み合った環境で、それらの構造解析が容易に行われるようになれば、生物学に非常に大きなインパクトを与えることになります。
また、本研究で開発した技術を応用して、創薬研究のプロセスで薬剤と標的たんぱく質が実際に細胞内で相互作用しているかを確認する手段として期待されます。
<参考図>
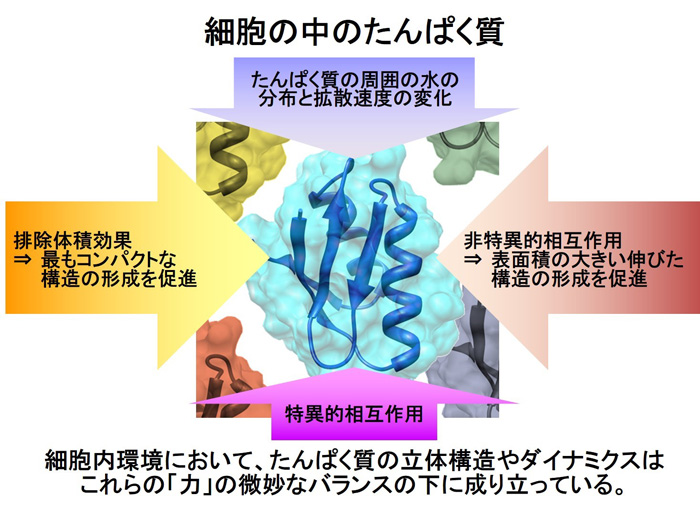
図1 たんぱく質が細胞内環境で受ける複合的な影響
このような細胞内環境の効果を正しく予測することは困難なので、ⅰn-cell NMR法などの実験的手段を用いて解析する必要がある。
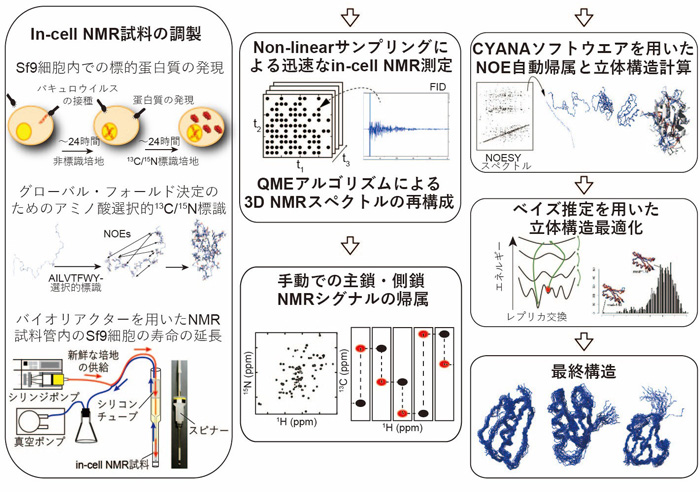
図2 Sf9細胞内のたんぱく質の立体構造決定のために開発した解析法
真核細胞内たんぱく質のⅰn-cell NMR法のために開発した解析法。バイオリアクターシステム、多次元NMRスペクトルの再現性の高い再構成法、ベイズ推定を用いた新しい立体構造計算法などを組み合わせ、従来では不可能であった高分解能での立体構造決定を可能にした。
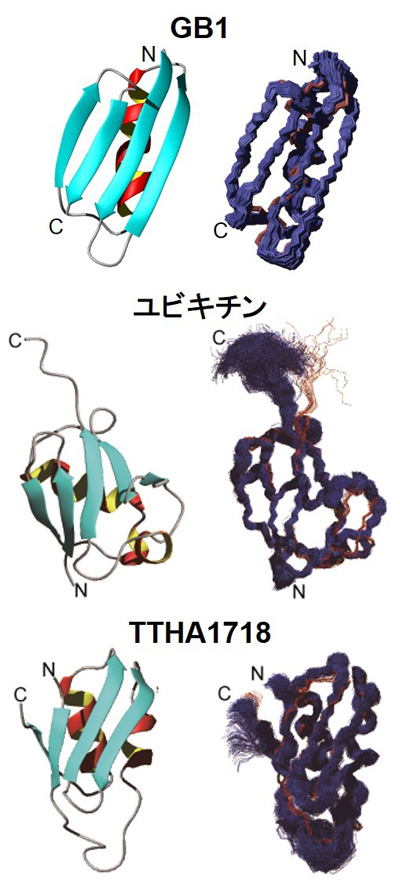
図3 Sf9細胞内で決定されたたんぱく質の立体構造
3種のたんぱく質について、真核細胞では初となる高分解能の立体構造を決定することに成功した。右は最終構造アンサンブルの主鎖原子を重ね合わせたもの。左はたんぱく質の折りたたみ方を示したリボン構造。
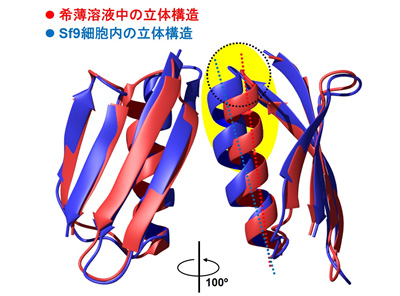
図4 Sf9細胞内の環境がGB1たんぱく質の立体構造に与えた影響
GB1たんぱく質の希薄溶液内構造(赤)とSf9細胞内構造(青)を比較したもの。Sf9細胞内では、α―ヘリックス構造の相対的配置が変化しており、たんぱく質の表面に向かって開く方向にずれていた。これはヘリックス付近の疎水的な領域(図中黄色)と細胞内の他の因子との疎水的相互作用の影響と考えられる。
<用語解説>
- 注1)真核細胞
- 核膜で隔てられた明瞭な細胞核を持つ細胞。全ての細胞は、大腸菌や他のバクテリアなどの(明瞭な核を持たない)原核細胞と、真核細胞の2つに分けられる。ヒトを含む全ての高等生物は真核細胞でできている。
- 注2)核磁気共鳴分光測定法(NMR法)
- 静磁場の中に置かれた原子核が固有の周波数の電磁波と相互作用する現象。この性質を利用して、NMR観測可能な原子核(1H、13C、15Nなど)をその原子核が置かれている化学的環境の差によって分光することができる。
- たんぱく質のような複雑な分子であっても、異種核多次元NMR法によって分子中の多数の1H核のNMRシグナルを分離し、それぞれの1H核同士の相互作用を詳細に解析することで、分子の立体構造や機能メカニズムなどを原子レベルで解析することができる。
- 注3)昆虫培養細胞Sf9
- ヨトウガ由来の昆虫培養細胞の1つ。昆虫を宿主とするバキュロウイルスに外来遺伝子を組み込み、Sf9細胞を始めとする昆虫細胞に感染させて目的のたんぱく質を発現させる技術が既に確立されており、真核細胞由来のたんぱく質を調製する方法として広く用いられている。
- 注4)異種核多次元NMR
- たんぱく質分子の詳細なNMR解析を可能にするNMR測定技術。1990年代に米国のBaxらによって開発された。たんぱく質を均一に13Cおよび15N(いずれもNMR測で定可能な安定同位体核)で標識し、1H核のNMRシグナルを、この核と相互作用する13Cおよび15N核の周波数で2~4次元に展開する。高分解能スペクトルとして測定された場合、非常に多くの原子から構成されているたんぱく質分子であっても、個々の原子が分離して観測される。
- 注5)GB1、ユビキチン、TTHA1718
- GB1:連鎖球菌protein GのB1ドメイン。NMR解析の標準たんぱく質の1つとして方法論的開発に広く用いられている。
- ユビキチン:真核生物に高度に保存されているたんぱく質で、不要なたんぱく質の分解など、さまざまな生命現象に関与している。NMR解析の標準たんぱく質の1つ。
- TTHA1718:高度好熱菌由来の重金属結合たんぱく質。大腸菌を用いた世界初の細胞内立体構造決定がなされた試料。
- 注6)HRas、カルモジュリン
- HRas:ヒト原がん遺伝子H-rasの産物たんぱく質。低分子量GTP結合たんぱく質の1つであり、細胞の増殖、分化のシグナルを伝達する働きがある。
- カルモジュリン:代表的なカルシウム結合たんぱく質。細胞内のカルシウム、シグナル伝達で中心的な役割を果たしており、さまざまな生命現象の調節に寄与している。
<論文タイトル>
“High Resolution Protein 3D Structure Determination in Living Eukaryotic Cells”
(生きた真核細胞中の蛋白質の高分解能3次元構造の決定)
<お問い合わせ先>
<研究に関すること>
伊藤 隆(イトウ ユタカ)
首都大学東京 大学院理学研究科 化学専攻 教授
池谷 鉄兵(イケヤ テッペイ)
首都大学東京 大学院理学研究科 化学専攻 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
科学技術振興機構 広報課
首都大学東京 管理部 企画広報課 広報係
京都大学 総務部 広報課 国際広報室