何重にも張り巡らされたストレス感知のための巧妙な仕組み
2019-07-17 東北大学大学院医学系研究科,東北大学東北メディカル・メガバンク機構,日本医療研究開発機構
発表のポイント
- ストレスセンサーKeap1が酸化ストレス※1を感知するメカニズムを初めて明らかにしました。
- Keap1は複数のシステイン残基※2を使い分けることにより酸化ストレスを感知していることがわかりました。
- Keap1は不具合が生じた場合においても酸化ストレスを感知して生体を守ることができる巧妙な仕組みを備えていることを明らかにしました。
研究概要
東北大学大学院医学系研究科の鈴木隆史講師(医化学分野)、山本雅之教授(医化学分野、東北メディカル・メガバンク機構 機構長)らは、ストレスセンサーKeap1が酸化ストレスを感知する仕組みを解明しました。
酸化ストレスは老化、そしてがんなどの様々な病気を引き起こす原因となりますが、転写因子※3Nrf2は酸化ストレスに応答して活性化し細胞を保護します。つまりNrf2は酸化ストレスから体を守っています。Nrf2はストレスセンサーKeap1によって、活性を調節されています。しかし、Keap1が環境中の毒物(親電子性ストレス※4)を感知する仕組みはこれまでに知られていたものの、酸化ストレスがNrf2を活性化するメカニズムは長い間わかっていませんでした。
今回Keap1が親電子性ストレスとは異なるメカニズムで酸化ストレスを感知することがわかりました。また、Keap1は、仮に不具合が発生した場合においても酸化ストレスを感知して生体を守ることができる巧妙な仕組み(フェイルセーフ機構)を備えていることがわかりました。本研究成果により、Keap1は複数のシステイン残基を使い分けて様々な環境ストレス刺激を感知していることが明らかになりました。今後、これらの知見を活用してNrf2活性化剤の開発が発展することが期待されます。
この成果は米国時間2019年7月16日に米国科学雑誌「Cell Reports」のオンライン版で公開されました。
本研究の詳細
Nrf2の活性を調節するストレスセンサーKeap1が親電子性ストレスを感知するメカニズムは親電子性物質によるKeap1システイン残基の修飾(図中の「既知のメカニズム」部分)であり、すでに解明されていました。本研究により、Keap1がこのメカニズムと異なる酸化ストレスを感知するメカニズムを持つことを明らかにしました。それは酸化ストレスによって複数のシステイン残基の間でジスルフィド結合※5が形成されることによって酸化ストレスを感知しNrf2を活性化するメカニズムです(図中の「酸化ストレス」部分)。
Keap1は、仮に不具合が発生した場合においても酸化ストレスを感知して生体を守ることができる巧妙な仕組み(フェイルセーフ機構)を備えていることがわかりました(図)。その仕組みは、酸化ストレス感知に必要なシステイン残基の一部が親電子性ストレスなどによる修飾を受けてしまった場合でも、残ったシステイン残基の間でジスルフィド結合(SS結合)を形成することでNrf2活性化を引き起こすことを可能にするメカニズムです。そのため、システイン残基を1つずつ失わせる従来の解析方法では明らかにすることは難しく、複数のシステイン残基を同時に失わせる解析アプローチを採用することによって明らかにすることに成功しました。この複数のシステイン残基の組み合わせは膨大であるため、これまで手付かずのままとなっていました。
今後の展望
多くの基礎・臨床研究の成果から、Nrf2活性化は外部からの酸化ストレスを原因とした化学発がん※6など様々な疾患の予防や治療に有効であることが明らかになっております。本研究を進めていくことで、Keap1-Nrf2システムの活性化メカニズムの分子基盤の理解が進み、Keap1-Nrf2システムを利用した新薬や治療法の開発が加速することが期待されます。
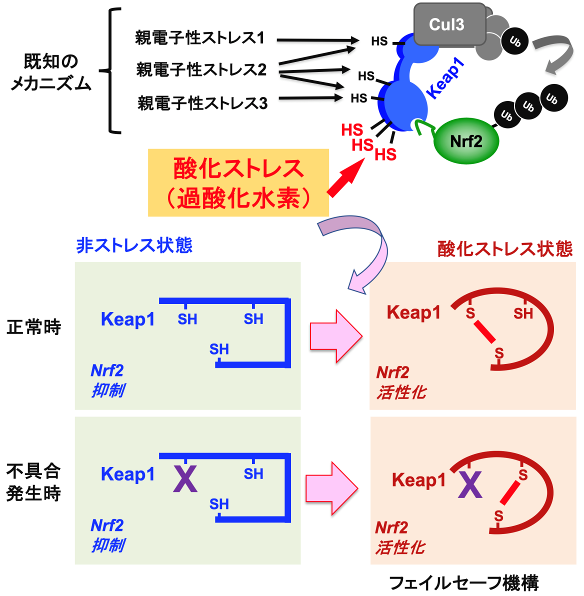
【図】酸化ストレス応答におけるKeap1-Nrf2制御系のフェイルセーフ機構
Keap1は、Cul3と複合体を形成してNrf2をユビキチン(Ub)化し、Nrf2を分解することでその働きを抑制する。Keap1は、親電子性ストレスとは異なるシステイン残基(SH)で酸化ストレスを感知し、ジスルフィド結合(SS結合)を形成してNrf2を活性化する。酸化ストレスセンサーの一部に不具合が生じた場合においても、酸化ストレスを感知してNrf2を活性化できる仕組み(フェイルセーフ機構)を備えている。
用語解説
- ※1 酸化ストレス
- 過酸化水素など反応性の高い活性酸素種によってDNAやタンパク質が傷害されること。外来ストレスやミトコンドリアでの酸化的リン酸化など様々な要因によって細胞内で発生する。
- ※2 システイン残基
- タンパク質を構成するアミノ酸の一つで、側鎖に反応性の高いチオール基(SH基)を持っている。
- ※3 転写因子
- DNAに結合して遺伝子の発現を制御するタンパク質の総称。
- ※4 親電子性ストレス
- 内部に電子が少ない部分を持った分子(親電子性物質)によってDNAやタンパク質などが傷害されること。環境中の毒物の代謝(解毒)過程で生成することが多い。
- ※5 ジスルフィド結合
- 二つのチオール基が酸化されることで形成される共有結合のこと。SS結合ともいう。タンパク質の立体構造の形成に大きく影響することが多い。
- ※6 化学発がん
- 工業副産物や食品等に含まれる化学物質により引き起こされるがんの総称。
論文題目
- 題目:
- Molecular Mechanism of Cellular Oxidative Stress Sensing by Keap1
「Keap1による酸化ストレス感知の分子機構」 - 掲載誌:
- Cell Reports
- DOI:
- 10.1016/j.celrep.2019.06.047
著者
-
- 東北大学大学院医学系研究科 医化学分野
- 鈴木 隆史、村松 亜紀、齋藤 良太、磯 達朗、安達 紗希、須田 博美、守田 匡伸、Liam Baird、山本 雅之*
(*東北大学 東北メディカル・メガバンク機構を兼任)
-
- 名古屋大学トランスフォーマティブ生命分子研究所
- 桑田 啓子
-
- 名古屋大学大学院生命農学研究科
- 柴田 貴広
-
- 東京大学大学院農学生命科学研究科
- 内田 浩二
-
- 佐賀大学農学部アグリ創生教育研究センター
- 川口 真一
-
- 金沢医科大学総合医学研究科
- 岩脇 隆夫
研究支援先
本研究は、文部科学省 科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業(AMED P-CREATE)における研究開発課題「抗がん剤・放射線治療抵抗性がんを標的としたNRF2阻害剤の開発」(研究開発代表者:山本雅之)、公益財団法人武田科学振興財団の支援を受けて行われました。
お問い合わせ先
研究内容に関すること
東北大学大学院医学系研究科 医化学分野
東北メディカル・メガバンク機構長
教授 山本 雅之(やまもと まさゆき)
東北大学大学院医学系研究科 医化学分野
講師 鈴木 隆史(すずき たかふみ)
報道担当
東北大学東北メディカル・メガバンク機構(ToMMo)
広報・企画部門
長神 風二(ながみ ふうじ)
AMED事業に関すること
日本医療研究開発機構(AMED)
戦略推進部 がん研究課