2020-01-29 愛知医科大学, 国立遺伝学研究所
従来の DNA2本鎖切断を利用したゲノム編集方法は、高効率ですが、DNA 配列の書き換えエラーも多いという問題点がありました。愛知医科大学医学部生化学講座の小西裕之教授(特任)、兵頭寿典講師らの研究グループは、高い DNA 配列書き換え効率を維持しつつ、書き換えエラーの発生を劇的に抑えるゲノム編集方法の研究を行いました。
本研究は、愛知医科大学医学部内科学講座(神経内科)、国立遺伝学研究所との共同研究として行われました。
研究成果は 2020 年 1 月 28 日、米国科学誌「Cell Reports」(電子版)に掲載されました。
<研究成果のポイント>
- ゲノム DNA の2本鎖のうち1本だけを2か所切断することで、効率よくゲノ ム配列を書き換えられることを見出しました。
- ゲノム DNA のもう一方の鎖は切断されないため書き換えエラーがほぼ起き ないことを証明しました。
- DNA の2本鎖切断が起きないため、p53 がん抑制遺伝子が活性化せず、細胞 にがん化のリスクが起きていないことがわかりました。
- 医療向けの安全で正確なゲノム書き換え方法として今後の研究が期待されます。
I. 研究の背景
近年の技術革新により、人類は DNA 配列の一部を設計通りに書き換える(つまり塩基を置換する)ことができるようになりました。DNA に書き込まれている遺伝情報の総称をゲノムと呼ぶため、この DNA 配列の書き換え行為は「ゲノム編集」と呼ばれます。ゲノム編集は、動物・植物だけでなくヒト細胞にも行うことができます。ヒトゲノムの編集は、技術の安全面や倫理面で克服すべき問題を抱えていますが、治療法のなかった遺伝性疾患や DNA 配列異常が引き起こす疾患の根治療法になりえるなど画期的な技術でもあります。
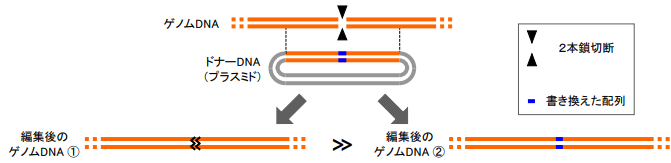
図1 従来のゲノム DNA 書き換えの方法。
ゲノム DNA の2本鎖を切断し、 細胞の DNA 修復機構によって DNA 配列を書き換える。実際には、設 計通りに書き換えられる(右、②)ことよりも、2本鎖切断の部位に 書き換えエラーが発生する(左、①)ことの方が多い。
現在までにゲノム編集による様々な「書き換え」方法が報告されていますが、最も一般的なのは、書き換えたい部位の DNA2本鎖を切断し、その切断部位を、書き換えたい DNA 配列を持つ人工 DNA 断片(ドナーDNA)を参考に修復させる方法です(図1)。しかし、この方法は書き換えエラーが発生しやすく、またゲノム中の予期せぬ場所に2本鎖切断が起きやすいという短所があります。さらに、DNA の2本鎖切断はがん抑制遺伝子である p53 の活性化を引き起こす(細胞にがん化のリスクが起きていることを意味する)など、重大な危険性も報告されています。今後、ゲノムの書き換え
を疾患治療に応用していくためには、より安全で正確な方法が必要とされています。
II. 研究内容
愛知医科大学医学部の小西裕之教授(特任)、兵頭寿典講師らの研究グループは、ゲノム書き換え技術の安全面の問題を解決するため、新たな手法の確立を目指して研究を行ってきました。そして今回、DNA の同じ鎖の2か所に1本鎖切断を起こすことによって効率よくゲノム編集を行えることを見出しました。
研究グループはまず、DNA1本鎖を切断する特殊な CRISPR/Cas9 酵素とドナーDNA を、プラスミドベクターによって様々なヒト細胞株に導入しました。
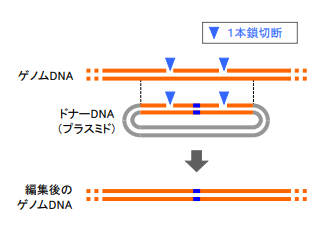
図2 当研究のゲノムDNA書き換えの方法。
ゲノム DNA とドナーDNA に1本鎖切断が導入され、書き換えが起きる。
そしてゲノム書き換えの効率をフローサイトメトリーやゲル泳動によって解析しました。その結果、この方法で達成される書き換え効率は従来の DNA2本鎖を切断する方法と概ね同レベルであることがわかりました。また、書き換えの参考となるドナーDNA にも同じ部位に1本鎖切断が起きており、それが十分な書き換え効率が達成される理由であると考えら
れました(図2)。
次に、上記の導入を行った細胞株からゲノム DNA を採取し、その配列を詳細に解析しました。その結果、当研究の方法で発生するDNA書き換えエラーは、従来のDNA 2本鎖切断による方法に比べてはるかに少ないことがわかりました(図3)。当研究の方法では DNA2本鎖切断が起きないことがその理由であると考えられます。
また、上記の導入を行った細胞株でがん抑制遺伝子 p53 が活性化しているかどうかを、p53 の下流分子 p21 の定量的 PCR と免疫細胞染色によって検討しました。その結果、従来法では p53 の活性化が見られたのに対し、当研究の方法では p53 の活性化は見られませんでした。
以上より、当研究の DNA 書き換えの方法は、細胞へのダメージが少なく、従来の方法よりも安全・正確にゲノ
ムを書き換えうることが明らかになりました。
III. 今後の展開
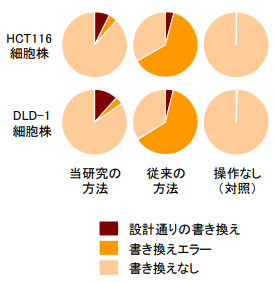
図3 当研究の方法によるゲノム書き換えの結果。従来法の結果と合わせて示す。
将来、ゲノム編集を疾患の治療に応用するにあたっては、大別して2通りの様式が想定されています。ひとつは、造血幹細胞(血球細胞のもとになる幹細胞)などの細胞を患者さんから採取し、ゲノム編集を施した後に患者さんに戻す方法(体外法)であり、もうひとつは、ゲノム編集を行うためのタンパク質や核酸を体内に直接投与して、体内でゲノム編集治療を行う方法です(体内法)。
今後は、今回報告した DNA 書き換えの方法をその両方に対応できるように最適化して行く予定です。
まずは細胞株(シャーレで培養した細胞)での研究と並行してマウスなどの実験動物を使った研究を進めて行きたいと思います。
IV. 発表雑誌
タイトル: Tandem paired nicking promotes precise genome editing with scarce interference by p53(Tandem paired nicking 法は p53 による干渉をほぼ受けずに正確なゲノム編集を誘導する)
著 者 : 兵頭寿典 (Toshinori Hyodo)1、Md. Lutfur Rahman1、Sivasundaram Karnan1、伊藤卓司
(Takuji Ito)2、豊田敦 (Atsushi Toyoda)3, 4、太田明伸 (Akinobu Ota)1、Md Wahiduzzaman1、都築忍 (Shinobu Tsuzuki)1 、岡田洋平 (Yohei Okada)2 、細川好孝 (Yoshitaka
Hosokawa)1、小西裕之 (Hiroyuki Konishi)1
1. 愛知医科大学医学部 生化学講座
2. 愛知医科大学医学部 内科学講座(神経内科)
3. 国立遺伝学研究所 ゲノム・進化研究系 比較ゲノム解析研究室
4. 国立遺伝学研究所 先端ゲノミクス推進センター
掲載誌: Cell Reports(米国東部時間 1 月 28 日)本研究は、日本学術振興会科学研究費助成事業(18K14703、18K08342、18H02645、17H05707、 17K19465、17K07263)、文部科学省科学研究費助成事業・新学術領域研究「学術研究支援基盤形成」先進ゲノム解析研究プラットフォーム(先進ゲノム支援;16H06279)、日本医療研究開発機構・難治性疾患実用化研究事業(19ek0109243h0003)、公益財団法人ヒロセ国際奨学財団、公益財団法人武田科学振興財団の支援を受けて行われました。
<研究者のコメント>
ゲノム編集を技術的な面から分類すると、DNA 配列の破壊、新しい配列の挿入、配列の書き換えなどに分けられます(図4)。ゲノム編集食品では、その中でもっぱら DNA 配列の「破壊」が行われています。それによって食品となる動植物に新たな性質(価値)を付加しようというわけです。
一方、医療の分野では当研究でとりあげたような「書き換え」が重要になると考えられています。ヒト細胞のゲノム配列の異常を書き換えて正常に戻すことが、疾患(特に遺伝性疾患)の根治療法になりうるからです。
なお、生殖細胞の遺伝子は書き換えられないため、書き換えたゲノムは次世代には引き継がれません。また、「書き換え」以外にゲノム配列の「破壊」や新しい配列の「挿入」も医療に役立つと考えられています。
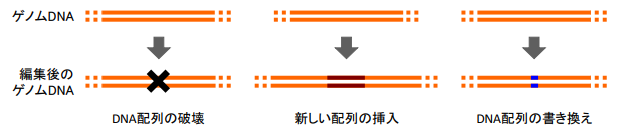
DNA配列の破壊 新しい配列の挿入 DNA配列の書き換え
図4 さまざまなゲノム編集のパターン。当研究では、 このうち「DNA 配列の書き換え」をテーマとする。
<問い合わせ先>
研究に関すること
愛知医科大学医学部 生化学講座
小西 裕之 教授(特任)
報道担当
愛知医科大学 庶務課