2020-03-06 東京大学
三上 秀治(化学専攻 助教)
合田 圭介(化学専攻 教授/カリフォルニア大学ロサンゼルス校 非常勤教授
/武漢大学工業科学研究院 非常勤教授)
発表のポイント
- 生物学・医学の研究において細胞集団(血液細胞、免疫細胞、がん細胞、幹細胞、微生物、腸内細菌など)の解析にAIが活用され始めているが、従来はAI技術の開発に不可欠な高品質かつ十分な量の学習データを取得することが困難であった。
- 賢いAIの開発の肝となる高品質・大規模な細胞画像データを取得する超高速細胞撮像技術の開発、およびディープラーニングを用いた高精度細胞解析を行った。
- 多種多様な細胞集団から膨大な情報を引き出して活用することが可能となり、AI × 医療、AI × 創薬、AI × スマートセル産業などへの展開が期待される。
発表概要
東京大学大学院理学系研究科化学専攻の三上秀治助教、合田圭介教授らは、生物学・医学の分野におけるAI技術開発の肝となる高品質・大規模な細胞画像の取得技術「疑似固定蛍光イメージング・フローサイトメトリー(Virtual-Freezing Fluorescence Imaging Flow Cytometry; VIFFI)」の開発に成功しました。また、実例として、ディープラーニングを用いて高精度な細胞解析(AI × 免疫学)を実証しました。本研究成果により、多種多様な細胞集団(血液細胞、免疫細胞、がん細胞、幹細胞、微生物、腸内細菌など)から膨大な情報を引き出して活用することが可能となり、AI × 医療、AI × 創薬、AI × スマートセル産業などへの展開が期待されます(図1)。
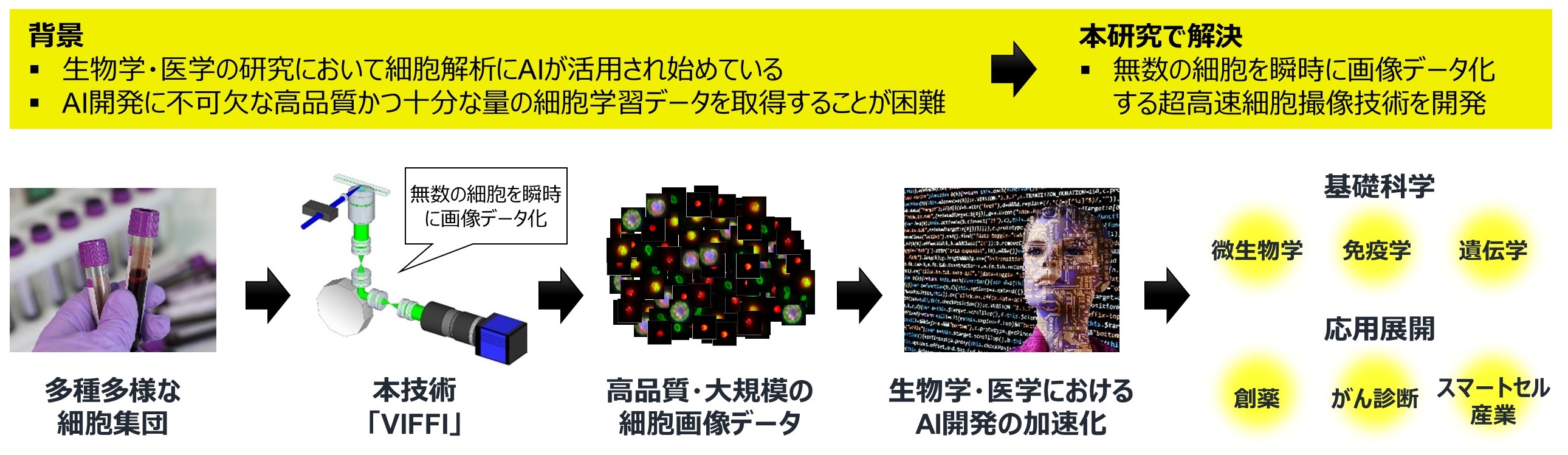
図1:本研究の概念図
今回、細胞集団から従来よりも圧倒的に高品質・大規模なデータを取得する技術を開発したことで、生物学・医学におけるAIの能力を最大限に引き伸ばすことが可能になり、基礎科学における新たな発見や、さまざまな生命工学分野における効率化などの応用展開が期待される。
本研究は、内閣府総合科学技術・イノベーション会議の革新的研究開発推進プログラム(ImPACT)、日本学術振興会の研究拠点形成事業、科学研究費助成事業、ホワイトロック財団、精密測定技術振興財団の支援を受けて実施されました。
本研究成果は、2020年3月6日にNature Communicationsのオンライン版で公開されました。
発表内容
研究の背景と経緯
近年、生物学・医学の分野において生体試料からAIによって情報を引き出す技術が注目されています。AIを用いることによって、これまで人の手や直感に頼らざるを得なかった作業が自動化され、ひいては人が処理しきれない膨大な情報を処理できるようになるため、これらの分野に革命的な進展を引き起こすことが期待されます。しかしながら、AIが能力を発揮するためには、高品質かつ大規模なデータによってAIを「学習」させることが必要ですが、従来の技術ではこのような高品質・大規模データを取得することが困難なために、本来のAIの能力を活かしきることができませんでした。同研究グループでは、過去に大規模な細胞集団から顕微鏡画像を取得する技術を開発しましたが(2018年1月30日プレスリリース)、撮像を高速化するほど画像が不鮮明となる問題があり、取得されるデータはAIの能力を引き出すには不十分でした。
研究の内容
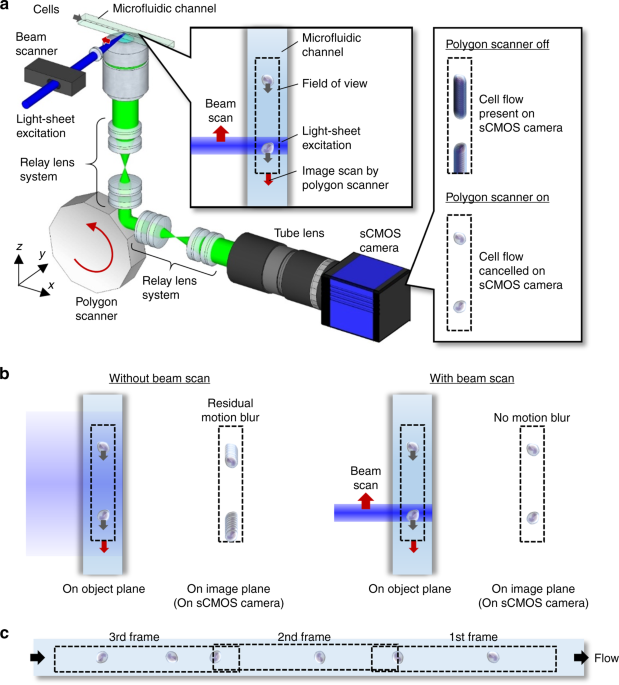
本研究では、細胞の観察に適した蛍光顕微鏡(注1)の鮮明な画像を従来よりも桁違いに高速に取得できる技術「疑似固定蛍光イメージング・フローサイトメトリー(Virtual-Freezing Fluorescence Imaging Flow Cytometry; VIFFI)」を開発しました(図2a、図2b)。
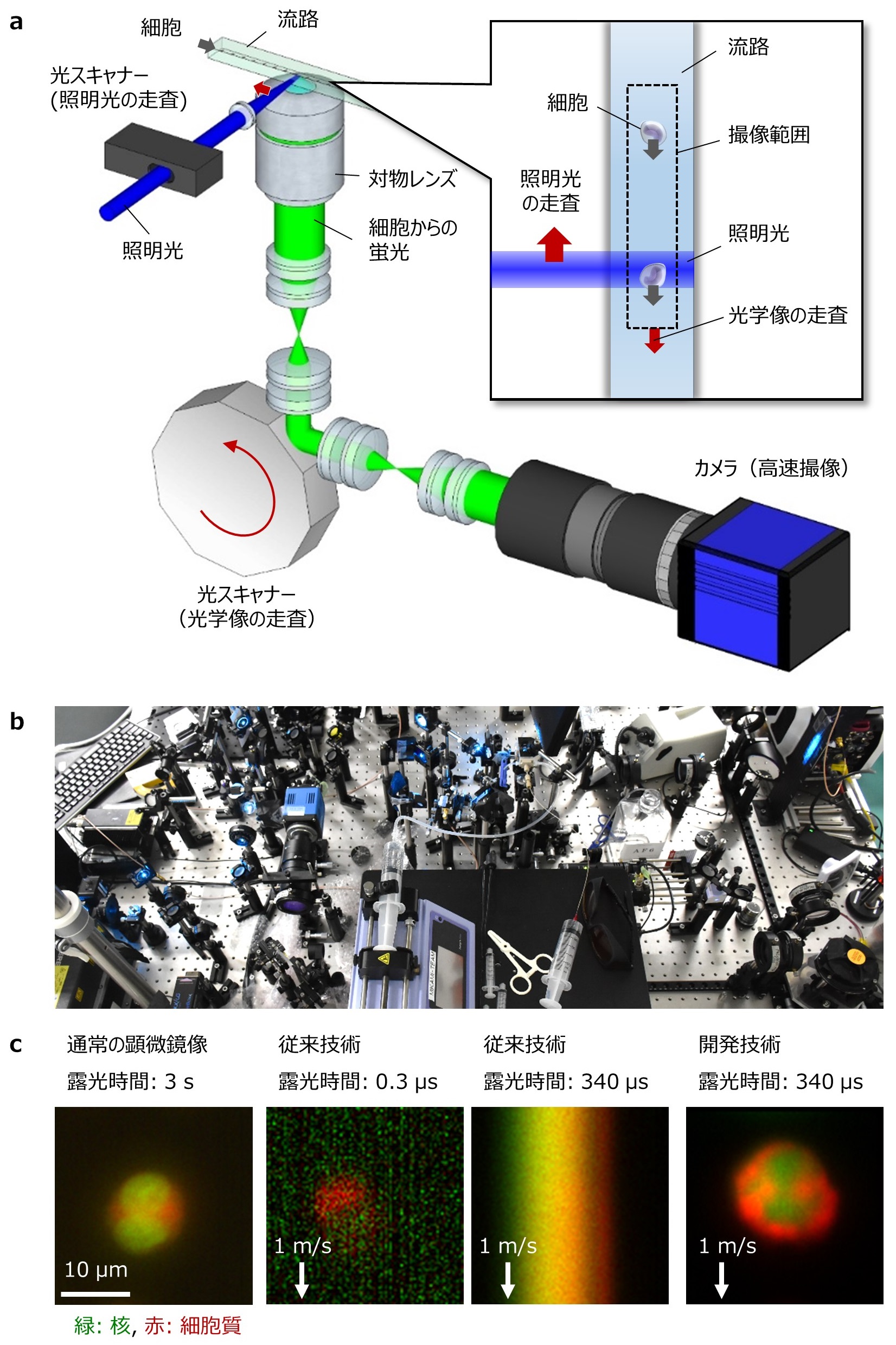
図2:本研究で開発した疑似固定蛍光イメージング・フローサイトメトリー(Virtual-Freezing Fluorescence Imaging Flow Cytometry; VIFFI)の概略
a. 開発技術の模式図。ふたつの光スキャナー(光の進む向きを制御する装置)によって細胞を照らす照明光と細胞から発せられる蛍光の進む向きを制御することで、細胞が高速で流れていてもカメラに届く蛍光の光学像が固定されるようにする。このため、明るい画像を取得するために露光時間を長くしても像がぶれることなく鮮明な画像が取得できる。b. 開発した装置の外観。c. 開発技術の動作実証。白血病細胞を用いて開発技術の動作実証を行った。左の画像は通常の蛍光顕微鏡で取得した画像。真ん中の2つの画像は無数の細胞を撮像するために細胞を水中で毎秒1メートルの速さで流して従来技術で取得した像。露光時間が短いと画像が暗く、露光時間が長いと動きによるぶれが生じるためにいずれも不鮮明な画像となる。右の画像は開発技術によって得られた像。毎秒1メートルの速さで細胞が流れていても、明るく鮮明な画像が取得できた。図中のμmはマイクロメートルで、ミリメートルの1000分の1を表す単位。
本技術では、高速に細胞を撮像する際に生じる画像のぶれやにじみをレーザー光などの光線を巧みに操作することで抑え、撮像の高速性と画像の鮮明さの両立を実現することが可能です。具体的には、ふたつの光スキャナー(光の進む向きを制御する装置)によって細胞を照らす照明光と細胞から発せられる蛍光の進む向きを制御することで、細胞が高速で流れていても蛍光画像がカメラ上で固定されるようにし、次々と流れる細胞を撮像しつつ、ひとつひとつの細胞の撮像に十分な露光時間を確保します。本技術を用いない場合は、露光時間が短いと画像が暗く、露光時間が長いと画像がぶれてしまうのでいずれも不鮮明となりますが、本技術によって鮮明な撮像ができるようになりました(図2c)。本技術を用いて、毎秒1メートルの速度で流体中を流れるさまざまな種類の細胞の撮像を行い、細胞内部の詳細な構造を取得できることを実証しました(図3)。
図3:本研究の開発技術によって取得されるさまざまな細胞の鮮明な蛍光顕微鏡画像
a. 白血病細胞のDNAを染色したもの。b. 酵母細胞(細胞壁を可視化したもの)。c. クラミドモナス(藻類の一種。画像は体内のクロロフィルを可視化したもの)。d. 肺がん細胞。赤が細胞内部、緑が細胞表面、青が細胞核を表す。e. マウスの白血球。赤が細胞の外形、緑が細胞核を表す。f. ユーグレナ(藻類の一種)。緑が脂肪、赤がクロロフィルを表す。いずれの画像も毎秒1メートルの速さで細胞が流れている間に撮像された。図中のμmはマイクロメートルで、ミリメートルの1000分の1を表す単位。
さらに、AI × 免疫学の具体例として、約20,000個のマウスの白血球のひとつひとつから鮮明な画像を短時間で取得し(図4a)、細胞内部の構造が細胞ごとにどのように異なるかを明らかにしたほか(図4b)、別々の条件で準備された白血球の集団を、AIを用いて約95%の高精度で識別できることを実証しました(図4c)。
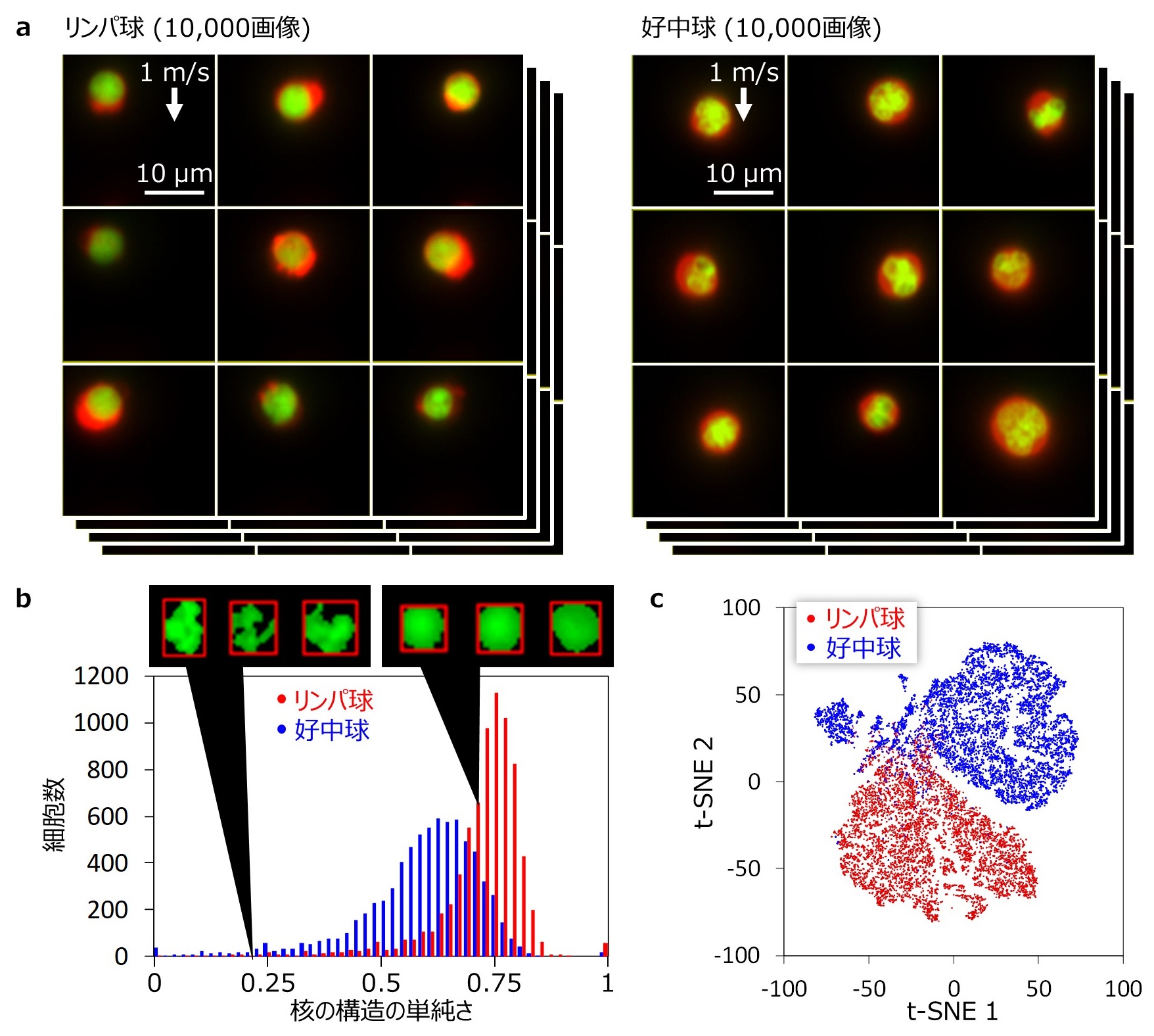
図4:AI × 免疫学の実例
a. マウスのリンパ球、好中球(それぞれ白血球の一種)をひとつひとつ撮像し、それぞれ10,000枚程度取得した。外形(赤色)と内部の核の形状(緑色)の鮮明な画像から、それぞれの白血球の特徴がはっきりと捉えられている。b. 核の形状を詳細に分析し、構造の単純さを数値化して細胞集団内の分布をとらえたもの。リンパ球、好中球で分布が異なることのみならず、それぞれの種類の中で分布が見られることがわかる。c. これらの画像データをAIの一種であるディープラーニングにより解析したもの。t-SNEプロット(注4)により画像の特徴を自動的に分析し、それぞれの細胞の類似度合いを可視化している。2点の間が近いほど細胞の画像が類似している。リンパ球と好中球の集団がおおむね分離されており、95%の精度で分離することができた。
今後の展開
本技術により取得される細胞集団の高品質・大規模な画像データは、AIの実力を最大限発揮するのに理想的なデータとなるため、大規模な細胞集団を研究対象として扱う細胞生物学、免疫学、遺伝学などの基礎科学における新たな発見や、創薬、バイオ燃料開発、リキッドバイオプシー(注2)、スマートセル(注3)産業等における効率化技術の開発など、さまざまな応用展開が期待されます(図1)。
本研究チームは、日本、米国、中国、台湾の研究者からなる大規模な異分野融合・国際研究チームであり、東京大学の三上秀治(理学系研究科化学専攻助教)、川口誠(研究当時:理学系研究科化学専攻修士課程学生)、黃俊融(研究当時:理学系研究科化学専攻客員研究員)、松村洋貴(理学系研究科化学専攻修士課程学生)、杉村武昭(研究当時:理学系研究科化学専攻客員研究員)、黄康睿(理学系研究科化学専攻博士課程学生)、雷誠(研究当時:理学系研究科化学専攻特任助教)、上野俊之介(理学系研究科化学専攻博士課程学生)、三浦太一(研究当時:理学系研究科化学専攻修士課程学生)、伊藤卓朗(研究当時:理学系研究科化学専攻客員研究員)、永澤和道(研究当時:医科学研究所博士研究員)、前野貴則(研究当時:医科学研究所博士研究員)、渡会浩志(研究当時:医科学研究所特任准教授)、山岸舞(研究当時:理学系研究科生物科学専攻客員共同研究員)、上村想太郎(理学系研究科生物科学専攻教授)、大貫慎輔(新領域創成科学研究科先端生命科学専攻特任助教)、大矢禎一(新領域創成科学研究科先端生命科学専攻教授)、黒川宏美(筑波大学医学医療系助教)、松阪諭(筑波大学医学医療系教授)、孫家偉(國立交通大學光電工程學系教授)、小関泰之(工学系研究科電気系工学専攻准教授)、合田圭介(理学系研究科化学専攻教授)で構成されています。
発表雑誌
- 雑誌名
Nature Communications論文タイトル
Virtual-freezing fluorescence imaging flow cytometry著者
Hideharu Mikami*, Makoto Kawaguchi, Chun-Jung Huang, Hiroki Matsumura, Takeaki Sugimura, Kangrui Huang, Cheng Lei, Shunnosuke Ueno, Taichi Miura, Takuro Ito, Kazumichi Nagasawa, Takanori Maeno, Hiroshi Watarai, Mai Yamagishi, Sotaro Uemura, Shinsuke Ohnuki, Yoshikazu Ohya, Hiromi Kurokawa, Satoshi Matsusaka, Chia-Wei Sun, Yasuyuki Ozeki*, and Keisuke Goda*DOI番号
10.1038/s41467-020-14929-2
用語解説
注1 蛍光顕微鏡
前処理などにより蛍光を発するよう準備された試料にレーザー光などの照明光を照射して、試料から発する蛍光を検出することによって試料の画像を取得する顕微鏡の一種。生体試料の観察したい部分だけを蛍光観察できたり、1ミクロン以下の高精細な蛍光画像を取得できたりするため、生体試料の観察に幅広く用いられている。
注2 リキッドバイオプシー
血液などの体液検体を用いて診断を行う医療技術。病変の一部を採取して検査を行う生検と比べ患者の負担が小さく、複数回の診断を行って治療の経過を時系列でモニターすることが可能となる。また、血液中の循環がん細胞やセルフリーDNAを検出することによってがんの早期発見のための技術としても注目を集めている。
注3 スマートセル
遺伝子改変や培養条件を最適化することで、従来の化学工業的な手法では合成できない複雑な化合物を生合成できるように改変された細胞。DNAの突然変異と目的物質を生産する細胞選別を繰り返し行う指向性進化法(2018年ノーベル化学賞)を用いることでさまざまな物質を生産する細胞をデザインできる。 ↑
注4 t分布型確率的近傍埋め込み(t-SNE)プロット
t-SNEは多次元のデータから低次元の特徴量を抽出する方式であり、t-SNEの結果を散布図として表したものを t-SNEプロットという。本研究ではディープラーニングが出力する多次元データに t-SNE処理を施し、高次元での特徴をある程度保持したまま 2 次元平面上に各細胞集団の分布を表示している。t-SNEプロットは細胞集団の識別における分離度を視覚的に表現する上で便利である。
―東京大学大学院理学系研究科・理学部 広報室―