2020-05-22 国立がん研究センター,東京大学,理化学研究所,日本医療研究開発機構
発表のポイント
- がん抑制遺伝子であるBRCA2遺伝子のバリアントに対するハイスループット機能解析法を開発しました。
- これまで薬剤感受性や発がんリスクが明らかでなかった186種類の意義不明なBRCA2遺伝子バリアントについて機能解析を行い、新たに37種類の病的なバリアントを発見しました。
- 本手法の臨床応用例として、遺伝子検査で発見されたバリアントに対する迅速な病的意義判定システムを構築しました。
概要
国立研究開発法人国立がん研究センター研究所細胞情報学分野 池上政周任意研修生、高阪真路ユニット長、間野博行分野長らの研究グループは、国立がん研究センター中央病院乳腺・腫瘍内科 田村研治科長、国立大学法人東京大学大学院医学系研究科 田中栄教授、細谷紀子准教授、国立研究開発法人理化学研究所生命医科学研究センター 桃沢幸秀チームリーダーらと共同で、遺伝性乳がん・卵巣がん(注1)の原因として知られるがん抑制遺伝子(注2)BRCA2遺伝子のバリアント(注3)に対するハイスループット機能解析法(注4)を開発しました。
本研究グループは、これまでにがん遺伝子(注5)に対する革新的なハイスループット機能解析手法(mixed-all-nominated-mutants-in-one method: MANO法)を構築し、EGFRやERBB2といったがん遺伝子の意義不明バリアントの機能解析を行ってきました。この手法を発展させ、BRCA2の機能解析手法であるMANO-BRCA法(MANO-B法)を確立し、186種類の意義不明バリアントを含むこれまでで最大規模の244種類のバリアントについて機能解析を行った結果、新たに37種類の病的バリアントを同定しました。さらに本手法の臨床応用例として、遺伝子検査で新たに発見されたバリアントの病的意義(注6)を迅速に判定し、報告するシステムを構築しました。本システムは、適切な治療方針が定まらず不安を抱えていた意義不明バリアント保持者に正しい情報を伝えることができることから、リスク低減手術(注7)やPARP阻害薬(注8)投与の必要性を判断するためのコンパニオン診断(注9)としての活用が期待されます。
本研究成果は、英国科学雑誌「Nature Communications」に5月22日付で掲載されます。
背景
日本人の女性は、その生涯のうちに9%が乳がんを、1%が卵巣がんを発症するといわれており、乳がんは最も頻度の高いがんです。一般的にはがんは遺伝する疾患ではありませんが、乳がん・卵巣がんのうちおよそ10%は遺伝性に生じます。特に、BRCA1およびBRCA2の2種類の遺伝子のいずれかに生まれつき病的バリアントを有する場合を遺伝性乳がん・卵巣がん症候群(Hereditary Breast and/or Ovarian Cancer syndrome: HBOC)といい、親から子に二分の一の確率で発がんのリスクが遺伝します。HBOCの女性は、その生涯に乳がんに41-90%、卵巣がんに8-62%の頻度で発症すると報告されており、また若い年齢で発症する傾向やがんが多発する傾向がみられます。HBOCと診断された女性は遺伝カウンセリングを受診し、リスク低減手術や定期的なサーベイランス(注10)といった治療の選択肢の説明を十分に受けた上で、どれを選択するかを決めることになります。また、HBOCの女性の血縁者がHBOCである確率は十分に高いため、血縁者も遺伝子検査を受けるかどうかを慎重に判断する必要があります。
細胞の中にあるDNAは、紫外線や活性酸素、化学物質などの刺激により、常に損傷を受けています。DNAの損傷がうまく修復されないと細胞が死んでしまったり、異常が蓄積してがん細胞に変化したりします。BRCA遺伝子は損傷を受けたDNAを修復する機能を持ち、細胞ががん化することを抑える働きを持ちます。BRCAの病的バリアントを持つ細胞ではこの修復機能が低下しているためDNAの異常が蓄積しやすく、結果として病的バリアントの保持者は乳がんや卵巣がんを発症しやすくなります。そして興味深いことに、完全にBRCAの機能を失ったがん細胞に、BRCAとは別の仕組みでDNA損傷を修復するPARPタンパク質の働きを阻害すると、DNA損傷が顕著となりがん細胞が死んでいくことが知られています。実際に、分子標的治療薬(注11)であるPARP阻害薬の一つオラパリブは、BRCA病的バリアントを有する乳がん・卵巣がん患者に対して臨床の場で使用されています。
遺伝子を構成しているDNAは4種類の塩基からなり、連続した3個の塩基が1つのアミノ酸に翻訳されます。BRCA2は10,257個の塩基からなる比較的大きい遺伝子で、最終的に3,418個のアミノ酸からなるタンパク質を構成します。BRCA2の遺伝子検査ではこの全ての塩基を決定し、どのようなバリアントであるかは、最終的に構成するタンパク質にどのような変化が生じるかを判定できます。がん患者を対象としてこれまでに行われてきたゲノム研究や遺伝子検査により、BRCA2遺伝子には多数のバリアントが発見されています。BRCA2の短縮型バリアント(注12)が発がんに寄与していることはよく知られており、リスク低減手術やサーベイランス、血縁者への遺伝子検査によるがんの予防と早期発見、そして既に生じたがんにはPARP阻害薬を用いて治療する、などの診療が行われます。一方でBRCA2遺伝子には非同義バリアント(注13)が数千種類も報告されていますが、そのほとんどは病的意義が明らかとなっていないバリアント(variants of unknown significance: VUSs)です。VUSの保持者については、そのバリアントの機能や疾患との関連が不明であるため、検査の結果が治療に繋がらないことになります。また、病的な変化であることを否定もできないため、慎重なサーベイランスを要することから、VUSの存在は遺伝子検査の限界として大きな問題となっています。しかし、日々の遺伝子検査で発見され続けている膨大な数に及ぶBRCA2のVUSに対して、その機能解析に対応できるハイスループットな手法はこれまで存在しておらず、更に遺伝子検査の有用性を高めるには、バリアントの病的意義に関するデータベースの充実が不可欠です。
BRCA2のバリアントが病的であるかどうかを判定する上で、そのバリアントの保持者を多数集めたとき、野生型バリアントを有する人と比べてがんの発症率が高くなっているかが最も重要です。しかし、BRCA2にはその遺伝子の大きさに起因する数千種類にも及ぶ非同義バリアントが存在しており、一つ一つのバリアントの保持者は限られたものになり、病的かどうかを判断するに至りません。このような場合には、細胞実験や動物実験によってバリアントの機能を調べる機能解析法が有用です。これまでにもBRCA2バリアントのDNA修復機能を評価するためにさまざまな実験手法が開発されています。しかし、膨大な数のVUSの病的意義を判定するのに重要である、(1)ハイスループットの解析手法であること、(2)ヒトの細胞でBRCA2が安定的に発現する実験系であること、(3)BRCA2の塩基配列のどの部位のバリアントに対しても機能を評価できること、の3点を満たす実験系は存在せず、革新的な機能解析手法の開発が望まれていました。
研究成果
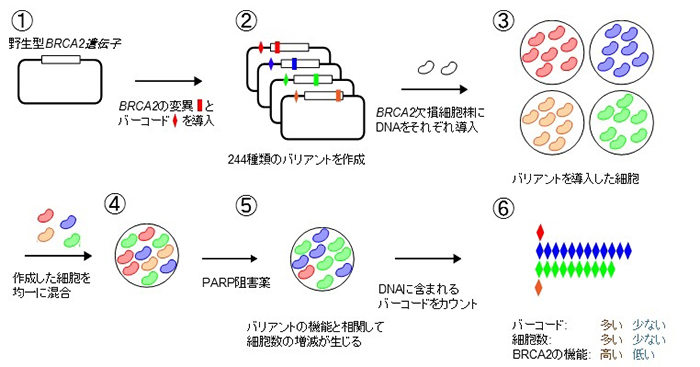
本研究グループはこれまでにがん遺伝子のVUSに対する機能解析法であるMANO法を開発し、多くのVUSの機能と分子標的治療薬への反応性を明らかにしてきました。その経験を活かし、がん抑制遺伝子であるBRCA2の機能解析に対応した、前述の3点を満たす実験系であるMANO-B法を確立しました(図1)。
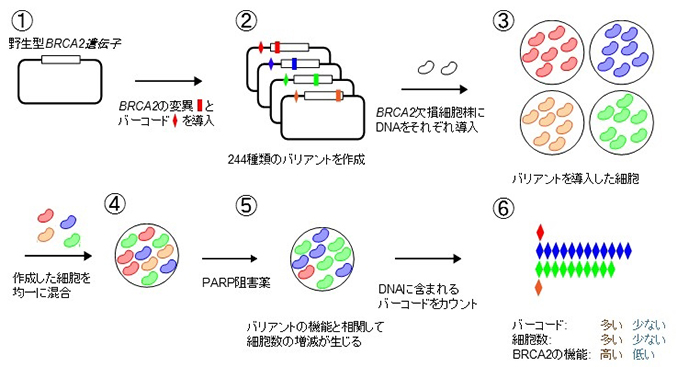
図1 MANO-B法の概略図
まずBRCA2の機能を喪失したヒト大腸がん細胞株であるDLD1にさまざまなBRCA2バリアントを導入し、各バリアントの機能に相関してPARP阻害薬への反応性が変化する現象を確認しました。この事実は、PARP阻害薬への反応性が高い場合は導入したバリアントの機能が低く、反応性が低い場合は導入したバリアントの機能が高いと評価できることを意味します。
MANO-B法はトランスポゾンベクター(注14)を用いてBRCA2遺伝子をBRCA2遺伝子欠損の細胞株に導入して機能解析を行います。まず野生型(注15)のBRCA2を鋳型として、1ヶ所だけDNAに変異を導入したベクターを244種類作成しました。さらに、それぞれのバリアントに一対一で対応する10塩基からなる識別用バーコード配列を組み込んでおきます。BRCA2遺伝子のバリアントを導入した細胞を作成したあと、その全てを均一に混和した状態でPARP阻害薬とともに一定期間培養します。その後培養細胞のゲノムDNAを抽出し、次世代シークエンサー(注16)を用いてバーコードの相対量を計測します。その値から各バリアントが導入された細胞の相対数を算出することで、各バリアントの機能とPARP阻害薬への反応性を一度の解析で多数評価できます。
この手法を用いて244種類のBRCA2バリアントの機能解析を行いました。まず、病的意義に関する標準的な評価基準であるACMG分類(注17)やIARC分類(注18)とMANO-B法の結果の一貫性を確認しました。ACMG分類における22種類の良性のバリアントと19種類の病的なバリアントは、MANO-B法によってきれいに2つのグループに分別されており、MANO-B法での機能評価と臨床的な良悪性が対応していることが分かりました(図2)。さらに186種類のVUSの機能解析を行った結果、126種類が正常な機能を持つバリアント、37種類が機能を喪失した病的バリアントと判明しました。23種類のバリアントは中間的な機能を持っており、臨床的に良性なのか発がんへの寄与があるのかは判断が困難でした(図3)。また、多くの病的なバリアントはDNAと結合するドメイン(注19)であるHDやOBに位置していましたが、HDやOB以外にも病的バリアントは存在し、またHDやOBのバリアントが必ずしも病的とは限らないことから、個々のバリアントに対して機能解析を行う必要性が明らかとなりました。
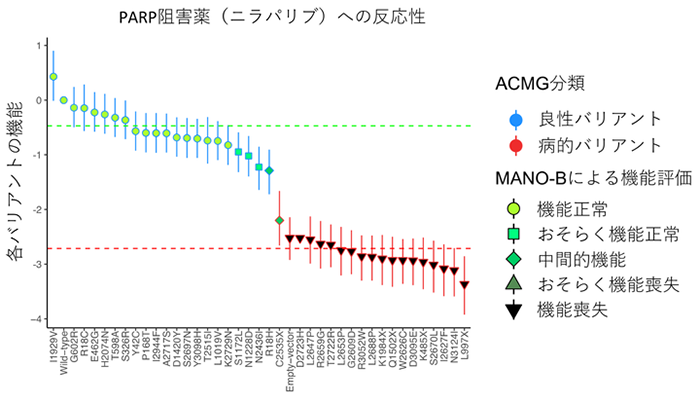
図2 ACMG分類とMANO-B法での機能評価の一貫性
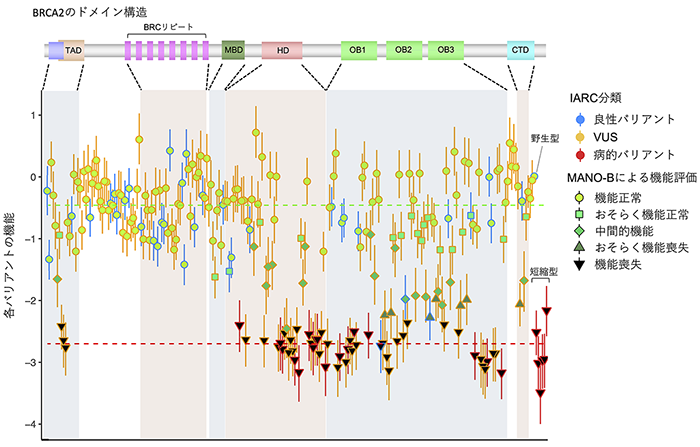
図3 244バリアントに対するMANO-B法での機能評価
更にMANO-B法を臨床応用することを目的とし、遺伝子検査で新規に発見されたVUSの病的意義を患者や医療者に迅速に報告するシステムとして、以下のAccurate BRCA Companion Diagnostic (ABCD) テストを提唱しました。機能を評価したいバリアント4種類と、既に機能の分かっているバリアント8種類を用いてMANO-B法を行い、得られた結果をベイズ推定(注20)の手法で過去の実験結果と統合することで各バリアントの機能を判定します。ABCDテストは開始から報告まで5週間で終了する簡便な実験系でありながら、244バリアントを用いた大規模な実験と同様の機能評価ができることが分かりました。
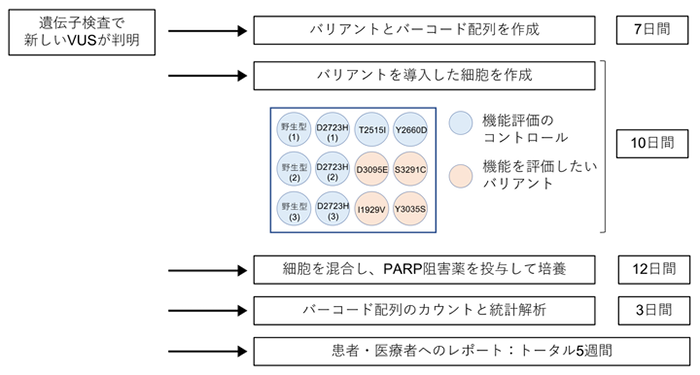
図4 新規VUSに対する迅速な病的意義報告システムであるABCDテストの概要
展望
本研究において、これまで病的意義が不明であった186種類のBRCA2バリアントの機能解析を行い、37種類の病的バリアントと126種類の正常な機能のバリアントを新たに同定できたことは、遺伝子検査の有用性を向上させることに繋がる大きな結果です。このMANO-B法を継続して多数のVUSの存在に対して実施していくことで、適切な治療方針が定まらず不安を抱えているVUS保持者を減らすことができます。一方で、23種類の中間的な機能を持つバリアントが認められ、これらが発がんに寄与しているかどうかについて、今回の結果からは意義付けができませんでした。中間的な機能を持つバリアントの保持者を多数集め、がんの発症率を解析するような疫学研究が望まれます。
また、今回提唱したABCDテストは5週間で報告可能であり、臨床的に許容できる迅速性を有します。VUSを保持することが判明し不安になっている患者に対して、リスク低減手術やPARP阻害薬投与の必要性を判断するためのコンパニオン診断としての臨床応用が期待されます。
発表論文
雑誌名
Nature Communications
タイトル
High-throughput functional evaluation of BRCA2 variants of unknown significance
著者
Masachika Ikegami, Shinji Kohsaka, Toshihide Ueno, Yukihide Momozawa, Satoshi Inoue, Kenji Tamura, Akihiko Shimomura, Noriko Hosoya, Hiroshi Kobayashi, Sakae Tanaka, and Hiroyuki Mano
国立がん研究センター
研究所 細胞情報学分野 任意研修生 池上政周
研究所 細胞情報学分野 ユニット長 高阪真路
研究所 細胞情報学分野 主任研究員 上野敏秀
研究所 細胞情報学分野 特任研究員 井上聡
中央病院 乳腺・腫瘍内科 科長 田村研治
中央病院 乳腺・腫瘍内科 医員 下村昭彦 (当時)
研究所 細胞情報学分野 分野長 間野 博行
東京大学大学院医学系研究科
疾患生命工学センター放射線分子医学部門 准教授 細谷紀子
整形外科学講座 講師 小林寛
整形外科学講座 教授 田中栄
理化学研究所生命医科学研究センター
基盤技術開発研究チーム チームリーダー 桃沢幸秀
DOI
10.1038/s41467-020-16141-8
掲載日
2020年5月22日
研究費
本研究は下記事業の支援を受けて行われました。
日本医療研究開発機構 革新的がん医療実用化研究事業(JP19ck0106252)
日本医療研究開発機構 臨床ゲノム情報統合データベース整備事業(JP18kk0205003)
日本医療研究開発機構 革新的先端研究開発支援事業インキュベートタイプ(JP18am0001001)
日本学術振興会 科学研究費助成事業(19J13207)
用語解説
注1 遺伝性乳がん・卵巣がん
乳がんや卵巣がんは基本的には遺伝しませんが、BRCA1およびBRCA2の2種類の遺伝子のうちいずれかに生まれつき病的バリアントを有する場合は、親から子に発がんのリスクが遺伝します。乳がん・卵巣がんのうちおよそ10%が遺伝性に生じます。
注2 がん抑制遺伝子
がんの発生を抑制する機能を持つタンパク質をコードする遺伝子。がん抑制遺伝子の機能喪失によりがん化が促進されます。
注3 バリアント
遺伝子の多様性を意味する言葉で、ヒトによってさまざまなDNAの配列が異なることが、ヒトの特徴や体質の多様性を生み出しています。
注4 ハイスループット機能解析法
機能解析の対象となる多数の遺伝子バリアントの実験を個別に行うのではなく、同時並行的に行うことで、一実験で大量の結果を得ることを可能にする実験手法。
注5 がん遺伝子
遺伝子に生じた異常によりがんの発生や増殖を促進するように変化した遺伝子。
注6 病的意義
バリアントが病気の発生に関与するかどうかについての有意性。
注7 リスク低減手術
BRCA1遺伝子やBRCA2遺伝子の病的バリアント保持者に対して、がんが発症する前に予防として乳腺や卵巣・卵管を切除する手術。
注8 PARP阻害薬
PARP(poly ADP-ribose polymerase)というDNAの損傷を修復するタンパク質を阻害する分子標的治療薬。BRCA1あるいはBRCA2の機能を喪失したがん細胞の細胞死を誘導できることから、BRCA遺伝子の病的バリアントを有する乳がん・卵巣がんなどのがん患者の治療に用いられています。
注9 コンパニオン診断
治療の効果や副作用を実施前に予測するために行なわれる臨床検査のこと。
注10 サーベイランス
定期的に検査や診察を行い、がんの早期発見に努めること。
注11 分子標的治療薬
がん細胞の増殖に関わる特定のタンパク質を標的にして、がんの増殖を抑制する薬剤。
注12 短縮型バリアント
遺伝子が作り出す本来のタンパク質と比べて、一部分が欠失したタンパク質を作るようになるバリアント。
注13 非同義バリアント
野生型と比較してタンパク質を構成する多数のアミノ酸のうち別のアミノ酸に変化しているバリアント。
注14 トランスポゾンベクター
遺伝子を細胞に導入する操作に用いる運び屋の一種で、目的の遺伝子を高効率に細胞のゲノムに組み込み、組み込み後に除去が可能なもの。
注15 野生型
バリアントの中で最も多くみられる型のこと。
注16 次世代シークエンサー
DNAの配列を、従来法と比べて桁違いに迅速かつ大量に決定できる実験機器。
注17 ACMG分類
米国臨床遺伝・ゲノム学会(American College of Medical Genetics and Genomics)の提唱する、遺伝子バリアントの病的意義分類。
注18 IARC分類
国際がん研究機関(International Agency for Research on Cancer)が疫学研究をもとにして判定したバリアントの病的意義分類。
注19 ドメイン
タンパク質の一部で他の部分とは独立した機能を持った構造。
注20 ベイズ推定
過去に得られたデータと新たに得たデータをもとにして、不確実な事柄を予測する統計手法。
問い合わせ先
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
国立大学法人東京大学
医学部・大学院医学系研究科総務係
国立研究開発法人理化学研究所
広報室 報道担当
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課