2018-05-21 理化学研究所
理化学研究所(理研)放射光科学研究センター油谷克英嘱託職員らの共同研究チーム※は、「超好熱菌[1]」が生産するタンパク質に非常に多く含まれる荷電性のアミノ酸(荷電性残基)[2]が、変性状態でイオン対(塩結合[3])を形成することで熱安定化に寄与する役割を果たすことを、分子動力学(MD)シミュレーション[4]により解明しました。
本研究成果は、超熱安定なタンパク質の設計に新しい重要な理論的指針を与えると期待できます。
水の沸騰温度付近で生育する超好熱菌が生産するタンパク質は、常温生物由来のタンパク質に比べて高い熱安定性を示します。超好熱菌タンパク質には、荷電性残基が好熱菌や常温生物などのタンパク質に比べて異常に高い割合で存在していますが、その理由については明らかにはなっていませんでした。
今回、共同研究チームは、MDシミュレーションにより、高温領域での熱安定性が良く解析されている3種の大腸菌由来CutA1変異型タンパク質の熱変性構造を明らかにしました。その結果、熱変性状態でも荷電性残基間の相互作用に差異が生じ、かなりの高温でも安定なイオン対が常温でのイオン対に匹敵する程度に維持されていることが分かりました。これらの現象は変性状態でのイオン対が変性構造の揺らぎを抑制して、変性状態のエントロピー[5]低下に寄与していると考えられます。
本成果は、国際科学雑誌『Scientific Reports』(5月16日付け)に掲載されました。
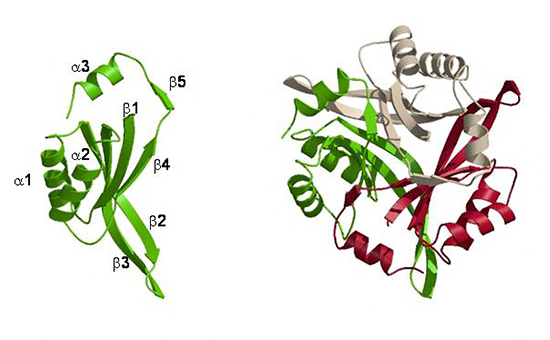
図 CutA1タンパク質の単量体(左)と三量体(右)の構造
※共同研究チーム
理化学研究所 放射光科学研究センター
嘱託職員 油谷 克英(ゆたに かつひで)
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
リサーチアソシエイト 松浦 祥悟(まつうら よしのり)
利用技術開拓研究部門 生体機構研究グループ
先任研究員 内藤 久志(ないとう ひさし)
高輝度光科学研究センター XFEL利用研究推進室
チームリーダー 城地 保昌(じょうち やすまさ)
背景
私たちの体の主な構成成分の一つであるタンパク質は、20種類のアミノ酸が多数ひも状に連なってできており、それぞれ固有の形、立体構造を持っています。この立体構造は、タンパク質が生理機能を発揮するのに重要であり、アミノ酸の配列によって決まります。タンパク質は天然構造(N)と変性構造(D)が平衡(1式)にあり、熱力学的法則(2式)によって安定化されています。
[N] ⇔ [D] (1)
ΔG = ΔH – TΔS (2)
ここで、ΔGは変性のギブスエネルギー[5]変化、ΔHは変性のエンタルピー[5]変化、ΔSは変性のエントロピー変化です。ΔG(=RTln [D]/[N])は安定性の尺度であり、ΔG =50kJ/molのときのD状態の割合はN状態の1億分の1程度です。
このようにD状態はN状態に比べて圧倒的に少ないため、D状態の構造研究は難しく遅れています。遺伝子操作技術が発展している今日、熱安定性の高いタンパク質を設計する指針が確立できていないのは、このD状態の構造が充分に理解されていないためです。
一方、水の沸騰温度付近で生育する「超好熱菌」が生産するタンパク質は、常温生物由来のタンパク質に比べて高い熱安定性を示します。また、超好熱菌タンパク質には、側鎖がイオン化する荷電性のアミノ酸残基(荷電性残基)が、好熱菌や常温生物などのタンパク質に比べて異常に高い割合で存在しています。このため、荷電性残基間のイオン相互作用(塩結合)が、タンパク質の熱安定化に寄与していると考えられます。しかし、実際は塩結合とは関係のない多くの荷電性残基が存在しており、超好熱菌タンパク質になぜ異常に多くの荷電性残基が存在するのかは謎でした。
そこで、共同研究チームは、異常に多い荷電性残基がD状態の構造に好ましい影響を与えている可能性を追求しました。例えば、ジスルフィド結合(S-S)は、タンパク質のD状態の自由度を抑制して、D状態のエントロピー減少によって安定化していると考えられています。つまり、2式のΔSを減少させ、安定性(ΔG)を高めるというわけです。そこで、荷電性残基がD状態でどのように挙動するかを、400K(約127℃)と450K(約177℃)での分子動力学(MD)シミュレーションで調べました。
研究手法と成果
油谷嘱託職員らは、2006年に変性温度(Td)が約150℃の超耐熱性を持つタンパク質を発見しました注1)。それは、超好熱菌株の一種Pyrococcus horikoshii由来のタンパク質「CutA1」で、非常に多く存在する荷電性残基が熱安定化に寄与していると推測しました。CutA1は、バクテリアからヒトの脳に至るまで広範囲の生物に存在することが知られています。ただしその機能は、大腸菌由来のCutA1(EcCutA1)(図1A)では、金属イオンとの関わりが議論されているものの、まだよく分かっていません。
共同研究チームは、EcCutA1を超好熱菌タイプに変換する研究過程で得た、わずかな変異で変性温度(Td)が大きく上昇する次の3種の変異型を用いました。
- EcCutA1を構成するアミノ酸の3個のシステイン(Cys)をそれぞれアラニン(Ala)に置換(C16A/C39A/C79A)した変異型(Ec0SH、Td=85.6℃)。
- Ec0SHの2個のアミノ酸残基を疎水性残基のバリン(Val)に置換(S11V/E61V)した疎水性変異型(Ec0VV、Td=113.2℃)。
- Ec0VVの6個のアミノ酸残基を荷電性残基のアスパラギン酸(Asp)、リシン(Lys)やアルギン(Arg)に置換(A39D/S48K/H72K/S82K/Q87K/T88R)した荷電性残基変異型(Ec0VV_6、Td=136.8℃)。
これらの3種の変異型はどれも三量体構造(図1A)をしていますが、単量体構造(112残基)について(図1B)、400Kと450K(図1C,D)の高温度における熱変性のMDシミュレーションを1,400ナノ秒(ns、1nsは10億分の1秒)まで行いました。MDは汎用ソフトウエアGROMACSを、力場はgromos43a1を用い、計算には理研のスーパーコンピュータ「mini-K」、「RICC」、「HOKUSAI」と研究室のワークステーションを使用しました。
注1)2006年7月13日プレスリリース「史上最高の熱安定を持つタンパク質を発見」
図2は、MDシミュレーションの結果、3種の変異型が400Kと450Kの熱変性によって、どの程度構造が破壊されるかを示した経時変化のグラフです。熱変性に伴う、天然構造におけるCα原子の変化量を全原子に関して平均変化量として、1,400nsまでの変化を示しています。どちらの温度でも、200~400nsで破壊の程度は一定値に達しました。その一例が図1C(Ec0VV_6)で、450KでのMDシミュレーションで500ns経過した時点では、αへリックス構造は完全に破壊され、βシート構造も天然構造(図1B)から大きく変化しました。また、400Kおよび450KでのMDシミュレーション中の構造は絶えず大きく揺らいでいました。
次に、3種の変異型の二次構造(αへリックス、βシート、βブリッヂ、ターン)について、MDシミュレーション中で平均どの程度維持されているかについて調べました。その結果、Ec0VV_6の場合、αへリックスは400Kでは1,000~1,400nsの平均で天然構造のほぼ4割を維持しましたが、450Kでは完全に構造破壊されたことが分かりました。しかしαへリックスを除く、βシート、βブリッヂ、ターンは4割近く維持していました(表1)。ただし、これらは天然構造と同じ残基での二次構造の形成を意味しているのではありません。
一方、Ec0VV_6の450Kにおける MDシミュレーション中(1254.4ns)で、Asp20とArg88が非常に近い距離で適切なイオン対(塩結合)を形成していることが分かったため(図1D)、イオン対に焦点を当てることにしました。
図3は450K MDシミュレーション中でのEc0VV_6のAsp39のCγ原子とLys87のCε原子間の距離の時間変化を示します。一般に正負のイオン対が0.6ナノメートル(nm、1nmは10億分の1メートル)以内にあれば、塩結合を形成していると考えられています。300Kの初期構造では2.5nm程度離れていたイオン間距離が、450K、1400nsのMDシミュレーション中に激しく揺らぐ中で、0.6nm以下に近づき塩結合を形成したり、また大きく離れたりしていることが分かりました。
そこで、Ec0VV_6に含まれる置換された6種の荷電性残基(Arg88、Asp39、Lys48、Lys72、Lys82、Lys87)について、1400nsのMDシミュレーション中に適切なイオン対のイオン間距離が0.6nm以下を占める割合を「占有率」と定義し、その対(ペア)残基と占有率(%)を表2に示しました。比較のために、天然構造(300K)でのそれらの塩結合の占有率も示しています。
Arg88は、450Kの場合15種の適切なペア残基と合計120.9%の占有率で塩結合を形成しています。値が100%を超えているのは、同時に2種類以上のペアと塩結合を形成していることを示しています。6種の荷電性残基の平均の占有率は、450k、400k、300kでそれぞれ89.5、84.3、140.1%です。これらの結果は、450Kと400Kの熱変性状態では、天然構造(300K)に比べてそれぞれ63.4%と60.2%の割合で塩結合を形成していることを示しています。以上の結果から、450Kないしは400Kの熱変性状態でのEc0VV_6は、構造破壊の程度、二次構造の含量の差異に依らず、一定の割合のイオン対(塩結合)を維持していることが分かりました。
生理的条件下で天然構造と平衡にある変性構造は、モルテン・グロビュール状態[6]に近い構造で、αへリックスをも含むことが推定されています。本研究における2種の熱変性構造(450Kと400K)のいずれかが、天然構造と平衡にある変性構造に対応するかは判定できませんが、2種の構造が天然構造に比べて6割程度の適切なイオン対(塩結合)を形成していたことが示されました。
変性状態でのイオン対は変性構造の自由度を著しく阻害して、変性状態のエントロピー低下をもたらすと考えられます。つまり、多くの荷電性残基は変性状態でイオン対を形成し、揺らぎの自由度を制限し、エントロピー低下に寄与していると思われます。これが超好熱菌タンパク質に多数含まれている荷電性残基の熱安定化に果たす役割です。
今後の期待
本研究で明らかになった、天然状態と平衡にある変性構造でのイオン対形成(塩結合)がタンパク質の安定性に重要な役割を果たしているとする発想は、今後タンパク質の安定性を理解する上で、また熱安定性の高いタンパク質を設計する上で重要な指針を与えるものです。
特に、変性状態では天然状態に比べて大きく揺らいでいるために、変性状態でのイオン対形成は、特定のイオン対とのみ塩結合を形成する天然状態と異なり、イオン対を形成する残基が頻繁に交換されていると考えられます。そのため、変性状態のイオン対形成のための荷電性残基の配置は、必ずしも特定のペアとのイオン対形成を必要としないので、天然状態でのイオン対形成の設計に比べて、比較にならないほど容易なものとなります。このことにより、今後のタンパク質の熱安定化設計の指針は一段と精度の高いものになると期待できます。
原論文情報
Katsuhide Yutani, Yoshinori Matsuura, Hisashi Naitow, and Yasumasa Joti, “Ion–ion interactions in the denatured state contribute to the stabilization of CutA1 proteins”, Scientific Reports, 10.1038/s41598-018-25825-7
発表者
理化学研究所
放射光科学研究センター
嘱託職員 油谷 克英 (ゆたに かつひで)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 超好熱菌
- 80~90℃以上の温度を好んで生育する細菌のことで、それ以下の温度で生育する好熱菌とは区別される。超好熱菌由来のタンパク質は、常温生物、好熱菌由来のタンパク質に比べ、熱安定性が特段に高い。
-
- 荷電性残基
- 側鎖がイオン化するアミノ酸残基を荷電性残基と呼ぶ。イオン化して負荷電を持つアミノ酸残基にはアスパラギン酸(Asp)、グルタミン酸(Glu)が、イオン化して正電荷を持つアミノ酸残基にはアルギニン(Arg)、リシン(Lys)、ヒスチジン(His)がある。
-
- 塩結合
- 正と負の荷電性のアミノ酸(荷電性残基)間のイオン-イオン相互作用である。5~6オングストローム(Å)程度離れた距離まで相互作用が及ぶといわれている。超好熱菌が産出するタンパク質には荷電性残基が多く含まれ、安定化に重要な役割を果たしていると考えられているが、まだ不明なことが多い。
-
- 分子動力学(MD)シミュレーション
- タンパク質などの水溶液中での揺らぎ、動的環境を調べるためによく用いられる。経験的な力場を用いて、古典力学におけるニュートン方程式を数値解析により解くことで、各原子の位置と速度の時間展開を得ることで、その系の動的過程を解析する。MDはMolecular Dynamicsの略。
-
- エントロピー、ギブスエネルギー、エンタルピー
- ギブスエネルギー(G)、エンタルピー(H)、エントロピー(S)は、熱力学における物質の状態を表わす物理量である。タンパク質の変性が可逆的であれば、天然状態をN状態、変性状態をD状態とすると、タンパク質の変性は次式で表される。
N⇄D K = [D] / [N]
ここで、Kは平衡定数、[D]と[N]はDとN状態の濃度を示す。そこで、タンパク質の安定性の量的尺度である変性のギブスエネルギー変化(ΔG)は、平衡定数から次式によって求められる。ΔGは、正の値が大きいほど安定性が高い。
ΔG = – RT ln K
ここで、Rは気体定数、Tは絶対温度である。
他の熱力学的パラメータ、変性のエンタルピー変化(ΔH)と変性のエントロピー変化(ΔS)は次式で関係づけられる。
ΔG = ΔH – TΔS
ΔGがΔHかΔSのどちらの寄与によって、安定化(正の値の増加)されているかが分かれば、安定化のメカニズムが説明できる。
-
- モルテン・グロビュール状態
- 天然構造に比べ二次構造はあまり変化しないのに三次構造が壊れた、慣性半径が少し増加した状態のこと。タンパク質の折れ畳みの初期過程を反映したものだと考えられている。生理的条件で天然状態と平衡にある変性状態の構造に近い。
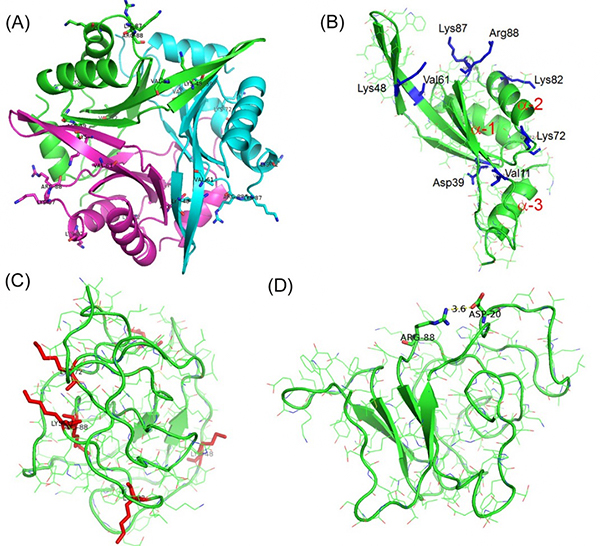
図1 大腸菌由来CutA1(Ec0VV_6)の分子動力学(MD)シミュレーション中の立体構造
(A) 天然状態(300K、約27℃)でのMDシミュレーション過程における20ns時点での三量体構造。
(B) 天然状態(300K、約27℃)でのMDシミュレーション過程における20ns時点での単量体構造。この図はA図の緑の部分に対応する。三つのαへリックスにα1、α2、α3の番号が付けられている。
(C) 450K(約177℃)でのMDシミュレーション過程における500ns時点での単量体構造。赤いスティックは6個のターゲットの荷電性残基(Arg88、Asp39、Lys48、Lys72、Lys82、Lys87)を示す。
(D) 450K(約177℃)でのMDシミュレーション過程における1254.4ns時点での単量体構造。Asp20とArg88とのイオン相互作用(塩結合)を示す。
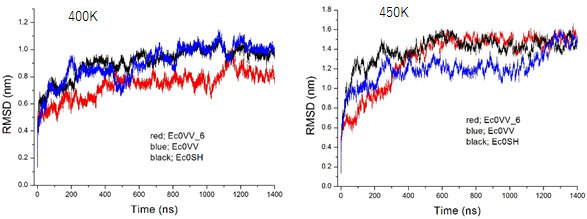
図2 3種の変異型Cα原子の400Kと450Kでの全原子の平均変化量の経時変化
400K(127℃)と450K(177℃)のどちらも、3種の変異型単量体の構造破壊は時間がたつにつれて進むが、200~400nsになると破壊の程度は一定値に達したことが分かる。縦軸、RMSDは天然構造のC原子が加熱によりどの程度変化したかという指標。横軸は時間。
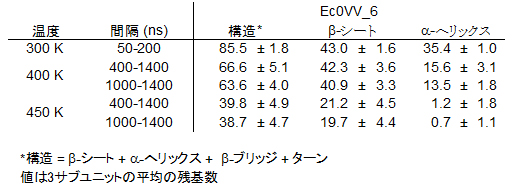
表1 MDシミュレーション中での二次構造を形成する残基数の変化(Ec0VV_6)
αへリックスは、400Kでは1,000~1,400nsの平均で天然構造のほぼ4割を維持しているが、450Kでは完全に構造破壊されたことが分かる。しかしαへリックスを除く、βシート、βブリッヂ、ターンは4割近く維持していた。
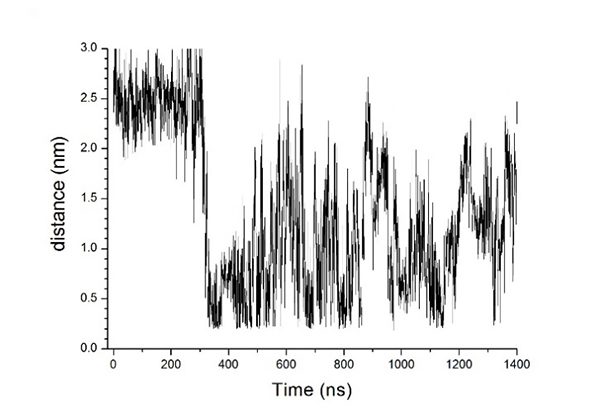
図3 MDシミュレーション中での荷電性残基間の距離の経時変化の一例
450KでのEc0VV_6に含まれるAsp39のCγ原子とLys87のCε原子間の距離の変化を示す。縦軸は目的の原子間の距離。横軸は時間。
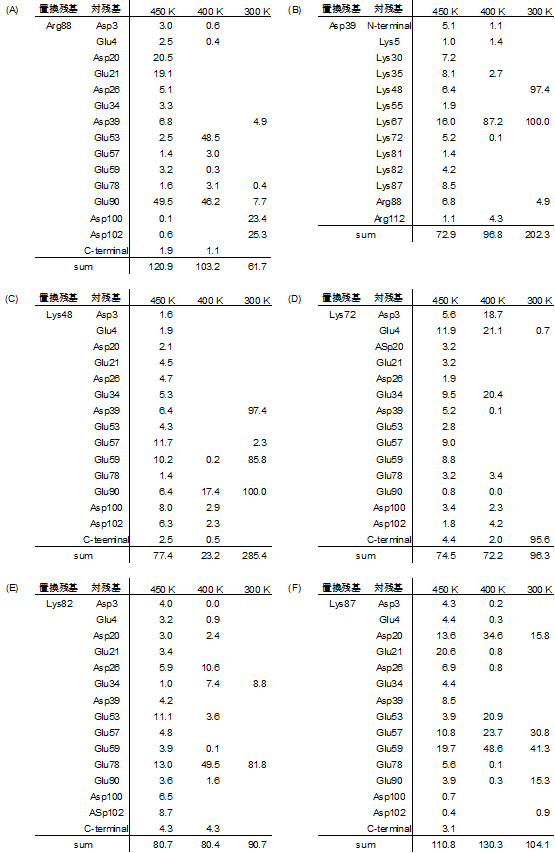
表2 Ec0VV_6の6種の荷電性残基の占有率(%)
450K、400K、300K MDシミュレーション中でのEc0VV_6の6種の荷電性残基(Arg88、Asp39、Lys48、Lys72、Lys82、Lys87)が形成する塩結合(0.6nm以下)の占有率(%)を示す。450Kと400Kの熱変性状態では、天然構造(300K)に比べてそれぞれ63.4%と60.2%の割合で塩結合を形成していた。