2020-08-06 理化学研究所
理化学研究所(理研)放射光科学研究センターNMR研究開発部門の大山貴子研究員と石井佳誉部門長、生命医科学研究センタートランスクリプトーム研究チームのピエロ・カルニンチチームリーダーらの国際共同研究グループは、翻訳段階でタンパク質合成を促進する「SINEUP[1]」と呼ばれる機能性長鎖ノンコーディングRNA[2]の機能ドメイン[1]の2次構造[3]を決定し、さらに活性部位を同定しました。
本研究成果は、抗体医薬[4]などに使われるタンパク質を培養細胞でより多く生産させたり、特定のタンパク質が体内で正常に合成されないために発症する遺伝病の治療薬への応用が期待できます。
近年、2万8,000種に上る長鎖ノンコーディングRNA[2]が報告されています。しかし、詳細な構造解析が難しいことから、長鎖ノンコーディングRNAがどのような作用機序で働いているかはよく分かっていませんでした。
今回、国際共同研究グループは、長鎖ノンコーディングRNAであるSINEUPの167塩基からなる機能ドメイン(SINE B2)について、核磁気共鳴(NMR)法[5]を用いた構造形成部位の解析と、生物学的手法を用いた配列変化と活性の相関解析を行いました。その結果、167塩基のうち塩基番号31番~119番の領域が構造を形成し、この部位に活性があることが分かりました。この成果は、NMR法が長鎖ノンコーディングRNAの原子レベルでの構造解析に有効であることを示しており、SINEUPの作用機序解明の第一歩となるものです。
本研究は、科学雑誌『Nucleic Acids Research』のオンライン版(7月22日付)に掲載されました。
背景
ヒトなど動物の細胞中には、遺伝子をコードしていない「ノンコーディングRNA(ncRNA)」と呼ばれるRNAが大量に存在します。ncRNAのうち200塩基より長いものは長鎖ノンコーディングRNA(lncRNA)と呼ばれ、ヒトでは約2万8,000種ものlncRNAが存在することが分かっています。
ncRNAが生命活動に必須なタンパク質の合成(転写や翻訳)の制御に関与していることは示されつつありますが、ncRNAがどのように働くのかについてはほとんど解明されていません。例えば「SINE[6](短鎖散在反復配列)」と呼ばれるncRNAは、ヒトゲノムに13.5%の割合で含まれていますが、大量に存在する理由やどんな機能があるのかはあまり分かっていません。
近年、このSINEの一つである「SINE B2」が、翻訳の段階で標的タンパク質の合成を促進させるアンチセンスlncRNAに機能ドメインとして含まれていることが判明し、このlncRNAは、SINE B2がタンパク質翻訳量をUP(向上)させることから「SINEUP(サインアップ)」と名付けられました注1)。SINEUPの詳しい作用機序が解明されれば、SINEの機能解明に限らず、例えば特定のタンパク質が正常に合成できないために発症する遺伝病の治療や抗体医薬の大量生産への応用が期待されます。
分子の作用機序は局所的な化学反応のリレーによるものであるため、解析には分子の化学構造の詳細を知ること(構造解析)が重要です。生体分子の構造解析の手法は主に、X線結晶構造解析[7]、核磁気共鳴(NMR)法、低温電子顕微鏡法[8]の三つがあります。しかしRNAは、結晶化しにくいことからX線結晶構造解析には向かず、分子中の水素原子が多くないためにNMR法にも適さず、低温電子顕微鏡法で扱うには分子量が小さすぎるといった理由から、特に100塩基を超えるRNAはいずれの手法を用いても構造解析が困難でした。このためlncRNAの詳細な構造を調べた例は、これまでほとんどありませんでした。
注1)2012年10月25日プレスリリース「タンパク質合成を促進するアンチセンスRNAを初めて発見」
研究手法と成果
国際共同研究グループは、lncRNA SINEUPの機能ドメインである167塩基のSINE B2配列について、NMR法を用いて構造形成部位と活性部位の同定を行いました。
まず、SINE B2の構造形成部位を調べるために、RNA鎖の5′末端[9]と3′末端[9]を10塩基単位で切断したRNA断片を調製し、SINE B2の全長RNAと断片RNAとのNMRスペクトルを比較しました。RNAには、2次構造の塩基対を形成したときにだけ、NMRシグナルが出現するイミノ基(=N-H、塩基対に使われる)の水素があります。このイミノ基の水素の化学シフト[10]値は構造に依存するため、同じ構造であれば化学シフト値は同じですが、異なる構造をしている場合は化学シフトも異なります。この性質を用いて、SINE B2の全長RNAと同じ構造を持つ断片RNAをうまく選択することで、SINE B2全長RNAのどの領域に断片RNAの構造が形成されているかを判別することにしました。SINE B2を3種類の断片RNA(A~C)に分割した結果、A~Cがそれぞれ全長RNAの一部分の構造を保っていることが分かりました(図1)。この解析から、SINE B2は図1の紫・青・緑・黄緑の四つのドメインで構成されていることが示されました。
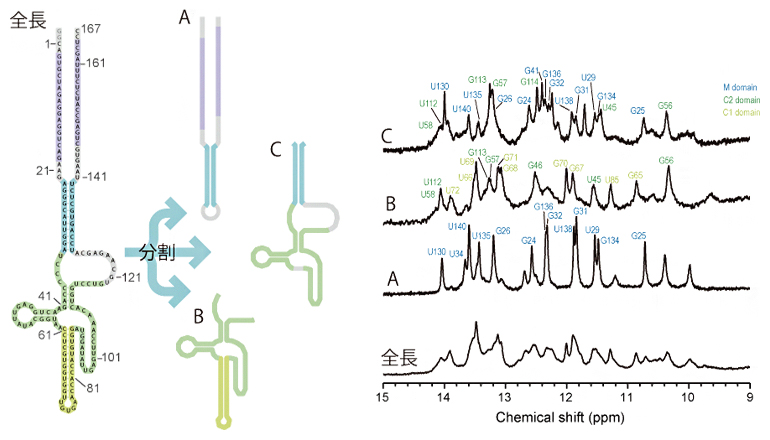
図1 SINE B2の断片化の模式図(左)と各断片のNMRスペクトル(右)
左:167塩基からなるSINE B2全長RNAには、紫、青、緑、黄緑で色分けした四つのドメインがあり、A(紫と青)、B(緑と黄緑)、C(青と緑)の3種類の断片RNAに分割した。灰色の部分はリンカー領域。
右:A~CのそれぞれのNMRスペクトルは、全長RNAの一部と同じ構造を保っていることが分かった。
また、SINE B2全長RNAと塩基番号31番~119番(B領域)のRNAについて、SINEUPの活性を調べたところ、B領域だけでもSINE B2全長の8割程の活性を維持していることが分かりました。この領域がSINEUP活性に大きく関与していると考えられます。
さらに、B領域について詳しくNMR法で解析したところ、43番~58番の領域が117番~119番の領域と2次構造あるいは3次構造[3]を形成して、B領域全体が複雑な立体構造になっている可能性が示唆されました。また、細胞中で実際にどの部位が2次構造形成しているかを解析するicSHAPE[11]における結果とNMR法で得られた2次構造が一致していることも分かりました。
今後の期待
作用機序を詳しく解析するためには立体構造解析が重要であり、今回の研究ではその足掛かりとなる2次構造を決定することができました。今後は、SINE B2のさらに詳細な立体構造解析を行い、SINEUPの作用機序の解明を目指します。これにより、抗体医薬として使われるタンパク質を大量生産する際に通常よりもより多くタンパク質を生産したり、特定のタンパク質が正常に合成されないために発症する遺伝病の治療薬としての応用が期待できます。
補足説明
1.SINEUP、機能ドメイン
SINEUPは、マウスのUchl1遺伝子のアンチセンスRNAがUchl1タンパク質の合成を促進する現象の発見をきっかけに見いだされた新しいタイプの長鎖ノンコーディングRNA。SINE因子の配列を持ち、タンパク質翻訳を促進する「機能ドメイン」と、標的mRNAと相補的な配列を持つ「結合ドメイン」の二つで構成される。任意の標的mRNAからのタンパク質翻訳を促進することができるツールとして使うことができるため、研究用試薬やタンパク質製造ツールから核酸医薬まで、幅広い応用が進んでいる。SINEUPはSINE element-containing translation UP-regulatorの略。
2.ノンコーディングRNA、長鎖ノンコーディングRNA
ノンコーディングRNAは、遺伝子をコードしていないRNA全般を指す。転位RNA(tRNA)やリボソームRNA(rRNA)もノンコーディングRNAの一種である。トランスクリプトーム解析により、ヒト細胞中に存在するRNAの7割がノンコーディングRNAであること、ヒトゲノムの9割以上のノンコーディング領域がRNAに転写されることが近年になって示された。転写、RNAプロセッシング、RNA分解、翻訳などの遺伝子発現のさまざまな段階に影響を与える。ノンコーディングRNAのうち、200塩基以上のものを長鎖ノンコーディングRNAという。
3.2次構造、3次構造
RNAの2次構造は、塩基対の形成を指す。RNAは通常のグアニン(G)-シトシン(C)、アデノシン(A)-ウラシル(U)間のワトソンクリック型塩基対のほかに、G-UやU-Uなどの非ワトソンクリック型塩基対が形成されることがある。RNAの3次構造は、水素結合により形成される3次元的な立体構造を指す。
4.抗体医薬
抗体は、抗原に対して非常に強く結合するタンパク質である。疾患と関連した抗原に特異的に結合する抗体は治療効果を示す。抗体医薬は、がんやリウマチなどの治療に用いられるが、副作用の少ない効果的な治療薬として注目されており、病気と関連する抗原の探索も行われている。
5.核磁気共鳴(NMR)法
強い磁場中に置かれた原子核に電磁波を照射すると、核スピンの共鳴現象により、原子核の性質や周囲の環境に応じた周波数(共鳴周波数)の電磁波の吸収や放出が起こるが、その電磁波をNMR信号として捉えることで、物質の分子構造の解析や物性の解析を行う手法。分子の相互作用などの情報も得られるため、生命科学、医薬、化学、食品、材料物性といった幅広い分野で利用されている。NMRはNuclear Magnetic Resonanceの略。
6.SINE
SINEは短鎖散在反復配列とも呼ばれる。ゲノムの特定の塩基配列がコピーされ、これが再びゲノムに挿入されたもの。生物進化の過程において、ある生物のゲノムの特定の場所にSINEが挿入されると、これが子孫に受け継がれる。このことから、多数の生物のSINEを分析すると系統関係が分かる。SINEは、short interspersed nuclear elementの略。
7.X線結晶構造解析
対象とする分子などの結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、物質内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質などの複雑な分子の立体構造を詳細に知ることができる。
8.低温電子顕微鏡法
タンパク質などの生体分子を急速に凍結させ、電子顕微鏡で観察する手法。分子を染色しないため、観察像は自然に近い状態を反映していると考えられている。
9.5′末端、3′末端
RNAはヌクレオシドの2′-リボースの5’位のヒドロキシ基と3’位のヒドロキシ基がリン酸ジエステル結合によって連結されてできている。RNAの5’位のヒドロキシ基側を5’末端と呼び、3’位のヒドロキシ基側を3’末端と呼ぶ。RNAの5’末端はDNA上の転写開始点に相当する。
10.化学シフト
NMR法では、同じ原子核でも原子核がおかれた磁場環境の違い(化学結合状態など)によって共鳴周波数がわずかに異なる。この周波数の違いは化学シフトと呼ばれ、分子を構成する原子核それぞれに独自性を与える。また、化学シフトは、磁場環境の違いを反映した物理量であり、豊富な構造情報を持っている。
11.icSHAPE
生細胞内に発現するRNAの2次構造を1塩基ごとにトランスクリプトームレベルで決定する技術。方法としては、RNAの1本鎖領域をNAI-N3で修飾し、逆転写反応により修飾された部位をcDNAとして回収する。次世代シーケンサーとバイオインフォマティクスの技術を組み合わせ、修飾部位を解読することで、標的RNAの2次構造を決定する。icSHAPEはin vivo click selective 2-hydroxyl acylation and profiling experimentの略。
国際共同研究グループ
理化学研究所
放射光科学研究センター NMR研究開発部門
部門長 石井 佳誉(いしい よしたか)
(東京工業大学 生命理工学院 教授)
NMR応用・利用グループ NMR先端応用・外部共用チーム
研究員 大山 貴子(おおやま たかこ)
次世代NMR装置開発チーム
チームリーダー 山崎 俊夫(やまざき としお)
生命医科学研究センター トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
特別任期制研究員 高橋 葉月(たかはし はづき)
研究員 ハルシタ・シャルマ(Harshita Sharma)
イタリア工科大学 Central RNA Laboratory部門
部門長 ステファノ・グスティンチッチ(Stefano Gustincich)
研究支援
本研究は、科学技術振興機構(JST)未来社会創造事業大規模プロジェクト型「高温超電導線材接合技術の超高磁場NMRと鉄道き電線への社会実装(研究代表者:前田秀明)」、日本学術振興会(JSPS)科学研究費補助金若手研究「タンパク質の翻訳を促進するレトロトランスポゾンSINEの作用機序の解明(研究代表者:高橋葉月)」、日本医療研究開発機構(AMED)革新的バイオ医薬品創出基盤技術開発事業「タンパク質翻訳を促進する新規ノンコーディングRNAを用いた革新的創薬プラットフォームの構築(研究代表者:ピエロ・カルニンチ)」による支援を受けて行われました。
原論文情報
Ohyama, Takako; Takahashi, Hazuki; Sharma, Harshita; Yamazaki, Toshio; Gustincich, Stefano; Ishii, Yoshitaka; Carninci, Piero, “An NMR-based approach reveals the core structure of the functional domain of SINEUP lncRNAs”, Nucleic Acids Research, 10.1093/nar/gkaa598
発表者
理化学研究所
放射光科学研究センター NMR研究開発部門
部門長 石井 佳誉(いしい よしたか)
NMR応用・利用グループNMR先端応用・外部共用チーム
研究員 大山 貴子(おおやま たかこ)
生命医科学研究センター トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
報道担当
理化学研究所 広報室 報道担当