慢性腎臓病の新たな予防法開発への期待
2020-08-17 名古屋大学,九州大学,日本医療研究開発機構
名古屋大学環境医学研究所/医学系研究科の菅波孝祥教授、田中都講師、丸山彰一教授、坂(田中)まりえ研究員、および九州大学大学院医学研究院の小川佳宏教授を中心とする研究グループは、急性腎障害から慢性腎臓病への病態の進展に、マクロファージに発現するMincle(macrophage-inducible C-type lectin)が関わることを明らかにしました。急性腎障害は様々な原因により急激に腎機能が低下する状態で、患者の半数程度は腎機能が一旦回復しますが、中長期的には高い確率で慢性腎臓病に移行することが明らかになり、この病態メカニズムが注目を集めています。一方、Mincleはマクロファージの細胞膜上に発現する膜タンパクで、従来、結核菌や病原性真菌に対する病原体センサーとして、感染防御に働くことが知られていました。研究グループは、マウス急性腎障害モデルを用いて、Mincleが壊死尿細管を感知して腎障害の慢性化に働くことを見出し、急性腎障害から慢性腎臓病への移行メカニズムの一端を明らかにしました(概念図)。
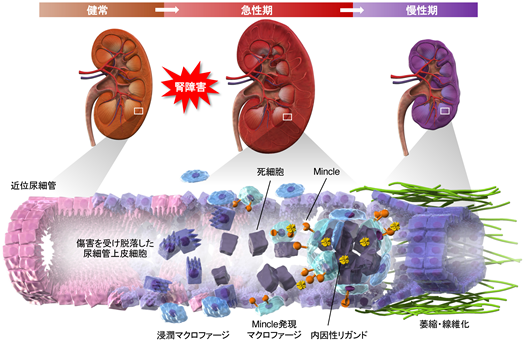
概念図 急性腎障害から慢性腎臓病への移行メカニズム―Mincleによる壊死尿細管の感知と炎症の慢性化―
本研究成果は、国際科学誌Journal of Experimental Medicineに掲載されました(2020年8月14日付)。
ポイント
- マウス急性腎障害モデルにおいて、マクロファージに発現するMincleが壊死尿細管を感知することにより、炎症が慢性化することを見出しました。
- Mincleは、壊死尿細管に蓄積するβ-グルコシルセラミドと遊離コレステロールを認識することを明らかにしました。
- Mincleが活性化すると、マクロファージの炎症性サイトカイン産生が増加するとともに、死細胞の貪食が抑制されました。
- Mincleを欠損するマウスは、急性腎障害が早期に収束し、慢性腎臓病への進展が予防されました。
背景
急性腎障害は、様々な原因により急激に腎機能が低下する状態で、入院患者の3.5%に発症するなど比較的高頻度に認められる腎疾患です。患者の半数程度は腎機能が一旦回復しますが、最近、実は腎臓にはダメージが蓄積しており、中長期的には高い確率で慢性腎臓病(注1)や末期腎不全に移行することが明らかになって、この病態メカニズムが注目を集めています。これまでに、炎症の慢性化や線維化、血管障害などのメカニズムが提唱されていますが、その詳細は分かっていません。人口の高齢化や糖尿病など生活習慣病の増加、集中治療領域の発達、造影剤の使用や癌症例の増加などに伴って、わが国においても急性腎障害の発症頻度は増加傾向にあり、その対策は喫緊の課題です。
Mincle(macrophage-inducible C-type lectin)は、炎症刺激によりマクロファージにおいて発現が強く誘導される分子として、1999年に発見されました。その後、Mincleは、結核菌や病原性真菌に対する病原体センサーであることが報告されました。即ち、マクロファージの細胞膜上に局在するMincleが病原体を認識すると、細胞内にシグナルが伝達され、炎症性サイトカインを産生することにより、生体の感染防御に働くことが分かっています。一方、Mincleは、死細胞に対するセンサーであることも明らかにされており、研究チームは既に、肥満で生じる脂肪組織の慢性炎症において、Mincleが重要な役割を担うことを報告しています(注2)。
研究成果
本研究では、腎虚血再灌流によるマウス急性腎障害モデル(注3)を用いました。このモデルでは、腎臓の近位尿細管(注4)と呼ばれる部位に強い障害が生じ、近位尿細管の壊死、炎症細胞の浸潤、血管障害などにより急速に腎機能が悪化します。障害は一過性で、数時間~1日をピークとして、その後は徐々に回復しますが、喪失した近位尿細管は十分に再生・修復せず、腎萎縮に至ります。そこで、急性期(~1日)、修復期(3~5日)、慢性期(7~14日)において、Mincle欠損マウスと対照(野生型)マウスの腎病変を比較することにより、腎障害の慢性化におけるMincleの意義を検討しました。
Mincleと腎障害の慢性化
対照マウスでは、腎障害6日目までに約半数が死亡しましたが、Mincle欠損マウスでは全例が生存しました(図1)。興味深いことに、急性期は腎障害の程度に差はなく、修復期~慢性期にかけてMincle欠損マウスでは速やかに炎症が軽減しました。慢性期において、対照マウスでは健常な近位尿細管数が著しく減少し、腎重量も約6割に減少しましたが、Mincle欠損マウスでは健常近位尿細管が残存し、腎重量も保たれました(図1)。このようにMincleは、腎障害の急性期ではなく、修復期~慢性期における持続的な炎症に関わることが明らかになりました。
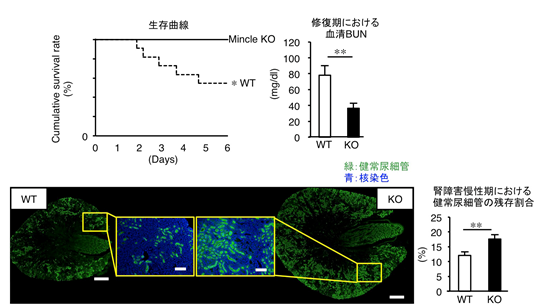
図1 腎障害時におけるMincle欠損マウスと対照(野生型)マウスの比較WT:対照(野生型)のマウス、Mincle KO(KO):Mincle欠損マウスを示す。
左上:腎障害後の生存曲線。
右上:修復期における血清BUN(尿素窒素)。血清BUNは腎機能を示し、腎機能が低下すると上昇する。
左下:慢性期の腎組織像。KOマウスでは、健常な近位尿細管(緑)が保たれている。
Mincleによる壊死尿細管の感知
組織学的な解析により、Mincleを発現するマクロファージは、細胞死に陥った近位尿細管(壊死尿細管)の周囲に集積することが明らかになりました。即ち、Mincleは壊死尿細管を感知して、腎障害の慢性化に働くことが想定されました。そこで、壊死尿細管からMincleを活性化する因子(内因性リガンド(注5))を探索しました。具体的には、障害腎より抽出した脂溶性成分をカラムにより分画し、Mincle活性能を指標として質量分析で同定しました。その結果、β-グルコシルセラミドという糖脂質とコレステロールが共存することで、強いMincle活性化能を示す(Mincleリガンドとなる)ことを見出しました。実際、障害腎の壊死尿細管部位にβ-グルコシルセラミドとコレステロールが蓄積することを組織染色により確認しました(図2)。
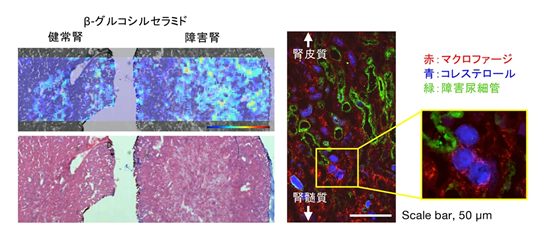
図2 腎障害の組織学的解析:Mincleによる壊死尿細管の感知左:β-グルコシルセラミドの検出
上:健常腎と障害腎の質量分析イメージング。障害腎においてβ-グルコシルセラミドが増加
下:ヘマトキシリン・エオジン(HE)染色(病理組織像の確認用)
右:障害腎の免疫染色像
壊死尿細管部位にコレステロール(青)が凝集し、周囲をマクロファージが取り囲んでいる。
Mincleとマクロファージ機能
従来、Mincleはマクロファージの炎症性サイトカイン産生を促進させることが知られていましたが、今回、研究チームは、Mincleがマクロファージによる死細胞の貪食を強く抑制することを新たに見出しました。死細胞は、DAMPs(注6)と呼ばれる炎症刺激因子を放出するため、通常、生体内において死細胞はマクロファージにより速やかに貪食・処理されます。Mincleの活性化により死細胞クリアランス(注7)が低下することで、死細胞が長期間残存し、炎症が増悪すると想定されます。実際、急性腎障害モデルの慢性期において、Mincle欠損マウスでは、炎症サイトカインの発現や死細胞の数が対照マウスよりも減少していました。
今後の展開
本研究では、マウス急性腎障害モデルを用いて、Mincleが急性腎障害の慢性化に関わることを明らかにしました。これまでは、主に腎障害の急性期に関する研究が精力的に行われてきましたが、Mincleは修復期~慢性期に作用する点がユニークと言えます。現在、病態メカニズムに基づいた急性腎障害の治療は存在せず、その対応は喫緊の課題となっています。しかしながら、急性腎障害は急激に発症するため、ヒトにおいて病初期に治療介入することは困難とされています。また、急性腎障害から慢性腎臓病への移行メカニズムも、十分に分かっていません。本研究の成果を踏まえて、修復期~慢性期のMincleを標的とすることは、今後の治療戦略を考える上で有用と考えられます。さらに、新たに同定したβ-グルコシルセラミドなど内因性リガンドは、急性腎障害の病勢や予後を反映するバイオマーカーとなる可能性があります。今後は、Mincleの作用に関する詳細な分子機序を解明するとともに、臨床サンプルを用いて急性腎障害の診断や治療における意義を検証する予定です。
用語説明
- (注1)慢性腎臓病:
- 種々の原因により腎機能の低下や蛋白尿が持続する状態。近年、メタボリックシンドロームの増加に伴って、慢性腎臓病の頻度は増加しています。慢性腎臓病は、末期腎不全のリスクとなることに加えて、心筋梗塞や脳卒中など心血管疾患の危険因子となります。
- (注2)肥満とMincle:
- 研究チームは既に、肥満の脂肪組織においてMincleが高発現することを見出し、慢性炎症や組織線維化に働くことを報告しました。特に、脂肪組織の線維化が、脂肪肝の新たな病態メカニズムであることを明らかにしました。
- (注3)腎虚血再灌流によるマウス急性腎障害モデル:
- 腎動脈を一時的に遮断した後に開放することにより、腎臓に急性の障害を惹起する疾患モデル。急性腎障害の最も一般的な動物モデルであり、腎移植や開心術に伴う腎障害などを反映している。
- (注4)近位尿細管:
- 尿細管は、血液中から濾過された原尿(尿の元になる)が通過する管状構造の組織です。原尿が尿細管を通過する際に、水分や電解質、老廃物などが再吸収、あるいは排泄されて尿となります。尿細管の入り口部分に相当する近位尿細管は、活発に再吸収や排泄を行っており、虚血再灌流により最も強く障害を受けます。
- (注5)内因性リガンド:
- 内因性とは生体に由来することを、リガンドとはセンサーや受容体に作用する物質を意味します。これまでに、結核菌に由来するTrehalose-6,6-dimycolateなどの糖脂質が、Mincleを活性化する外来性リガンドとして報告されています。一方、障害腎では、壊死尿細管に由来する内因性リガンドがMincleを活性化すると想定されます。本研究により初めて、病態モデルから内因性Mincleリガンドが同定されました。
- (注6)DAMPs:
- damage-associated molecular patterns(ダメージ関連分子パターン)の略。死細胞やダメージをうけた細胞から放出される因子で、炎症細胞を活性化し、種々の生体応答を誘導するアラームとして機能します。
- (注7)死細胞クリアランス:
- 通常、死細胞はマクロファージなどにより速やかに貪食・処理される(クリアランス)。この過程に障害が生じると、死細胞が残存して、死細胞が放出するDAMPs(注6)により周囲に炎症が惹起される。
発表雑誌
- 雑誌名:
- Journal of Experimental Medicine 217: August 14, 2020
- 論文タイトル:
- C-type lectin Mincle mediates cell death–triggered inflammation in acute kidney injury
- 著者:
- Miyako Tanaka1,2, Marie Saka-Tanaka1,3, Kozue Ochi1,2, Kumiko Fujieda1,2, Yuki Sugiura4, Tomofumi Miyamoto5, Hiro Kohda1,2, Ayaka Ito1,2, Taiki Miyazawa6, Akira Matsumoto6, Seiichiro Aoe7, Yoshihiro Miyamoto8, Naotake Tsuboi3,9, Shoichi Maruyama3, Makoto Suematsu4, Sho Yamasaki10, Yoshihiro Ogawa1,11-13, Takayoshi Suganami1,2
- 所属:
-
- Department of Molecular Medicine and Metabolism, Research Institute of Environmental Medicine, Nagoya University, Nagoya, Japan.
- Department of Immunometabolism, Nagoya University Graduate School of Medicine, Nagoya, Japan.
- Department of Nephrology, Nagoya University Graduate School of Medicine, Nagoya, Japan.
- Department of Biochemistry, Keio University School of Medicine, Tokyo, Japan.
- Department of Natural Products Chemistry, Graduate School of Pharmaceutical Sciences, Kyushu University, Fukuoka, Japan.
- Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University, Tokyo, Japan.
- Department of Home Economics, Otsuma Women’s University, Tokyo, Japan.
- Division of Genomic Diagnosis and Healthcare, National Cerebral and Cardiovascular Center, Suita, Japan.
- Department of Nephrology, Fujita Health University School of Medicine, Toyoake, Japan.
- Department of Molecular Immunology, Research Institute for Microbial Diseases, Osaka University, Osaka, Japan.
- Department of Medicine and Bioregulatory Science, Graduate School of Medical Sciences, Kyushu University, Fukuoka, Japan.
- Department of Molecular and Cellular Metabolism, Graduate School of Medical and Dental Sciences, Tokyo Medical and Dental University, Tokyo, Japan.
- Japan Agency for Medical Research and Development, CREST, Tokyo, Japan.
- DOI:
- 10.1084/jem.20192230
研究支援
本研究は、国立研究開発法人日本医療研究開発機構・革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「腎臓病において組織障害と修復を制御する微小環境の解明と医学応用」(研究開発代表者:京都大学医学研究科柳田素子教授)、「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域における研究開発課題「細胞間相互作用と臓器代謝ネットワークの破綻による組織線維化の制御機構の解明と医学応用」(研究開発代表者:九州大学医学研究院小川佳宏教授)、日本学術振興会・科学研究費助成事業、ならびに公益財団法人堀科学芸術振興財団、公益財団法人武田科学振興財団などの支援を受けて行われたものです。
※菅波教授は、AMED-CRESTの研究開発課題における研究開発分担者です。
お問い合わせ先
研究について
名古屋大学環境医学研究所 分子代謝医学分野
名古屋大学大学院医学系研究科 免疫代謝学
教授 菅波孝祥(スガナミタカヨシ)
広報担当
名古屋大学医学部・医学系研究科総務課総務係
九州大学広報室
AMED事業について
国立研究開発法人日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課