複数の疾患に対する新しい治療薬の候補を発見
2021-03-19大阪大学,日本医療研究開発機構
研究成果のポイント
- 疾患のリスクを有する遺伝子多型※1が遺伝子の発現量※2に与えるメカニズムと、約20,000種類の薬剤が遺伝子の発現量に与えるメカニズムを統合し、コンピューター上で治療薬剤候補を網羅的にスクリーニング※3するゲノム創薬手法(Trans-Phar)を新たに開発した。
- Trans-Pharを数十万人規模の疾患ゲノム情報に適用することにより、新しい治療薬剤候補を見出した。
- 疾患ゲノム情報に基づいた新たな治療薬剤の発見や、既に使用されている薬剤の別の疾患への適用(ドラッグ・リポジショニング※4)につながると期待される。
概要
大阪大学大学院医学系研究科の岡田随象教授(遺伝統計学)、日本たばこ産業株式会社医薬総合研究所小沼貴裕研究員らの研究グループは、疾患のリスクを有するゲノム配列の違い(遺伝子多型)の情報を活用して、疾患治療において効果的と考えられる薬剤をコンピューター上でスクリーニングするゲノム創薬手法(Trans-Phar;integration of Transcriptome-wide association study and Pharmacological database)を新たに開発しました(図1)。さらに、その手法を数十万人規模の疾患ゲノム情報に適用することで、新しい治療薬剤候補を見出しました。
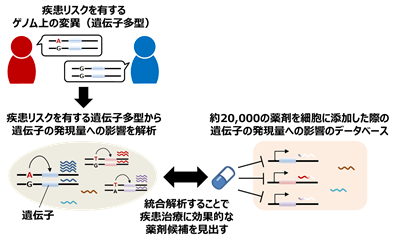
図1 本研究で新しく開発したゲノム創薬手法(Trans-Phar)
近年、ヒトゲノムデータの蓄積に従い、疾患リスクを有する遺伝子多型を同定する、ゲノムワイド関連解析(GWAS;genome-wide association study)※5が様々な疾患で実施されています。一方で、薬剤を細胞に添加した効果を網羅的に調べたデータベースが公開されるなど、薬剤のデータベースも充実しています。しかし、GWAS研究の成果と薬剤データを統合的に活用して、新たな治療薬剤を網羅的に探索するような、ゲノム創薬手法はこれまで開発されていませんでした。
今回、岡田教授らの研究グループは、GWASで同定された疾患リスクを有する遺伝子多型が、遺伝子の発現量に与える影響について調べました。さらに、約20,000種類の薬剤が様々な遺伝子の発現量に与える影響が収載されている大規模な薬剤データベースと統合することで、疾患における遺伝子の発現量変化を抑制するような薬剤を網羅的に探索するゲノム創薬手法(Trans-Phar)を新たに開発しました。Trans-Pharを、数十万人規模の疾患ゲノム情報に適用することで、疾患に有効と期待される新たな治療薬剤候補を見出しました。Trans-Pharの開発により、これまで薬剤開発が難航していたような疾患も含め、幅広い疾患における新しい薬剤の開発につながる可能性が期待されます。
本研究成果は、英国科学誌「Human Molecular Genetics」に、2021年3月19日(金)0時(日本時間)に公開されます。
研究の背景
大規模なヒトゲノム研究を通じて、ゲノム上の多様性がどのように疾患に影響を与えているかについて全体像が明らかになってきています。そして、疾患ゲノム研究の成果を創薬に活用する、ゲノム創薬※6の発展が期待されています。疾患ゲノム情報の裏付けがある治療標的を持つ薬剤は、その開発の成功率を数倍増加させることが近年報告されており、ゲノム創薬はますます注目を集めています。
疾患リスクを有する遺伝子多型を同定するゲノムワイド関連解析(GWAS)により、疾患リスクを有するゲノム上の変異が多数存在し、その多くは、様々な遺伝子の発現量を変えるメカニズムを持っていることが明らかになりました。一方で、薬剤のデータベースも近年充実しており、薬剤が遺伝子の発現量に与える効果を大規模に調べたデータベースが公開されています。疾患ゲノム情報に基づく遺伝子の発現量の変化と、薬剤による遺伝子発現量の変化の2つのメカニズムを統合して考えることは、疾患治療に効果的な薬剤を見出す上で有効と考えられてきましたが、そのようなゲノム創薬手法はこれまで開発されていませんでした。
今回、様々な疾患について、疾患リスクを有する遺伝子多型が遺伝子の発現量に与える影響を解析し、その影響を抑制するような薬剤をコンピューター上で網羅的に探索することで、その疾患治療に効果的な薬剤を見出すゲノム創薬手法の開発を行いました。
本研究の成果
今回、本研究グループは、数十万人規模のGWASで同定されてきた、疾患リスクを有する遺伝子多型について、遺伝子の発現量に与える影響を網羅的に解析しました。さらに、約20,000種類の薬剤が様々な遺伝子の発現量に与える影響が収載されている大規模な薬剤データベースを活用して、疾患における遺伝子の発現量に与える影響を抑制することで、薬剤を網羅的に探索する、新たなゲノム創薬手法(Trans-Phar)の開発に成功しました。Trans-Pharの開発により、治療薬剤候補を網羅的に探索することが可能となりました。
まず、Trans-Pharを、国際的に大規模なバイオバンク※7であるUKバイオバンク※8が保有する欧米人集団の30疾患のゲノム情報に適用することで、「効率的に疾患治療に効果を有する薬剤を探索可能かどうか」を検証しました。その結果、Trans-Pharにより治療に効果的であると同定された薬剤の中に、それらの30疾患について既に販売が承認されている(既に疾患に一定の効果があることが分かっている)薬剤が多く見出だされることが分かりました。つまり、開発したゲノム解析手法(Trans-Phar)は、治療に効果的な薬剤を精度よく同定することが出来ると考えられました。
さらに、18疾患における数十万人規模のゲノム情報に対してTrans-Pharを適用したところ、6疾患において、13種類の薬剤が治療に効果的であるとスクリーニングされました(図2)。これらの疾患の中には、筋委縮性側索硬化症(ALS;amyotrophic lateral sclerosis)※9のような、効果的な薬剤が少なく、薬剤開発の必要性が高い疾患も含まれており、Trans-Pharがそれらの疾患の薬剤開発の一助にもなると考えられました。また、今回検出された薬剤の中には、既に別の疾患を対象に承認されている薬剤も含まれていました。例えば、成人発症喘息に対して効果があると同定されたAzacitidine(アザシチジン)は、骨髄異形成症候群(myelodysplastic syndrome)※10等の治療に既に臨床で使用されています。このような薬剤は、既に治療で使用されている薬剤を別の疾患に対する治療薬としても開発すること(ドラッグ・リポジショニング)にも応用が期待でき、効率的な薬剤開発の一助にもなると考えられました。

図2 Trans-Pharの大規模ゲノム情報への適用により同定された新規治療薬剤候補
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、疾患に効果的な新たな薬剤の発見と開発への貢献が期待されます。例えば、これまで薬剤開発が難航していたような疾患も含めて、様々な疾患のゲノム情報にTrans-Pharを適用することで、新しい薬剤の開発につながる可能性が期待されます。さらに、Trans-Pharによって、これまで既に治療で使用されてきた薬剤が、別の疾患の治療にも効果的であることが予測できる可能性があることから、ドラッグ・リポジショニングへの活用も期待されます。
Trans-Pharで得られた新規治療薬剤候補については、細胞実験や動物実験などによるさらなる検証を進めることで、新規治療薬剤としての開発可能性をより詳細に検討することが可能となります。Trans-Pharは2020年8月から既にソフトウェアとしてウェブ上で一般公開しており(URL:https://github.com/konumat/Trans-Phar)、様々な疾患ゲノムデータにさらに広く適用されることにより、今後の新規治療薬剤候補の発見と開発へのより一層の貢献も期待されます。
特記事項
本研究成果は、2021年3月19日(金)0時(日本時間)に英国科学誌「Human Molecular Genetics」(オンライン)に掲載されます。
- タイトル
- “Integration of genetically regulated gene expression and pharmacological library provides therapeutic drug candidates”
- 著者名
- Takahiro Konuma1、2、Kotaro Ogawa1、3、Yukinori Okada1、4、5
- 所属
-
- 大阪大学大学院医学系研究科 遺伝統計学
- 日本たばこ産業株式会社 医薬総合研究所
- 大阪大学大学院医学系研究科 神経内科学
- 大阪大学免疫学フロンティア研究センター 免疫統計学
- 大阪大学先導的学際研究機構 生命医科学融合フロンティア研究部門
本研究は、日本医療研究開発機構(AMED)ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究開発:GRIFIN)における、研究開発課題「次世代ゲノミクス研究による乾癬の疾患病態解明・個別化医療・創薬」の一環として行われ、大阪大学大学院医学系研究科バイオインフォマティクスイニシアティブの協力を得て行われました。
用語説明
- ※1 遺伝子多型
- ゲノム配列の個体差のうち、集団中に一定以上の頻度存在するもののこと。中でもゲノム塩基配列中に一塩基が変異した多様性である一塩基多型(single nucleotide polymorphism;SNP)が代表的である。
- ※2 遺伝子の発現量
- 遺伝情報は、体内でDNA→RNA→タンパク質という流れで読み取られ発現する。遺伝子の発現とは、そのうち、DNA中の遺伝情報を有する領域(遺伝子)をRNAに写す過程であり、生成したRNA量が遺伝子の発現量となる。
- ※3 スクリーニング
- 薬学において、化合物や薬剤のデータベース情報などを用いて、取得したい性質を持つ薬剤を選抜すること。
- ※4 ドラッグ・リポジショニング
- ある疾患に既に有効であることがわかっている治療薬から、別の疾患にも有効である治療薬を見出すこと。特に、既に臨床使用が承認されている治療薬の場合は、ヒトでの安全性などの試験が済んでいるため、開発期間の短縮や開発コストの低減が期待できる。
- ※5 ゲノムワイド関連解析(GWAS;genome-wide association study)
- ヒトゲノム配列上に存在する数百万か所の遺伝子多型とヒト疾患との発症の関係を網羅的に検討する、遺伝統計解析手法。数千人から百万人を対象に大規模に実施されることで、これまで1,000を超えるヒト疾患に対する遺伝子多型が同定されている。
- ※6 ゲノム創薬
- ゲノム情報を利用して、疾患の原因となるゲノム領域や遺伝子に与える影響を解析し、その情報をもとに、その影響を制御するような薬剤を創ること。
- ※7 バイオバンク
- 疾患疫学や病態研究などを目的に、多数のヒトのDNA、血清、尿、組織などの検体を収集、蓄積、管理する施設のこと。近年では国家レベルで数十万人を対象とするバイオバンクが構築され、個人の検体とともに電子カルテ上の臨床情報やその後の予後などの追跡情報も蓄積される例が多い。
- ※8 UKバイオバンク
- 英国で実施されている国家的バイオバンク機構。ボランティア約50万人を対象に、ゲノム情報や数千の多彩な臨床情報、追跡情報を収集し、ほぼ無償で世界の研究者にデータの公開や分譲を行っている。
- ※9 筋委縮性側索硬化症(ALS;amyotrophic lateral sclerosis)
- 身体を動かすための神経系(運動ニューロン)が変性することで、筋肉が徐々に痩せていく疾患であり、治療法が確立されていない難病の一つとして指定されている。
- ※10 骨髄異形成症候群(myelodysplastic syndrome)
- 血液細胞(赤血球、血小板、白血球)のもととなる造血幹細胞に異常が生じ、血液中の血液細胞が減少する症候群。
本件に関するお問い合わせ先
研究に関すること
岡田随象(おかだゆきのり)
大阪大学 大学院医学系研究科 遺伝統計学 教授
報道に関すること
大阪大学大学院医学系研究科 広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課
ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究開発:GRIFIN)

