繊毛・べん毛の解析手法として新たな脊椎動物モデルを開発
2018-06-19 科学技術振興機構(JST),東京大学
- 繊毛、べん毛の構造解析には、無脊椎動物が主に利用されてきたが脊椎動物モデルの開発も求められていた。
- ゼブラフィッシュの精子べん毛を遺伝子操作、構造解析が可能な脊椎動物モデルとして開発し、それを使用して軸糸ダイニン構築メカニズムの一端を解明した。
- ヒトの繊毛、べん毛疾患(繊毛病)のモデルとして今後の活用が期待される。
JST 戦略的創造研究推進事業において、東京大学 大学院医学系研究科の吉川 雅英 教授と同大学院理学系研究科の武田 洋幸 教授らは、遺伝子操作を行ったゼブラフィッシュの精子べん毛について、はじめてクライオ電子顕微鏡法注1)を用いた微細構造解析を行い、軸糸ダイニン構築メカニズムの一端を明らかにしました。
繊毛、べん毛は単細胞生物から我々ヒトまで共通して存在する細胞小器官であり、精子の運動や、気管粘膜についたゴミの除去など、ヒトでも重要な役割を持っています。従来、繊毛、べん毛の構造解析にはクラミドモナスなどの単細胞生物や、ウニなどの無脊椎動物が主に利用されてきました。しかし、ヒトの繊毛、べん毛疾患(繊毛病)との関連から、よりヒトと遺伝子機能の共通性が高い、脊椎動物のモデル生物の開発も求められていました。
本研究グループは、実験動物としてすでに広く利用されている小型魚類のゼブラフィッシュに着目しました。ゼブラフィッシュはCRISPR/Cas9注2)を用いた遺伝子操作技術が確立されており、また精子の採集が容易であるという点で、繊毛、べん毛の脊椎動物モデルとして優れた特徴を有しています。
本研究では、繊毛病の原因遺伝子であるKTU、PIH1D3と、そのたんぱく質ファミリー遺伝子(PIH1D1、PIH1D2)についてゼブラフィッシュの変異体を作製し、クライオ電子顕微鏡法を用いて精子べん毛の微細構造を解析しました。その結果、変異体では繊毛、べん毛のモーター分子である軸糸ダイニンの構築ができなくなり、精子の運動に異常が生じることを明らかにしました。
本研究から、新たにPIH1D1、PIH1D2の2つの遺伝子が、その機能とともに繊毛病の原因遺伝子として示唆されました。脊椎動物モデルを使用した本成果は、繊毛病が生じるメカニズムを解明する上で、今後の研究に役立つ知見になると期待されます。
本研究成果は、2018年6月19日(英国時間)に国際科学誌「eLife」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長)
研究課題名:「べん毛・繊毛をターゲットとする細胞の構造生命科学」
研究代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
研究期間:平成26年10月~平成31年3月
繊毛、べん毛は細胞の表面から突き出した長い毛のような構造で、波打ち運動をすることで、細胞を移動させたり、細胞外の液流を生み出したりします。ヒトにおいては、精子がべん毛を使って泳ぐことや、気管に生えた繊毛が喉に侵入してきた異物を除去するなど、重要な働きをしています。繊毛、べん毛を動かしているのはその中に存在するモーター分子である「軸糸ダイニン」です。軸糸ダイニンの異常は、繊毛、べん毛運動の異常につながるため、男性不妊や慢性気管支炎などの原因となり、「繊毛病」と呼ばれるさまざまな症状の合併症を引き起こします。
繊毛、べん毛は単細胞生物から我々ヒトまで共通して存在しており、これまでその構造解析にはクラミドモナス(単細胞緑藻類)やウニの精子(無脊椎動物)が主に利用されてきました。軸糸ダイニンについては、特にクラミドモナスを用いた成果が多く、繊毛、べん毛の中に軸糸ダイニンが複数種類存在することや、それぞれの軸糸ダイニンが多くのたんぱく質から構成される巨大な複合体であることなどが分かっています。また、軸糸ダイニンが組み立てられる際には、「軸糸ダイニン組み立て因子」と呼ばれる別の因子が必要であることも分かっています。これらの軸糸ダイニンや軸糸ダイニン組み立て因子の遺伝子は、異常によって繊毛病の原因となるため、とても重要です。しかし、クラミドモナスの遺伝子がヒトの遺伝子と対応しない場合もあるため、ヒトにより近い、脊椎動物のモデル生物の開発も求められていました。
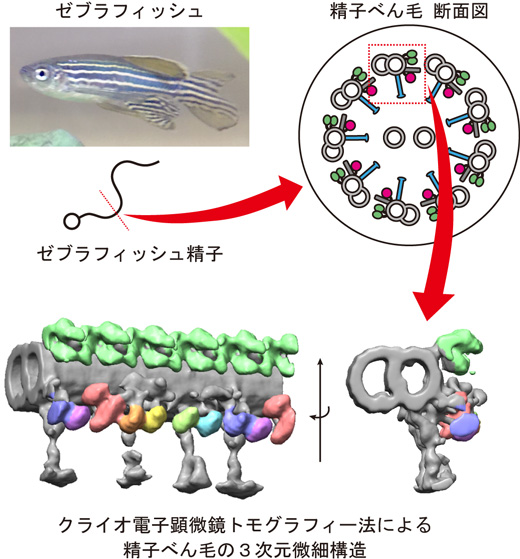
小型魚類のゼブラフィッシュは、脊椎動物のモデル生物として広く利用されている実験動物です。ゼブラフィッシュは、CRISPR/Cas9を用いた遺伝子操作技術が確立されており、すでに多くの研究で、ゼブラフィッシュが繊毛病のモデルとして用いられています。しかし、繊毛、べん毛の微細構造が遺伝子操作によってどのように変化するかは、今まで解析できていませんでした。そこで、本研究グループは、ゼブラフィッシュの精子に着目しました。ゼブラフィッシュの精子は、成魚を殺さずに、大量、安定に採取できるため、実験モデルとして優れています。また、遺伝子操作の影響を、精子の運動性の異常として容易に評価することができます。本研究では、ゼブラフィッシュの精子からべん毛を単離し、クライオ電子顕微鏡トモグラフィー法注3)を使用することで、世界で初めてその微細構造を明らかにすることに成功しました(図1)。
ゼブラフィッシュ精子べん毛の微細構造を観察する手法を開発したことで、繊毛病の原因遺伝子の機能をより詳細に解析することが可能になりました。そこで本研究では、繊毛病の原因遺伝子と考えられるPIHたんぱく質ファミリーの遺伝子について、ゼブラフィッシュの変異体を作製しました。PIHたんぱく質ファミリーのうち、KTU、PIH1D3は軸糸ダイニン組み立て因子として繊毛病の原因遺伝子であることが分かっています。一方、それ以外のPIHたんぱく質ファミリー遺伝子(PIH1D1、PIH1D2)については、機能が明らかになっていませんでした。クライオ電子顕微鏡トモグラフィー法を用いて精子べん毛の微細構造を解析したところ、どの変異体でも共通して軸糸ダイニンの構築に異常が生じるものの、軸糸ダイニンの欠損はそれぞれ異なる種類が影響を受けていることが分かりました(図2)。また、精子の運動を評価することで、それぞれの軸糸ダイニンの異常がべん毛運動に与える影響も明らかにしました。これらの結果から、すべてのPIHたんぱく質ファミリーが軸糸ダイニン組み立て因子であり、それぞれ異なる種類の軸糸ダイニンの組み立てに関与するというモデルを提唱しました。
本研究は、(1)ゼブラフィッシュの遺伝子操作、(2)クライオ電子顕微鏡トモグラフィー法による精子べん毛の微細構造解析、(3)精子の運動性の評価、の3つを組み合わせた点で、繊毛、べん毛の関連遺伝子の解析に対して新規な手法を提唱しています。本研究から、新たにPIH1D1、PIH1D2の2つの遺伝子が、その機能とともに、繊毛病の原因遺伝子として示唆されました。今後はゼブラフィッシュを使用した解析によって、さらに繊毛病の原因遺伝子の発見や、繊毛病が生じるメカニズムの理解が加速されることが期待されます。
![]()
図1
(上段)ゼブラフィッシュ精子と、その断面の模式図。
(下段)本研究から得られた、ゼブラフィッシュ精子べん毛の3次元微細構造。着色された部位は、繊毛、べん毛のモーター分子である軸糸ダイニンの構造を示す。8種類の異なる軸糸ダイニンが、それぞれ異なる色で着色されている。
![]()
図2 各変異体における精子べん毛の3次元微細構造
野生型の構造と比較して、赤丸で示した軸糸ダイニンが欠損していることが分かる。
- 注1)クライオ電子顕微鏡法
- 急速凍結によって非晶質の氷の中に試料を閉じ込め、電子顕微鏡で観察する技術。試料の染色や化学固定を行わないために、より生体内に近い状態の構造が観察できる。
- 注2)CRISPR/Cas9
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)と呼ばれるDNA配列、および、CRISPR関連たんぱく質Cas9(CRISPR-Associated Protein 9)によって構成される、原核生物の獲得免疫機構。CRISPR/Cas9によって任意のDNA配列の切断が可能なため、効率的な遺伝子操作(ゲノム編集と呼ばれる)が可能となった。
- 注3)クライオ電子顕微鏡トモグラフィー法
- クライオ電子顕微鏡法において、試料を傾斜連続撮影することで異なる角度からの投影像を収集し、それらを画像処理によって統合することで三次元構造を得る技術。
タイトル:“Systematic studies of all PIH proteins in zebrafish reveal their distinct roles in axonemal dynein assembly”
(ゼブラフィッシュのすべてのPIHたんぱく質は、軸糸ダイニン構築においてそれぞれ異なる機能を有する)
吉川 雅英(キッカワ マサヒデ)
東京大学 大学院医学系研究科 生体構造学分野 教授
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
科学技術振興機構 広報課
東京大学 大学院医学系研究科・医学部 総務係
東京大学 大学院理学系研究科・理学部 広報室