成人T細胞白血病の進展メカニズムの特定と早期診断法の開発にむけて
2021-08-19 東京大学
発表のポイント
◆ ヒトT細胞白血病ウイルスI型(HTLV-1、注1)に感染した細胞が、どのように成人T細胞白血病リンパ腫(ATL、注2)細胞に進化したのかを追跡し、変異パターンの異なる不均一な感染細胞集団から、遺伝子異常によって特定の細胞が増悪する過程を詳細に示しました。
◆ シングルセル解析技術(注3)を駆使することで、遺伝子異常を持つ個々のATL細胞の性質を調べました。遺伝子変異と遺伝子制御異常によって形成されたATL細胞は、変異パターンに対応した特性を保持していることを発見しました。
◆ 発症前から徐々に進化していく過程を詳細に解析することで、がんの進化の過程を明らかにしました。早期のゲノム解析の重要性が示されたことから、予後不良な腫瘍性疾患に対するゲノム医療の加速が期待されます。
発表概要
がん、白血病、悪性リンパ腫は、無数の前がん状態の細胞にDNAの異常が蓄積して、徐々に悪性度の高いがん細胞へと進化することによって発症します。東京大学大学院新領域創成科学研究科の山岸誠特任講師、内丸薫教授、鈴木穣教授らの研究グループは、ヒトT細胞白血病ウイルスI型(HTLV-1)に感染したHTLV-1キャリア(注4)の体内で、長い年月をかけて感染細胞から悪性度の高い成人T細胞白血病リンパ腫(ATL)へ進化する過程に注目し、どのように白血病細胞へ進化するか、シングルセル解析技術を駆使して解析しました。
その結果、発症前からDNAに変異をもった性質の異なる多様な感染細胞が混在することを発見しました。その後、特定のDNAに変異が加わったより悪性度の高い腫瘍細胞が出現し、進化の過程で選択され、発症に至るまでの過程を捉えることに成功しました。また、遺伝子変異はATL細胞の性質に大きく影響するため、変異に対応した治療法の開発が重要であることも明らかになりました。研究グループは、DNAの変異や細胞の構成を高精度に分析する解析技術を開発し、早期に感染細胞やがん細胞を検出できるようになりました。
がんの進化に共通するメカニズムの一端を明らかにした本発見の社会的意義は大きく、今後のがん研究や感染症研究のさらなる発展に貢献すると期待されます。また、日本に約100万人と推定されるHTLV-1キャリアの早期診断や、平均生存期間が数カ月と極めて治療が難しいATLに対するより良い治療法の開発にもつながると期待されます。
本研究成果は、科学雑誌「Nature Communications」2021年8月10日版に掲載されました。
発表内容
がんは不均一な集団で構成されています。前がん状態の細胞集団の一部が増殖に有利な遺伝子変異を獲得すると、個体内で選択され(クローン選択)、悪性度が高いがん細胞へと進化します。これまで、がんの発生から進化までの過程を正確に捉えることは困難でした。その最も大きな理由は、健康な方から微細な前がん状態の細胞を捉えるという検出技術および検体収集における課題があったことです。今回対象とした、ヒトT細胞白血病ウイルスI型(HTLV-1)の感染は、多段階発がん過程の最初の異常であり、感染細胞(=前がん細胞)から時系列に沿ってトレースすることで、多段階発がん過程の初期から最終期までを紐解ける可能性があります。
HTLV-1は、主に T細胞に感染し、ウイルス遺伝子産物によって宿主のシグナル伝達経路や遺伝子発現パターンを撹乱することで、感染初期に無数の不死化した感染クローンを出現させます。その後、30~50年以上かけてさまざまな異常を蓄積した特定の感染細胞が増殖し、感染者の3~5%が成人T細胞白血病リンパ腫(ATL)を発症します。ATLは造血器腫瘍(白血病やリンパ腫)で最も予後が悪い病型に分類され、有効な治療法は確立されておらず、診断からの平均生存期間が数カ月と極めて治療が難しい疾患です。わが国におけるHTLV-1感染者は約100万人以上と推定され、今後数万人がATLを発症すると予想されています。この難治な血液疾患に対する医療を向上していくためには、HTLV-1に感染した細胞がどのように悪性度が高いATL細胞へと進化していくのかを明らかにし、その特性を理解して治療へ結びつける必要があります。
東京大学大学院新領域創成科学研究科の山岸誠特任講師、内丸薫教授、鈴木穣教授らの研究グループは、細胞を1つずつ分離してDNAやRNAを分析する「シングルセル解析技術」を駆使して、HTLV-1に感染した細胞がどのようにATL細胞へ進化するかを解析しました。
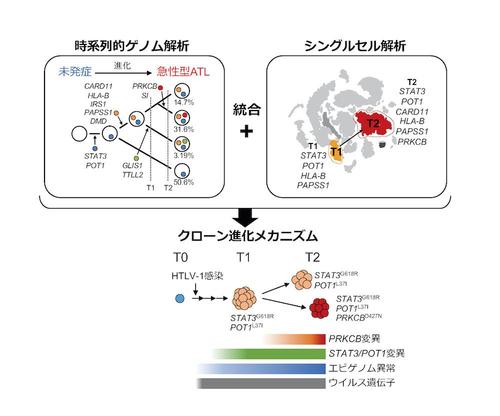
その結果、発症前から特定の遺伝子が変異したさまざまな感染細胞が混在し、その後さらにDNAに変異が蓄積し、悪性度の高い腫瘍細胞に進化した細胞が個体内で選択され、発症に至るという過程を検出することに成功しました(図)。これにより、長い潜伏期間にドライバー変異(注5)と呼ばれる腫瘍原性の強い変異を獲得したクローンでは、複数のシグナル伝達経路を活性化させ、細胞増殖能を高める遺伝子発現が急激に増加することで、悪性度が高いATL細胞へと進化していく過程を経ることが明らかになりました。
(図)ゲノム解析とシングルセル解析を組み合わせて明らかになった、クローン進化メカニズムの一例
興味深いことに、感染細胞は遺伝子変異を段階的に獲得していくために、変異パターンの異なる多様な細胞集団を構成し、クローン同士が競合しながらより悪性度の高い細胞へと進化していくこと、さらにこの多様性が治療後の早期再発に関わることも判明しました。シングルセル解析技術を用いることで、性質の異なる集団の構成を正確に分析し、クローン間で競合するメカニズムを捉えることにも成功しました。加えて、競合するクローン同士で共通する遺伝子発現パターンも検出され、主にエピジェネティックな機構によって誘導されていることも明らかにしました。これらの研究成果から、クローン進化過程における「ドライバーとしてのゲノム異常」と「背景としてのエピゲノム異常(注6)」による複合的な腫瘍化メカニズムが明らかになりました。
本研究は、無症候のHTLV-1キャリアの方々にご協力いただき、発症前のHTLV-1に感染した細胞集団から悪性度が高い腫瘍細胞へと進化する連続的な過程をゲノム、エピゲノムの両側面から解析し、複雑でヘテロな集団の形成過程、集団に潜む共通する特性、クローン選択と進化のメカニズムに関する新たなデータを得ることに成功しました。これは、HTLV-1感染症の発症メカニズムを同定しただけでなく、がんの進化の過程を明らかにするための、大きな一歩であると考えられます。
※本研究開発は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業、新興・再興感染症研究基盤創生事業、革新的がん医療実用化研究事業事、創薬基盤推進研究事業の支援によって実施されました。
発表雑誌
雑誌名:「Nature Communications」(オンライン版:8月10日)
論文タイトル:Chronological genome and single-cell transcriptome integration characterizes the evolutionary process of adult T cell leukemia-lymphoma
著者:Makoto Yamagishi, Miyuki Kubokawa, Yuta Kuze, Ayako Suzuki, Akari Yokomizo, Seiichiro Kobayashi, Makoto Nakashima, Junya Makiyama, Masako Iwanaga, Takahiro Fukuda, Toshiki Watanabe, Yutaka Suzuki*, Kaoru Uchimaru*
DOI番号 :https://doi.org/10.1038/s41467-021-25101-9
用語解説
(注1)ヒトT細胞白血病ウイルス1型(HTLV-1):
我が国に約100万人の感染者が存在すると推定されている。母乳や性交渉によって感染する。感染者の一部で重篤な白血病(ATL)や慢性炎症性疾患(HTLV-1脊髄症、HTLV-1ブドウ膜炎等)を発症する。
(注2)成人T細胞白血病リンパ腫(ATL:Adult T-cell Leukemia-lymphoma):
HTLV-1キャリアの約5%で発症する重篤な白血病リンパ腫。年間約1100人が発症し、ほぼ同数が毎年ATLで死亡している。有効な化学療法が確立しておらず、患者の約半数は発症後1年以内に死亡する。抗体療法、血液幹細胞の移植療法等が試みられている。
(注3)シングルセル解析:
細胞を1つずつ物理的に分離し、1細胞レベルで遺伝子の発現レベルやDNAの解析を行う技術。細胞集団の平均的な解析ではなく、個々の細胞の変化を動的に追うことで、少ない細胞集団や不均一な集団に対する高解像の解析が可能になる。
(注4)HTLV-1キャリア:
HTLV-1に感染した人。 HTLV-1のゲノムDNA(プロウイルス)を持ったT細胞が体内に存在するが、多くの人は無症状。一部のキャリアがATLを発症する。
(注5)ドライバー変異:
がんの発生や悪化の直接的な原因となる遺伝子変異。ドライバー変異を獲得した細胞は、周りの細胞よりも増殖能、転移能などが増加することで、個体内のクローン選択を経て、悪性度が高いがん細胞へと進化する。
(注6)エピゲノム異常:
DNAの配列の変化を伴わない後天的な遺伝子の変化を誘導する分子メカニズムの異常。エピゲノムはDNAやそれを取り巻くヒストン分子の化学修飾の総称を指す。