2022-02-10 京都大学iPS細胞研究所,日本医療研究開発機構
ポイント
- 6型コラーゲンが欠損して発症する筋ジストロフィー:ウルリッヒ型先天性筋ジストロフィー(UCMD)注1)のマウスモデルにiPS細胞由来間葉系間質細胞(iMSC)注2)を全身投与したところ、細胞組織の病態の改善および運動機能の改善を確認できた。
- 細胞組織における病態の改善は、iMSC移植による筋再生の促進、筋細胞のアポトーシス注3)抑制、ミトコンドリア異常注4)の改善が寄与していることを見出した。
- 本研究成果はiMSCの全身投与がUCMDの治療法となりうることを示している。
要旨
ウルリッヒ型先天性筋ジストロフィー(UCMD)は、6型コラーゲンが欠損して発症する運動器疾患で、先天性の筋萎縮による筋力低下や関節拘縮などの症状により運動機能が著しく制限される遺伝性の難病です。現在、治療法の開発が進んでおらず、新規治療法の確立が期待されています。
これまで京都大学iPS細胞研究所(CiRA)臨床応用研究部門の櫻井英俊准教授の研究グループは、iPS細胞由来間葉系間質細胞(iPSC-derived Mesenchymal Stromal Cell, iMSC)をUCMDモデルマウス骨格筋に局所投与することで6型コラーゲンが補充され、再生不全状態にあった骨格筋において、再生筋線維注5)の成熟化が促進され、筋芽細胞注6)数も増加していることを明らかにしました(CiRAニュース:2021年8月24日「6型コラーゲンを補う細胞移植がウルリッヒ型先天性筋ジストロフィーモデルマウスの病態を改善する」)。しかしながら、これらはあくまで局所投与による移植部位に限られた効果であり、運動機能の改善効果までは検証できていませんでした。
今回、原田文研究員(CiRA臨床応用研究部門)、櫻井准教授らの研究グループは、全身投与の効果を検証するため、UCMDモデルマウスの新生仔にヒトiMSCを腹腔内投与し、iMSCが全身へ分布することを確かめました。また、組織学的にも、移植したiMSCが生着し、6型コラーゲンの発現が回復していることを確認しました。移植後UCMDモデルマウスにおいて後肢の筋重量の増大、大腿四頭筋の筋線維径の増大を認め、線維化注7)面積は有意に縮小したことを確かめました。さらに、これらの病態改善効果は、筋再生の促進、筋細胞のアポトーシス抑制、ミトコンドリア異常の改善などのメカニズムを介していることを明らかにしました。最後に、運動機能評価によって、筋力の増加、握力の改善、そして持久力の改善が有意に認められました。
これらの結果はiMSCの全身投与がUCMDの治療法となりうることを示しています。
本研究成果は2021年11月23日にスイス科学雑誌Frontiers Cell and Developmental Biologyでオンライン公開されました。
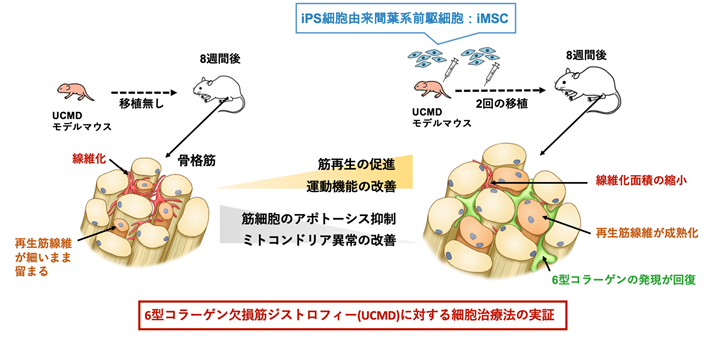
研究成果の概要図
研究の背景
UCMDは6型コラーゲンの欠損によって起こる、命に関わる遺伝性の運動器疾患です。先天性の筋萎縮により筋力の低下が早期にはじまり、結合組織や関節にも障害が起こります。UMCDに罹患した骨格筋を調べると、再生筋線維が細く、細胞外マトリックス注8)が線維化している現象がみられます(研究成果の概要図左参照)。現在、UCMDの治療法の開発は進んでおらず、新規治療法の確立が期待されています。
これまで本研究グループは、6型コラーゲン遺伝子を持たないUCMDのモデルマウスを使った実験法を確立しています。6型コラーゲンは骨格筋に存在する間葉系間質細胞から分泌されることから、UCMDのモデルマウスの骨格筋に、iMSCを局所投与したところ、6型コラーゲンが補われ、筋肉の再生や成熟が起こることを確かめました。しかし、再生した筋肉がどの程度機能するかは、さらなる検証を行う必要がありました。また、これまでに得られた結果は、あくまで局所投与による移植部位に限られた効果であり、広範囲の筋肉で同様の筋再生が起こるかは確かめられていませんでした。
そこで今回、全身投与の効果を検証するため、UCMDモデルマウスの新生仔にiMSCを腹腔内投与し、組織学的な検証と、運動機能の効果を確かめる実験を行いました。前回の局所投与における移植実験は生後4-6週間目のUCMDモデルマウスを用いていましたが、今回生後2日後の新生仔に移植することで、より少ないiMSCの移植によって、早期の骨格筋発達における生理学的な効果を得ることが期待されました。
研究結果
1) iMSC腹腔内投与後における検証
まず、iMSCに緑色発光タンパク質であるルシフェラーゼタンパクを搭載し、iMSCが腹腔内投与後全身へ分布するか調べました(図1 a)。UCMDモデルマウスの生後2日目の新生仔に500万個のiMSCを腹腔内投与し経過観察したところ、移植したiMSCは24時間で上肢や下肢まで広く運ばれていることが分かりました。その後、iMSCの数は減少していき、移植後28日目以降は追跡が難しくなりました。
移植後の骨格筋を組織学的に調べると、移植後1週目において大腿四頭筋や横隔膜でiMSCが生着していることが分かり、移植後2週目には6型コラーゲンの発現が回復していることも観察できました。さらに、iMSCを移植しない場合は、成熟しなかった再生筋線維が、iMSC移植後4週目には成熟化していることも確認できました(図1 b)。
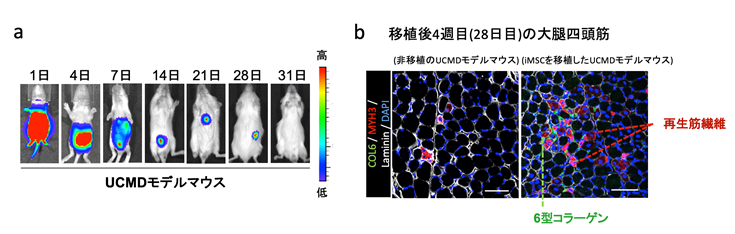
図1 UCMDモデルマウスへのiMSC腹腔内投与後における検証
- 移植したiMSCの体内分布についてin vivo イメージングシステム(IVIS)で評価した。iMSCの数が減少し28日以降は追跡できなかった。
- 移植後4週目におけるUCMDモデルマウスと非移植のUCMDモデルマウスの大腿四頭筋の組織学的検査。移植したマウスでは6型コラーゲンの発現(緑色)や成熟した再生筋線維(ピンク色)が観察できる。白色は細胞膜、青色は細胞核を示す。スケールバーは50μm。
移植後4週間で移植細胞数が大幅に減少することが分かったため、移植後4週目にもう一度500万個のiMSCを腹腔内投与し、さらなる経過観察を行いました。1度目の移植後8週目(2度目の移植後4週目)の大腿四頭筋を調べると、組織学的な病態の改善はさらに際立っていることが観察でき、筋肉量や筋線維の大きさが増加していることが分かりました。さらに、移植しない場合に顕著に現れていた線維化部分が、移植後8週目において有意に縮小していることも観察できました(図2)。
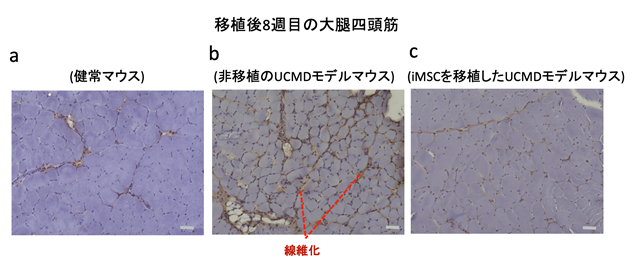
図2 移植後8週目(2度目の移植後4週目)における大腿四頭筋免疫組織化学染色により、線維化部分は茶褐色で示される。bで際立って見えている線維化面積は、移植後8週目のcでは減少していることが見える。スケールバーは50μm。
2)iMSCの移植により、筋細胞のアポトーシス抑制とミトコンドリア異常の改善が起こる。
iMSCの移植により、組織学的な病態改善効果が見られましたが、そのメカニズムについては筋再生の促進の他、筋細胞のアポトーシス抑制やミトコンドリア異常の改善が考えられます。
筋細胞のアポトーシスの細胞数を数えたところ、移植後4週目の前脛骨筋において非移植群と比較してアポトーシスを起こしている細胞数が少ないことが確認されました(図3)。これは、iMSCの移植により筋細胞のアポトーシスが抑制されていることを示唆します。
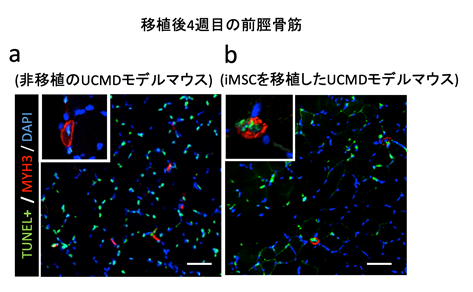
図3 iMSC移植による筋細胞のアポトーシス抑制iMSCを移植後4週目のUCMDモデルマウスの前脛骨筋で免疫蛍光染色を行うと、アポトーシスを示す緑色の細胞が非移植群に比べ減っていることが分かる。赤色は再生筋線維、青色は細胞核を示す。スケールバーは50μm。
さらに、ミトコンドリア異常についても調べてみると、非移植群では筋線維の間に異常な形状のミトコンドリアが多く見られましたが、移植後8週目の大腿四頭筋においてはそういった異常なミトコンドリアはほとんど見られませんでした(図4)。同様の結果は、横隔膜の骨格筋でも見られました。
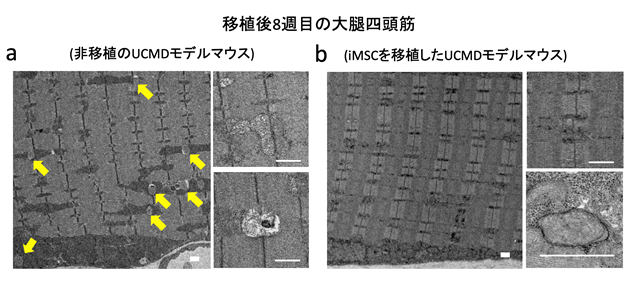
図4 iMSC移植によるミトコンドリア異常の改善UCMDモデルマウスの大腿四頭筋の電子顕微鏡画像。UCMDモデルマウスやUCMD患者の骨格筋では通常、膨れ上がった形状をした異常なミトコンドリアが観察される(aの黄矢印先部分)。iMSC移植後8週目の大腿四頭筋bでは、そのようなミトコンドリアはほとんど見られない。移植後のマウスでは正常なオートファジー注9)が起こっている像も確認できた(b 右下の写真)。スケールバーは1μm。
以上の結果から、iMSCの移植による細胞組織における病態改善には、筋再生に加え、筋細胞のアポトーシス抑制とミトコンドリア異常の改善が寄与していることが分かりました。
3)iMSC移植による運動機能評価
最後に、iMSCを移植したUCMDモデルマウスの運動機能がどのように改善されているかを調べました。iMSC移植後8週目のUCMDモデルマウスを評価すると、非移植群と比べ、筋力、握力、持久力が有意に増加していることが分かりました(図5)。
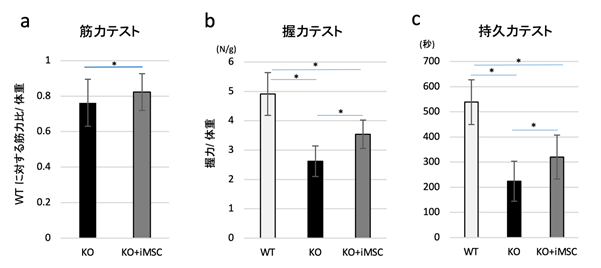
図5:iMSC移植後8週目のUCMDモデルマウスの運動機能評価
- 筋力テストは、マウスのふくらはぎの筋肉(腓腹筋)の最大筋張力を麻酔下に測定し、健常マウス(WT)との比率を体重で標準化し、非移植群(KO)とiMSC移植後のUCMDモデルマウス(KO+iMSC)を比べた。結果、iMSC移植後のUCMDモデルマウスでは非移植群と比べ筋力増加を示唆する結果が得られた
- 握力テストにおいては、iMSC移植後のUCMDモデルマウスの握力が非移植群と比べると35%増加していることが確認できた。
- 持久力テストはロータロッド装置を用いて測定した。iMSC移植後のUCMDモデルマウスは、非移植群より長い時間早い速度を維持して走り続けることができた。
KO (n=13)、KO+iMSC (n=14)、 *:p<0.05の有意差を示す。
本研究の意義と今後の展望
本研究では、UCMDモデルマウスにiMSCを全身投与し、その移植効果を検証しました。すると、これまでの局所投与の実験結果と同様、移植したiMSCが生着し、6型コラーゲンの発現が回復されていることが確認でき、補充された6型コラーゲンにより筋再生が促進されていることが分かりました。今回、さらに運動機能の改善といった移植効果も新たに報告することができました。これらの成果は、iMSCの細胞移植が、特に新生児や乳幼児の段階において、UCMDの治療法となりうる初歩的な実証となります。
今回、マウスの新生仔を扱ったため腹腔内投与による細胞移植でしたが、ヒトへの臨床応用を考えると動脈内投与を検討する必要があります。また、今回の実験により、移植したiMSCが長く骨格筋に留まることが分かったため、安全性を調べるためには長期の観察期間が必要であることが分かりました。今後、臨床応用に向けて、より大きな実験動物を用いて動脈注射による投与法の検討と、長期間の有効性・安全性の検証が必要です。
論文名と著者
- 論文名
- “Systemic supplementation of collagen VI by neonatal transplantation of iPSC-derived MSCs improves histological phenotype and function of Col6-deficient model mice”
- ジャーナル名
- Frontiers Cell and Developmental Biology
- 著者
- Aya Harada1*, Megumi Goto1, Atsuya Kato1, Nana Takenaka-Ninagawa1, Akito Tanaka1, Satoru Noguchi2, Makoto Ikeya1, Hidetoshi Sakurai1**
- 著者の所属機関
-
- 京都大学 iPS細胞研究所(CiRA)
- 国立精神・神経医療研究センター
- *筆頭著者、**:責任著者
- DOI
- 10.3389/fcell.2021.790341
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)特別研究員DC1(18J22274)
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「技術開発個別課題」「iPS細胞研究中核拠点」
用語説明
- 注1)ウルリッヒ型先天性筋ジストロフィー(UCMD: Ullrich congenital muscular dystrophy)
- 6型コラーゲンの遺伝子の変異が原因。生まれた直後から筋力が低く、筋萎縮の状態になる。肘・肩・膝などの関節が正常な範囲で動かなくなったり、手足の関節が過剰に伸びた状態になる。
- 注2)間葉系間質細胞(MSC: Mesenchymal stromal cells)
- 体内にもともと存在している、骨・脂肪・軟骨などへと分化する能力をもつ幹細胞の一種。本報では、体外でiPS細胞から作製したMSCをiMSCとする。
- 注3)アポトーシス
- 細胞死の1つで、細胞内の何らかの異常に反応して起こるプログラムされた細胞死。UCMDの患者やUCMDモデルマウスでは筋細胞のアポトーシスが起こっていることが確認されている。
- 注4)ミトコンドリア異常
- 細胞に必要なエネルギーを合成する細胞小器官であるミトコンドリアが、異常な形態や密度で発生すること。UCMDの患者やUCMDモデルマウスの骨格筋でミトコンドリア異常があることが確認されている。
- 注5)再生筋線維
- 骨格筋の組織は、筋線維という複数の核を持つ筒状の細胞から構成される。通常、成体の筋線維は太く成熟した状態で存在するが、筋損傷や筋ジストロフィーなどの病的な骨格筋では、筋線維が損傷すると筋再生が誘導されて後述する筋芽細胞が集まり細い再生筋線維を形成する。筋再生が順調に進行すると再生筋線維も太く成熟化して再生が完了するが、UCMDの患者やUCMDモデルマウスでは再生筋線維の成熟化が進まず、細いまま留まることが知られている。
- 注6)筋芽細胞
- 筋線維の外側にはサテライト細胞と呼ばれる幹細胞が張り付いており、この細胞が分裂して筋肉の修復や増強を行っている。筋芽細胞は、サテライト細胞が活性化されて筋細胞の前駆細胞となった状態である。
- 注7)線維化
- 細胞間のコラーゲン性の集合体が過剰に蓄積し、本来の機能を発揮できず硬くなった状態。
- 注8)細胞外マトリックス
- 細胞間の隙間を埋める生体高分子の集合体。骨・軟骨、歯、皮膚などに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
- 注9)オートファジー
- 細胞自身が、細胞内のタンパク質を分解するしくみのひとつ。自食ともいわれる。
お問い合わせ先
研究・報道に関すること
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
AMED事業に関すること
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課


